三阴性乳腺癌的临床病理特征及分子研究进展
2013-06-09
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
三阴性乳腺癌的临床病理特征及分子研究进展
周淑玲 杨文涛
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032

杨文涛,复旦大学附属肿瘤医院病理科副主任,主任医师,硕士生导师。1999年7月获得博士学位,1998年9月至1999年2月获国际抗癌联盟(UICC)资助在德国法兰克福大学医学院病理系担任访问学者。2000年9月至2002年3月在美国M.D.Anderson癌症中心进行博士后研究。长期从事肿瘤病理诊断和研究工作,擅长乳腺和妇科病理诊断。现任中华医学会病理分分会青年委员会副主任委员、中国抗癌协会乳腺癌专业委员会青年委员、上海市抗癌协会肿瘤病理专业委员会常委、上海市抗癌协会乳腺癌专业委员会常委、上海市医学会病理专业委员会委员、上海市医学会临床受体委员会委员,兼任《中华病理学杂志》、《诊断病理学杂志》、《临床与实验病理学杂志》编委,同时任国家自然科学基金评审专家。已发表论文近50篇,参编著作近10部,获得国家级、省部级等课题多项。曾获得教育部新世纪优秀人才、上海市优秀医学青年、上海市青年科技启明星、复旦大学十大医务青年等荣誉。
三阴性乳腺癌(triple negative breast cancer,TNBC)是具有特殊生物学及临床病理学特征的乳腺癌亚型,以雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均不表达为主要特征。该型乳腺癌组织学分级较高,侵袭性强,除浸润性导管癌外,还包括一些特殊的组织学亚型。TNBC的免疫表型和分子特征与基底样乳腺癌(basal-like breast cancer,BLBC)存在一定相似性。与其他亚型乳腺癌相比,TNBC因缺乏相应靶点而失去了内分泌和靶向治疗的机会,目前以蒽环类为基础的化疗为主,但疗效欠佳,早期局部复发和远处转移率较高,无病生存和总生存率较低,预后较差。同时该组肿瘤具有高度异质性,虽然免疫表型均为三阴性,但形态学、预后及对治疗的反应有很大差别。近年来,TNBC受到乳腺癌临床和病理学界的广泛关注,针对其分子分型以及多种信号通路的靶向药物得到广泛研究。
三阴性乳腺癌;病理;分子分型
乳腺癌是一种具有高度异质性的肿瘤,即使临床与病理分期相同的乳腺癌,其生物学行为以及对治疗的反应和预后可以截然不同。近年来,随着cDNA微阵列和多基因RT-PCR定量检测等分子生物学技术的发展,人类对乳腺癌的分类已经由传统的形态学分类转向分子分类。Perou等[1]根据基因表达谱研究将乳腺癌分为4个分子亚型,其中基底样乳腺癌(basal-like breast cancer,BLBC)亚型多数表现为ER、PR、HER-2阴性。不同分子分型乳腺癌的治疗方案以及预后差异均有统计学意义,因此,乳腺癌分子分型对于判断预后和指导临床治疗的作用越来越重要。ER、PR、HER-2均不表达的三阴性乳腺癌(triple negative breast cancer,TNBC),其临床复发早,进展快,生存短,且治疗手段有限,因而引起医学界的广泛关注,成为乳腺癌临床和病理研究的热点之一。
1 乳腺癌的分子分型
2000年,Perou等[1]根据基因表达谱差异将乳腺癌分为4个分子亚型:腔面型、HER-2过表达型、基底样型和正常乳腺样型。后续的研究发现,“正常乳腺样型”可重复性较差可能是样本质量欠佳而导致的人工假象[2]。2001年,Sorlie等[3]进一步将腔面型乳腺癌分为腔面A型和腔面B型两类,该研究是对前期乳腺癌分子分型的补充。迄今为止,被公认的乳腺癌分子分型主要有4类:腔面A型、腔面B型、HER-2过表达型和基底样型。由于基因表达谱分析技术对标本要求高,需要新鲜组织,且检测价格昂贵,实际操作困难,因此很难在临床广泛应用,所以在日常工作中多采用免疫组化的方法与各分子亚型大致对应。2011年St. Gallen乳腺癌共识[4]对乳腺癌各分子亚型在免疫组化水平上进行定义:腔面A型[ER和(或)PR(+)、HER-2(-)、Ki-67低表达(<14%)]、腔面B型[分为HER-2(+)和HER-2(-)。HER-2(-):ER和(或)PR(+)、HER-2(-)、Ki-67高表达(≥14%);HER-2(+):ER和(或)PR(+)、HER-2(+)、Ki-67任何水平]、HER-2过表达型[ER(-)、PR(-)、HER-2(+)]以及三阴性型[ER(-)、PR(-)、HER-2(-)]。
2 TNBC的分子特征
TNBC是基于免疫组化染色ER、PR和HER-2表达均为阴性的乳腺癌。虽然TNBC与BLBC组织形态、免疫表型、临床表现方面有很多相似之处,但它是由不同基因表达谱组成的异质性肿瘤;而BLBC的确诊主要通过基因芯片,该疾病是由肿瘤标志物以及分子特征完全一致的同质性肿瘤组成。二者的基因表达谱有近80%的重叠[4]。据文献报道,约77%的BLBC免疫表型为三阴性[5-6],6%~29%分子分型为BLBC者表现为ER/PR阳性或者HER-2阳性,而并不表现为三阴性[3,6-7]。TNBC也不能简单的归类于任何一种分子亚型,多达40%的TNBC可以不表达任何基底样标志物[8],有50%~75%的TNBC经cDNA微阵列分析可归为BLBC[9]。2013年,Prat等[10]基于12个中心的基因芯片数据以及相应激素受体和HER-2表达情况,运用PAM50基因预测模型[11]对乳腺癌进行分子分型,其中412例免疫表型为三阴性的乳腺癌中,78.6%分子亚型为基底样,7.8%为HER-2过表达,6.6%为腔面型,7.0%为正常乳腺样。因此,TNBC和BLBC的基因表达谱并不完全相同,二者之间的相关性还有待于进一步研究。
3 TNBC的临床特点及预后
TNBC占所有乳腺癌的10%~20%[12-13],多见于年轻女性(<50岁),尤其是伴有BRCA基因突变的女性[12]。这类特殊类型乳腺癌具有高度侵袭性,目前治疗以蒽环类为基础的化疗为主,但疗效不佳,早期局部复发和远处转移率较高,无病生存率和总生存率较低,预后较差[7,11-12]。Dent等[12]的研究显示,5年随访发现TNBC的远处转移率显著高于非三阴性乳腺癌(non-TNBC,33.9% vs 22.4%),在治疗后1~3年内为复发高峰期,大多数患者死于治疗最初的5年。但对患者进行10年随访观察发现,TNBC和其他类型乳腺癌之间的差异逐渐缩小,而non-TNBC远处转移风险在随访过程中一直存在。Rakha等[14]报道 TNBC 转移容易发生在骨髓、脑、肝、肺,内脏转移率高于骨转移。
4 TNBC的病理学特点
4.1 TNBC的形态学特征
TNBC大多为高级别非特殊类型浸润性导管癌,形态特征与BLBC高度一致。镜下,该肿瘤以推挤性生长方式为主,但肿瘤与周围组织分界较为清楚。肿瘤多呈现弥漫实性片状结构。肿瘤细胞呈合体细胞样,界限不清,组织学分级多为Ⅲ级,可见巨核及奇异核。核分裂象多见,核质比增大。间质有不同程度的淋巴细胞浸润,并可见肿瘤细胞化生(包括鳞状化生和大汗腺化生)。TNBC的坏死率较高,以大片地图样坏死和中央性坏死为主。但上述特征并不一定出现在每个病例中。
4.2 TNBC中的特殊组织学类型
TNBC是一组在形态学上具有高度异质性的肿瘤,除高级别浸润性导管癌外,化生性癌、髓样癌、分泌型癌、腺样囊性癌、低度恶性腺鳞癌等也可显示三阴性表型。虽然从免疫表型上这些肿瘤均为TNBC,但是形态学及预后有着非常大的差别。
部分TNBC预后非常好,如分泌型癌、腺样囊性癌、低度恶性腺鳞癌等。分泌型癌占所有乳腺癌0.01%,多发生于未成年人和50岁以下女性[15-16],该型乳腺癌预后极好。Horowitz等[17]对83例乳腺分泌型癌患者进行了随访,中位随访时间为70个月,5年总生存率为87.2%,10年总生存率为76.5%,83例中仅1例死于该肿瘤。腺样囊性癌占所有乳腺癌的比率不足0.1%,平均年龄64岁。该肿瘤很少发生腋窝淋巴结转移,预后较好[18-19]。Montagna等[20]的研究中,腺样囊性癌的5年无病生存率和总生存率均为100%。低度恶性腺鳞癌是化生性癌中的一种特殊类型,最早由Johnson等[21]报道。发病年龄20~85岁(平均53岁)[22],大部分预后良好,但一些病例具有局部侵袭性[23],淋巴结转移极少见。
TNBC中还有部分预后极差的病理亚型,如中央坏死性乳腺癌、分泌基质的癌。中央坏死性乳腺癌占所有乳腺癌的2%~3%[24],多发生于中老年妇女[24-25],侵袭性强,临床进展快,预后较差。Jimenez等[25]研究报道,中央坏死性乳腺癌的疾病无进展期和中位生存期分别为17.9个月和35.5个月,大多数病例发生了肺和中枢神经系统的转移,并且比分化差的浸润性导管癌预后差(P<0.004)。Yu等[26]的研究报道,中央坏死性乳腺癌的平均和中位疾病无进展期分别为17.8个月和14个月,63.2%的病例发生了远处转移。分泌基质的癌是化生性癌中的少见类型,占所有乳腺癌比例<1%,其局部复发和远处转移率较高[27]。最新研究的报道,该肿瘤9年局部无复发生存率和无远处转移生存率分别为57%、56%,5年生存率为55%[28]。
5 TNBC的分子研究进展
2010年,Perou[9]基于现有的基因芯片数据,对TNBC进行了基因表达谱的聚类分析,报道了TNBC中可以分出Claudin-low分子亚型,开启了对三阴性乳腺癌进一步进行分子分型的研究。2011年,Lehmann等[29]对587例TNBC的21组基因表达谱数据进行聚类分析,发现TNBC可进一步分为6种亚型,包括2种基底样亚型(BL1和BL2)、免疫调节亚型(IM)、间充质亚型(M)、间充质干细胞样亚型(MSL)以及管腔雄激素受体亚型(LAR)。这6种亚型呈现独特的基因表达谱,且与不同的信号转导通路相关。BL1和BL2亚型高表达细胞周期相关基因和DNA损伤反应基因,Ki-67的mRNA以及蛋白均高表达。另外,BL2亚型与多种生长因子信号通路相关,高表达生长因子受体基因,如EGFR、MET和EPHA2。BL1亚型TNBC与BLBC基因表型一致率较高(85%),而BL2亚型仅有31%的一致性。IM亚型与免疫细胞浸润信号通路相关。这一亚型与具有显著淋巴细胞浸润的髓样癌有部分重叠[30]。M亚型和MSL亚型与之前报道的claudin-low乳腺癌有共同特征[31]。M和MSL亚型中多种基因表达上调,包括细胞运动(Rho通路)、细胞分化、生长因子转导和上皮-间质转化等多种相关基因,虽然这两种亚型相关的转导通路有部分差异,但形态学上都表现为化生性癌的特征。LAR亚型以雄激素受体信号通路高表达为特点。该亚型不表达ER,但是激素相关通路基因高表达,其中雄激素受体基因在该亚型中的表达较其他亚型平均高出9倍。同时该亚型表达腔面型基因(如FOXA1、KRT18、XBP1),高达82%的LAR亚型基因表型为腔面A型或腔面B型。该研究进一步证实,LAR亚型与已经报道的高表达AR相关基因的乳腺癌及大汗腺分子亚型乳腺癌均为同一种亚型[32-33]。2012年,Shah等[33]发表了关于TNBC基因克隆谱和突变谱的报道,其中p53、PTEN/PIK3CA通路突变率最高。同时,最新发表在Nature上的乳腺癌TCGA(The Cancer Genome Atlas)数据也支持上述观点[33-34]。PIK3CA/PTEN 通路在BLBC中PTEN基因(35%)和INPP4B基因(30%)呈不同比例的缺失,而这两个基因的缺失可激活PI(3)K/AKT通路,从而使该通路成为PI(3)K抑制剂在TNBC中的潜在治疗靶点。上述研究将对TNBC的靶向治疗起到非常重要的推动作用。
由于TNBC基因表型的异质性,导致其组织学形态、治疗反应和预后均有明显差异。针对这组患者采用同样的治疗方法与肿瘤个体化治疗的原则不符。基于TNBC分子分型的研究成果,TNBC的治疗得到了进一步发展。Lehmann等[29]研究发现,BL1和BL2亚型对铂类治疗较敏感,PI3K/mTOR抑制剂(NVP-BEZ235)还可增加铂类药物的有效性,但是对于PARP抑制剂,只有伴有BRCA1突变的基底样亚型细胞株具有对该抑制剂的敏感性。M和MSL亚型与上皮-间质转化和生长因子转导通路相关,对PI3K/mTOR抑制剂(NVP-BEZ235)和abl/Src抑制剂(dasatinib)可能有治疗反应。LAR亚型对雄激素受体拮抗剂(比卡鲁胺)敏感。此外,LAR亚型的5个细胞系均检测到PI3K基因突变,因此同样对PI3K/mTOR抑制剂(NVP-BEZ235)有敏感性。AR和PI3K/mTOR信号转导通路将为LAR亚型治疗的研究提供了新的靶点。IM亚型的提出为TNBC免疫治疗提供了新的方向。近期研究提出肿瘤淋巴细胞浸润(tumor-infiltrating lymphocytes,TILs)这一新的概念,并且在多种上皮型肿瘤中TILs对于控制疾病进展显示出重要意义[35-37]。一项大型前瞻性临床试验的研究结果显示,TILs可降低TNBC患者的局部复发率,具备50%以上TILs的TNBC患者5年无病生存率达89%,相对于激素受体阳性的患者(62%)差异有统计学意义(P=0.018),这种相关性与TNBC患者选择的化疗方案无关[38]。除此之外,其他免疫治疗手段(如免疫刺激疗法、肿瘤疫苗等)也有十分广阔的前景。基于以上数据,细胞和分子免疫治疗为TNBC患者提供了新的潜在治疗选择。
总之,TNBC是近年来乳腺癌研究领域的热点,由于缺乏相应靶点,治疗选择少,因此对该群体的研究非常重要。Lehmann等[29]对TNBC基因表达谱研究,将其分为6个不同的分子亚型,并通过干细胞系研究初步得到各亚型的敏感药物。但是TNBC各亚型基于基因表达谱分析,治疗反应来源于细胞系研究,一些研究结果还无法应用到临床实践。一些针对TNBC的靶向治疗新药(如西妥昔单克隆抗体、厄洛替尼、PARP抑制剂等)大多数还处于临床试验阶段,抗肿瘤疗效还有待证实。随着对信号转导途径研究的深入和更多靶向药物的出现,将会给TNBC患者带来更加个体化、更有针对性的治疗。
[1] PEROU C M, SORLIE T, EISEN M B, et al. Molecular portraits of human breast tumours [J]. Nature, 2000, 406(6797): 747-752.
[2] SORLIE T, TIBSHIRANI R, PARKER J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets [J]. Proc Natl Acad Sci U S A, 2003, 100(14): 8418-8423.
[3] SORLIE T, PEROU C M, TIBSHIRANI R, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications[J]. Proc Natl Acad Sci U S A, 2001, 98(19): 10869-10874.
[4] GOLDHIRSCH A, WOOD W C, COATES A S, et al. Strategies for subtypes--dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747.
[5] OAKMAN C, VIALE G, DI LEO A. Management of triple negative breast cancer[J]. Breast, 2010, 19(5): 312-321.
[6] GAZINSKA P, GRIGORIADIS A, BROWN J P, et al. Comparison of basal-like triple-negative breast cancer defined by morphology, immunohistochemistry and transcriptional profiles[J]. Mod Pathol, 2013, 26: 955-966.
[7] NIELSEN T O, HSU F D, JENSEN K, et al. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma[J]. Clin Cancer Res, 2004, 10(16): 5367-5374.
[8] DIALLO-DANEBROCK R, TING E, GLUZ O, et al. Protein expression profiling in high-risk breast cancer patients treated with high-dose or conventional dose-dense chemotherapy[J]. Clin Cancer Res, 2007, 13(2 Pt 1): 488-497.
[9] PEROU C M. Molecular stratification of triple-negative breast cancers[J]. Oncologist, 2011, 16(Suppl 1): 61-70.
[10] PRAT A, ADAMO B, CHEANG M C, et al. Molecular characterization of basal-like and non-basal-like triplenegative breast cancer[J]. Oncologist, 2013, 18(2): 123-133.
[11] GUIU S, MICHIELS S, ANDRE F, et al. Molecular subclasses of breast cancer: how do we define them? The IMPAKT 2012 Working Group Statement[J]. Ann Oncol, 2012, 23(12): 2997-3006.
[12] DENT R, TRUDEAU M, PRITCHARD K I, et al. Triplenegative breast cancer: clinical features and patterns of recurrence[J]. Clin Cancer Res, 2007, 13(15 Pt 1): 4429-4434.
[13] BAUER K R, BROWN M, CRESS R D, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER-2-negative invasive breast cancer, the so-called triple-negative phenotype: a populationbased study from the California cancer Registry[J]. Cancer, 2007, 109(9): 1721-1728.
[14] RAKHA E A, EL-SAYED M E, GREEN A R, et al. Prognostic markers in triple-negative breast cancer[J]. Cancer, 2007, 109(1): 25-32.
[15] OZGUROGLU M, TASCILAR K, ILVAN S, et al. Secretory carcinoma of the breast. Case report and review of the literature[J]. Oncology, 2005, 68(2-3): 263-268.
[16] GABAL S, TALAAT S. Secretory carcinoma of male breast: case report and review of the literature[J]. Int J Breast Cancer, 2011, 2011: 704657.
[17] HOROWITZ D P, SHARMA C S, CONNOLLY E, et al. Secretory carcinoma of the breast: results from the survival, epidemiology and end results database[J]. Breast, 2012, 21(3): 350-353.
[18] GHABACH B, ANDERSON W F, CURTIS R E, et al. Adenoid cystic carcinoma of the breast in the United States (1977 to 2006): a population-based cohort study[J]. Breast Cancer Res, 2010, 12(4): R54.
[19] SUMPIO B E, JENNINGS T A, MERINO M J, et al. Adenoid cystic carcinoma of the breast. Data from the Connecticut Tumor Registry and a review of the literature[J]. Ann Surg, 1987, 205(3): 295-301.
[20] MONTAGNA E, MAISONNEUVE P, ROTMENSZ N, et al. Heterogeneity of triple-negative breast cancer: histologic subtyping to inform the outcome[J]. Clin Breast Cancer, 2013, 13(1): 31-39.
[21] JOHNSON R L T. Two cases of squamous epithelial tumors of the breast[J]. Br J Surg, 1917, 5(4): 17-21.
[22] KAWAGUCHI K, SHIN S J. Immunohistochemical staining characteristics of low-grade adenosquamous carcinoma of the breast[J]. Am J Surg Pathol, 2012, 36(7): 1009-1020.
[23] VAN HOEVEN K H, DRUDIS T, CRANOR M L, et al. Low-grade adenosquamous carcinoma of the breast. A clinicopathologic study of 32 cases with ultrastructural analysis[J]. Am J Surg Pathol, 1993, 17(3): 248-258.
[24] TSUDA H, TAKARABE T, HASEGAWA F, et al. Large, central acellular zones indicating myoepithelial tumor differentiation in high-grade invasive ductal carcinomas as markers of predisposition to lung and brain metastases[J]. Am J Surg Pathol, 2000, 24(2): 197-202.
[25] JIMENEZ R E, WALLIS T, VISSCHER D W. Centrally necrotizing carcinomas of the breast: a distinct histologic subtype with aggressive clinical behavior[J]. Am J Surg Pathol, 2001, 25(3): 331-337.
[26] YU L, YANG W, CAI X, et al. Centrally necrotizing carcinomaof the breast: clinicopathological analysis of 33 cases indicating its basal-like phenotype and poor prognosis[J]. Histopathology, 2010, 57(2): 193-201.
[27] DOWNS-KELLY E, NAYEEMUDDIN K M, ALBARRACIN C, et al. Matrix-producing carcinoma of the breast: an aggressive subtype of metaplastic carcinoma[J]. Am J Surg Pathol, 2009, 33(4): 534-541.
[28] POOI M D. "Matrix-producing carcinoma of the breast"[J]. Am J Surg Pathol, 2010, 34(1): 125, 125-126.
[29] LEHMANN B D, BAUER J A, CHEN X, et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J]. J Clin Invest, 2011, 121(7): 2750-2767.
[30] BERTUCCI F, FINETTI P, CERVERA N, et al. Gene expression profiling shows medullary breast cancer is a subgroup of basal breast cancers[J]. Cancer Res, 2006, 66(9): 4636-4644.
[31] PRAT A, PARKER J S, KARGINOVA O, et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer[J]. Breast Cancer Res, 2010, 12(5): R68.
[32] DOANE A S, DANSO M, LAL P, et al. An estrogen receptornegative breast cancer subset characterized by a hormonally regulated transcriptional program and response to androgen[J]. Oncogene, 2006, 25(28): 3994-4008.
[33] SHAH S P, ROTH A, GOYA R, et al. The clonal and mutational evolution spectrum of primary triple-negative breast cancers[J]. Nature, 2012, 486(7403): 395-399.
[34] Comprehensive molecular portraits of human breast tumours[J]. Nature. 2012, 490(7418): 61-70.
[35] FRIDMAN W H, PAGES F, SAUTES-FRIDMAN C, et al. The immune contexture in human tumours: impact on clinical outcome[J]. Nat Rev Cancer, 2012, 12(4): 298-306.
[36] DENKERT C, LOIBL S, NOSKE A, et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer[J]. J Clin Oncol, 2010, 28(1): 105-113.
[37] MLECNIK B, TOSOLINI M, KIRILOVSKY A, et al. Histopathologic-based prognostic factors of colorectal cancers are associated with the state of the local immune reaction[J]. J Clin Oncol, 2011, 29(6): 610-618.
[38] LOI S, SIRTAINE N, PIETTE F, et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in a phase III randomized adjuvant breast cancer trial in nodepositive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin-based chemotherapy: BIG 02-98[J]. J Clin Oncol, 2013, 31(7): 860-867.
复旦大学继续医学教育项目办班课程表
办班单位: 复旦大学附属肿瘤医院《中国癌症杂志》编辑部
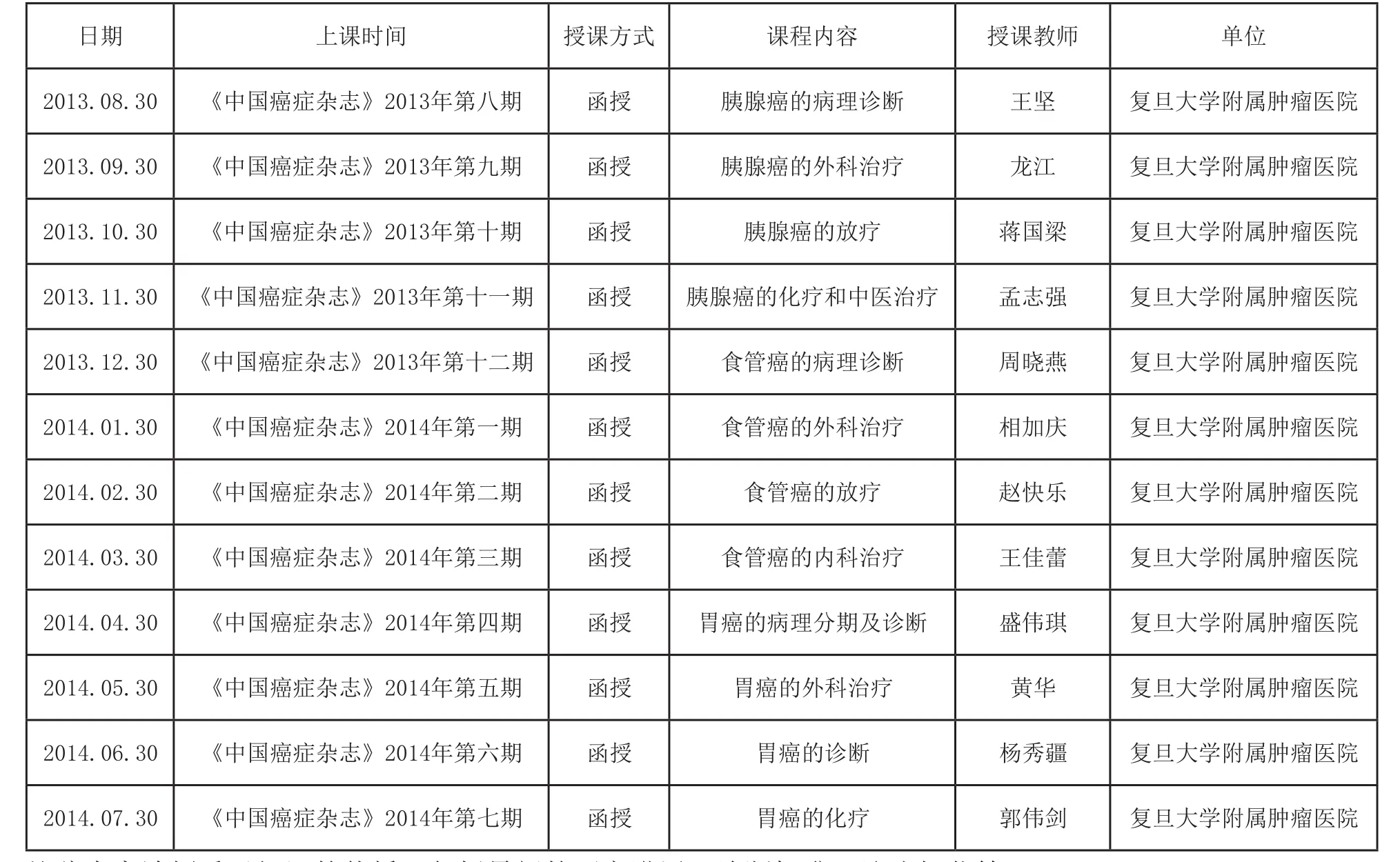
日期上课时间授课方式课程内容授课教师单位2013.08.30《中国癌症杂志》2013年第八期函授胰腺癌的病理诊断王坚复旦大学附属肿瘤医院2013.09.30《中国癌症杂志》2013年第九期函授胰腺癌的外科治疗龙江复旦大学附属肿瘤医院2013.10.30《中国癌症杂志》2013年第十期函授胰腺癌的放疗蒋国梁复旦大学附属肿瘤医院2013.11.30《中国癌症杂志》2013年第十一期函授胰腺癌的化疗和中医治疗孟志强复旦大学附属肿瘤医院2013.12.30《中国癌症杂志》2013年第十二期函授食管癌的病理诊断周晓燕复旦大学附属肿瘤医院2014.01.30《中国癌症杂志》2014年第一期函授食管癌的外科治疗相加庆复旦大学附属肿瘤医院2014.02.30《中国癌症杂志》2014年第二期函授食管癌的放疗赵快乐复旦大学附属肿瘤医院2014.03.30《中国癌症杂志》2014年第三期函授食管癌的内科治疗王佳蕾复旦大学附属肿瘤医院2014.04.30《中国癌症杂志》2014年第四期函授胃癌的病理分期及诊断盛伟琪复旦大学附属肿瘤医院2014.05.30《中国癌症杂志》2014年第五期函授胃癌的外科治疗黄华复旦大学附属肿瘤医院2014.06.30《中国癌症杂志》2014年第六期函授胃癌的诊断杨秀疆复旦大学附属肿瘤医院2014.07.30《中国癌症杂志》2014年第七期函授胃癌的化疗郭伟剑复旦大学附属肿瘤医院
约稿内容请侧重于知识的传播:包括最新的研究进展、诊断标准、治疗规范等。
Advance of clinicopathological and molecular research of triple negative breast cancer
ZHOU Shuling, YANG Wen-tao (Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YANG Wen-tao E-mail:yangwt2000@163.com
Triple negative breast cancer (TNBC) is characterized by the lack of expression of hormone receptors, as well as human epidermal growth factor receptor 2 and displays special biological and clinicopathological characteristics. This subtype is aggressive in nature with high histological grade. Besides invasive ductal carcinoma,several special histological types have also been found. The features of the TNBC subgroup roughly parallel those of the basal-like subgroup. Due to the lack of molecular targets, this subgroup has no chance of endocrine treatment and target therapy. Currently, the treatment of TNBC is dominated by chemotherapy based on anthracycline with suboptimal efficacy. Overall, the prognosis has remained quite poor. Emerging evidence indicates that patients regimens with triple negative breast cancer usually displays high rate of early recurrence and distant metastasis. Both the diseasefree survival and overall survival rates are low. Although this subtype which shows same immunohistologic pattern, great heterogeneity still exists within the group causing distinctions in morphology, prognosis, and more importantly, drastically different reactions to same treatment protocol. In recent years, TNBC has been widely concerned by both clinician and pathologist. Several targeted drugs for corresponding signal pathway as well as the subtype of triple negative breast cancer have been widely studied. This article focused on the advances in clinicopathological characteristics, new subtypes and treatment of triple negative breast cancer.
Triple negative breast tumor; Pathology; Molecular subtyping
10.3969/j.issn.1007-3969.2013.08.007
R737.9
:A
:1007-3639(2013)08-0603-06
2013-06-20)
杨文涛 E-mail:yangwt2000@163.com
