蛋白酶活化受体1活化或抑制对鼻咽癌细胞迁移侵袭及缝隙连接蛋白43表达的影响
2013-06-09张晓玲王涛彭纲张利玲李跃华李品东任精华
张晓玲王涛彭纲张利玲李跃华李品东任精华
1.华中科技大学同济医学院附属协和医院肿瘤中心,湖北 武汉 430022;
2.南华大学附属第一医院肿瘤内科,湖南 衡阳 421001
蛋白酶活化受体1活化或抑制对鼻咽癌细胞迁移侵袭及缝隙连接蛋白43表达的影响
张晓玲1王涛1彭纲1张利玲1李跃华2李品东1任精华1
1.华中科技大学同济医学院附属协和医院肿瘤中心,湖北 武汉 430022;
2.南华大学附属第一医院肿瘤内科,湖南 衡阳 421001
背景与目的:蛋白酶活化受体1(protease-activated receptor 1,PAR1)在肿瘤的侵袭转移中发挥重要作用,其在鼻咽癌中的作用机制尚不清楚。本文旨在检测PAR1活化或抑制对鼻咽癌细胞(CNE1-LMP1)增殖及侵袭的影响,并初探其机制。方法:选取高表达PAR1的CNE1-LMP1细胞系作为研究对象,首先采用四甲基偶氮唑盐(MTT)、划痕实验和Transwell侵袭实验分别检测PAR1特异性激动肽SFLLRN和特异性抑制剂SCH79797对CNE1-LMP1细胞增殖、迁移和侵袭的影响。然后应用实时定量PCR(real-time PCR)和蛋白质印迹法(Western blot)检测PAR1活化及抑制前后缝隙连接蛋白43(connexin43,Cx43) mRNA及蛋白表达情况,并比较组间表达差异。结果:与CNE1-LMP1细胞未处理组相比,PAR1特异性激动肽SFLLRN能够促进CNE1-LMP1细胞增殖、迁移和体外侵袭,同时发现Cx43 mRNA和蛋白量明显减少(P<0.05)。与CNE1-LMP1细胞未处理组相比,PAR1抑制剂SCH79797能明显抑制CNE1-LMP1细胞增殖、迁移和体外侵袭,并且发现Cx43 mRNA和蛋白量明显增高(P<0.05)。结论:活化PAR1能够促进鼻咽癌细胞系CNE1-LMP1的增殖、迁移和侵袭,减少Cx43 mRNA和蛋白表达,而抑制PAR1的表达能抑制鼻咽癌细胞系CNE1-LMP1的增殖、迁移和侵袭,增加Cx43 mRNA和蛋白表达。
鼻咽癌;蛋白酶活化受体1;侵袭;缝隙连接蛋白43;转移
鼻咽癌是我国南方地区最常见的恶性肿瘤之一,患者治疗失败的主要原因是局部复发和远处转移。因此,研究与鼻咽癌侵袭转移相关的分子标志可能为鼻咽癌的靶向治疗提供新的分子靶点。蛋白酶活化受体1(protease-activated receptor 1,PAR1)是G蛋白偶联受体家族主要成员之一,又称凝血酶受体,其被凝血酶或特异性人工合成多肽SFLLRN激活后,介导多种肿瘤细胞的生物学行为,如参与肿瘤细胞生长、侵袭、血管新生等多个环节和多条通路[1]。同时,近年来研究发现,PAR1高表达于乳腺癌、恶性黑色素瘤、前列腺癌、结肠癌、肺癌、口腔鳞状细胞癌、食管癌及肾细胞癌等恶性肿瘤,且其表达越高,这些肿瘤的侵袭转移力越强。而下调或者沉默PAR1的表达后,许多肿瘤的侵袭转移力减弱[2-6]。
间隙连接蛋白43(connexin43,Cx43)是构成缝隙连接通讯的重要组成成分,与肿瘤的发生、发展与转移密切相关[3]。许多研究显示,多种肿瘤组织表现为Cx43基因表达下降或缺失,导致细胞间缝隙连接通讯(gap junctional intercellular communication)中断[4]、细胞间的物质交换障碍,最终导致细胞增殖失控和分化异常,临床上常表现为肿瘤进展和转移。而恢复这些癌细胞的间隙连接功能或上调Cx43基因表达水平,它们表现出正常细胞的生物学表型,同时抑制肿瘤细胞生长。Villares等[5]研究已经证实在转移性恶性黑色素瘤中Cx43是PAR1下游的调控基因,且PAR1调节Cx43的表达发生在转录水平。且多项研究表明,缝隙连接蛋白Cx43与多种肿瘤细胞的生长、增殖有关,当其表达下降或缺失时,细胞过度克隆生长,促进肿瘤的转移。我们在前期研究的基础上[6],选用鼻咽癌细胞系CNE1-LMP1(高侵袭性,高转移性)作为研究对象,检测PAR1活化或抑制对鼻咽癌细胞CNE1-LMP1增殖、侵袭及Cx43的影响。
1 材料和方法
1.1 主要试剂和仪器
TRIzol Reagent试剂购自Aidlab, cDNA逆转录试剂盒(TransScript First-Strand cDNA Synthesis Super Mix)购自北京全式金生物技术有限公司,实时荧光定量PCR SYBR® Premix Ex Taq™ 购自TaKaRa公司,PCR引物由Invitrogen公司合成,蛋白质印迹法(Western blot)用的各种试剂购自Boster公司,Ecl plus和PVDF膜分别购自Thermo公司和Millipore,兔抗人Cx43多克隆抗体购自Cell Signaling Technology公司;兔抗人actin购自Santa cruz公司;HRP标记的抗兔IgG购自武汉谷歌生物科技有限公司,鼻咽癌细胞系(CNE1-LMP1)购自中南大学湘雅医学院中心实验室,应用RPMI-1640培养基(Hyclone)加10%胎牛血清(Hyclone),37 ℃、CO2体积分数为5%的培养箱培养。四甲基偶氮唑盐(MTT)购自Sigma公司,特异性PAR1激活肽SFLLRN购自ANASPEC公司,选择性PAR1抑制剂SCH79797购自TOCRIS公司[7]。
1.2 主要方法
1.2.1 细胞培养
人鼻咽癌细胞系CNE1-LMP1用含10%胎牛血清(FBS)的RPMI-1640培养液,置于37 ℃、CO2体积分数为5%的恒温培养箱中常规培养。
1.2.2 MTT法检测细胞生长和抑制
取处于对数生长期的鼻咽癌细胞系CNE1-LMP1,将其制成单细胞悬液并接种到96孔板中,待细胞贴壁后,用含不同浓度组的SFLLRN(细胞密度为2 000个/孔)或SCH79797(细胞密度为5 000个/孔)的1.5%血清培养基处理细胞,温育48 h后,每孔加入20 μL MTT(用PBS溶解成5 mg/mL) 溶液,37 ℃、CO2体积分数为5%的培养箱中继续培养4 h后,小心吸尽孔中的液体,每孔再加入DMSO 150 μL,摇床上震荡10 min。然后在酶标仪波长490 nm处读取每孔的吸光度值(A),实验重复3次。
1.2.3 Transwell体外侵袭实验
选用Transwell小室进行该实验,将实验前一天融化好的matrigel胶加入到小室中,每孔50 μL,放入37 ℃、CO2体积分数为5%的培养箱中,温育5 h后吸去小室中上清液,上室中加入用无血清培养基制成的终浓度为100 μmol/L 的SFLLRN或5 μmol/L的SCH79797细胞悬液200 μL处理细胞,细胞密度为20 000个/孔,下室中每孔加入含15%血清培养基600 μL,在培养箱中培养24 h后取出小室,4%多聚甲醛固定30 min后0.1%结晶紫染色,清水冲洗后用棉签擦净上室膜面的细胞,用倒置相差显微镜随机观察5个视野(×200),记数细胞取均值并照相。实验重复3次。
1.2.4 划痕实验
将处于对数生长期的CNE1-LMP1制成细胞悬液接种到6孔板,6孔板底部划好直线,调整细胞密度为2×105个/孔,摇匀后于37 ℃、CO2体积分数为5%的培养箱中常规培养过夜,待细胞贴壁后用1%血清培养基饥饿细胞24 h,然后用灭菌的200 μL微量移液枪枪头以直尺为参照沿培养板底部呈I字形垂直划痕,划痕后用PBS冲洗3次,以冲走划痕后的悬浮细胞,同时在实验组中分别加入用1.5%血清培养基配制的终浓度为100 μmol/L的SFLLRN或5 μmol/L SCH79797,对照组只加1.5%血清培养基。镜下记录划痕宽度并拍照。37 ℃、CO2体积分数为5%的培养箱中继续培养24 h,倒置显微镜下观察划痕愈合程度并拍照。
1.2.5 实时荧光定量RT-PCR
将处于对数生长期的CNE1-LMP1制成细胞悬液接种到6孔板,调整细胞密度为1×105个/孔,待细胞贴壁后用1%血清培养基饥饿细胞24 h后,在实验组中分别加入用1.5%血清培养基配制的终浓度为100 μmol/L的SFLLRN或5 μmol/L的SCH79797,对照组只加1.5%血清培养基。37 ℃、CO2体积分数为5%的培养箱中继续培养48 h,以TRIzol试剂提取各组细胞中RNA,按试剂盒说明书进行操作,然后按照逆转录试剂盒说明书将新提取的RNA逆转录为cDNA,实时荧光定量RT-PCR引物序列,Cx43引物上游[8]:5’-CCCGTGAGAACACCAAGT TT-3’,下游:5’-TCACTCCAGGGCATTTCTTC-3’;内参GAPDH引物上游:5’-GGTCGGAGTCAACGGATT TG-3’;下游:5’-GGAAGATGGTGATGGGATTTC-3’。按照试剂盒说明书体系,在相同PCR反应条件下扩增靶基因和内参[8]:95 ℃ 5 min预变性;95 ℃60 s,58 ℃ 60 s,72 ℃ 60 s,30个循环;72 ℃终延伸7 min。分析溶解曲线,计算Ct值,以GAPDH为参照物,采用2-ΔΔCT法分析各组Cx43 mRNA相对表达量。
1.2.6 Western blot检测
将细胞接种到6孔板中,细胞贴壁后加药物处理细胞,0、24和48 h后分别提取各处理组细胞总蛋白,每孔加RIPA裂解缓冲液冰上裂解30 min,4 ℃ 12 000 r/min离心15 min,取上清液并检测蛋白浓度,操作按试剂盒说明书进行。电泳分离:70 V,80 min;110 V,70 min;转膜(一般150 mA,2 h);5%脱脂奶粉TBST封闭1 h,兔抗人Cx43一抗工作浓度为1∶800(4 ℃轻摇过夜);兔抗人actin工作浓度为1∶500,HRP标记的抗兔lgG二抗工作浓度为1∶5 000(室温1 h)。暗室中ECL液显色。
1.3 统计学处理
应用SPSS 17.0统计分析软件对数据进行统计学处理,计量资料以表示,组间比较采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 SFLLRN和SCH79797对CNE1-LMP1细胞增殖的影响
0~500 μmol/L的SFLLRN与细胞共温育48 h后表现出促进细胞增殖的作用,且呈浓度依赖性,500 μmol/L SFLLRN作用最显著,我们选用100 μmol/L浓度组进行后续实验。0~20 μmol/L的SCH79797与细胞共温育48 h后表现出抑制细胞增殖、促进细胞凋亡的作用,且呈浓度依赖性,20 μmol/L SCH79797抑制最明显(图1A、B)。本研究后续实验选用对细胞凋亡影响较小的浓度组5 μmol/L。
2.2 SFLLRN和SCH79797对细胞侵袭的影响
用终浓度为100 μmol/L的SFLLRN和终浓度为5 μmol/L的SCH79797分别处理CNE1-LMP1细胞36 h后,对照组和各实验组高倍镜下穿过Transwell小室的细胞数量分别为(94±16)个、(168±18)个和(34±19)个(图2A、B)。表明SFLLRN能促进CNE1-LMP1细胞的侵袭,而SCH79797抑制CNE1-LMP1细胞的侵袭。
2.3 SFLLRN和SCH79797对细胞迁移的影响
与对照组相比,用终浓度为100 μmol/L的SFLLRN处理CNE1-LMP1细胞36 h后,细胞迁移明显增强,划痕间距缩短,而用终浓度为5 μmol/L的SCH79797处理CNE1-LMP1细胞36 h后,细胞几乎无迁移变化,划痕间距几乎不变(图3)。

图 1 SFLLRN和SCH79797对CNE1-LMP1细胞增殖的影响Fig. 1 Effect of SFLLRN or SCH79797 on the growth of CNE1-LMP1
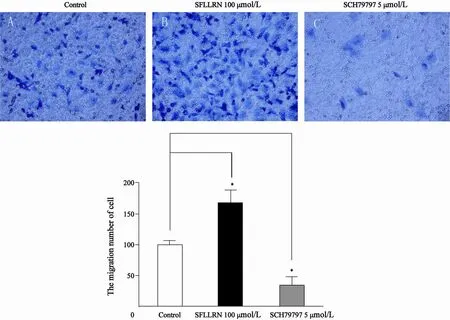
图 2 SFLLRN和SCH79797对CNE1-LMP1细胞体外侵袭能力的影响Fig.2 Effect of SFLLRN and SCH79797 on CNE1-LMP1 cells invasion in vitro

图 3 SFLLRN和SCH79797处理CNE1-LMP1细胞36 h后细胞迁移的变化Fig. 3 The change of migration cell 36 h after SFLLRN and SCH79797 processing CNE1-LMP1 cell

图 4 RT-PCR检测SFLLRN和SCH79797作用细胞不同时间后Cx43 mRNA的表达变化Fig. 4 Real-time PCR analysis of Cx43 mRNA in CNE1-LMP1 with SFLLRN and SCH79797
2.4 SFLLRN和SCH79797处理细胞后Cx43表达情况
RT-PCR检测显示,用100 μmol/L SFLLRN处理细胞24、48 h后,Cx43 mRNA表达与对照组相比呈明显下降趋势,而用5 μmol/L SCH79797处理细胞24、48 h后,Cx43 mRNA表达与对照组相比呈明显上升趋势(图4)。
2.5 SFLLRN和SCH79797处理细胞后Cx43蛋白表达情况
Western blot检测结果显示,用100 μmol/L SFLLRN处理细胞24、48 h后,Cx43蛋白表达与对照组相比呈明显下降趋势,而用5 μmol/L SCH79797处理细胞24、48 h后,Cx43蛋白表达与对照组相比呈明显上升趋势(图5)。
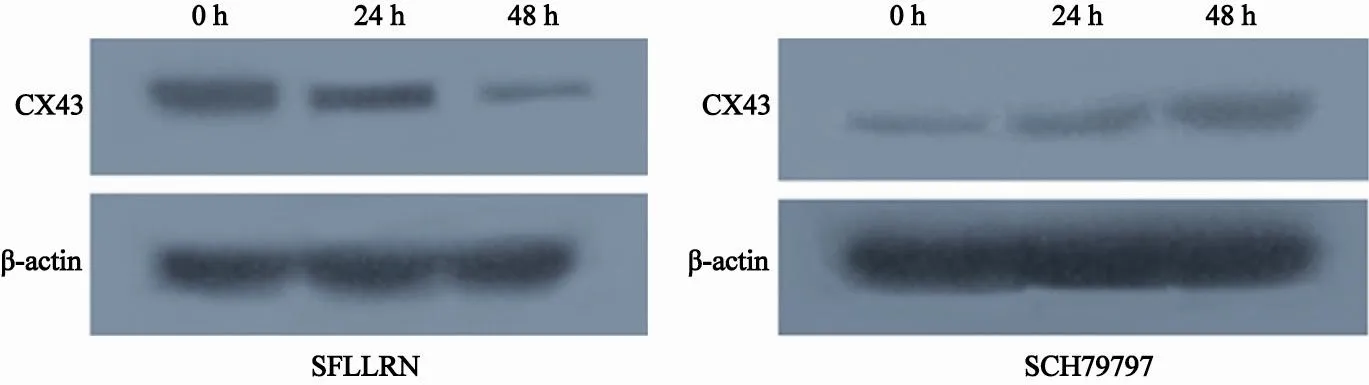
图 5 Western blot检测SFLLRN和SCH79797处理细胞后Cx43蛋白表达变化Fig. 5 Western blot analysis of Cx43 protein expression in CNE1-LMP1 with SFLLRN and SCH79797
3 讨 论
PAR1在鼻咽癌的进展中起重要作用,我们前期的研究已经表明PAR1高表达于具有高侵袭、高转移的鼻咽癌细胞系CNE1-LMP1[6]。因此,本研究通过使用PAR1激活肽SFLLRN及抑制剂SCH79797作用于鼻咽癌细胞系CNE1-LMP1,发现激活PAR1后,CNE1-LMP1细胞增殖及侵袭作用明显增加,而抑制PAR1表达后,CNE1-LMP1细胞增殖及侵袭作用明显减弱,进一步证实了PAR1在鼻咽癌进展中的核心作用。
为了更明确PAR1作用于细胞的机制,我们进一步研究发现PAR1的表达与Cx43之间存在联系,证实鼻咽癌中PAR1调控Cx43的表达。
Cx43在肿瘤中的作用仍存在争议,一些研究表明,当Cx43表达升高时,通过增加与血管内皮的黏附及物质交换功能,可以增强乳腺癌和神经胶质瘤的转移能力[9-17]。相反许多研究表明,在多种肿瘤中,缝隙连接蛋白Cx43表现为肿瘤抑制基因的特点,当其表达下降或者缺失时,细胞间连接通讯功能中断,机体对细胞的监视和调控作用减弱,细胞过度克隆生长,促进肿瘤的转移[1,18-19]。有研究发现,Cx43在人恶性黑色素瘤细胞中表达下降[20-21]。本研究也发现当活化PAR1后,Cx43蛋白及mRNA表达水平下降,当抑制PAR1后,Cx43蛋白及mRNA表达水平升高。Villares等[5]研究证实在转移性恶性黑色素瘤中,Cx43是PAR1下游的调控基因,指出尽管PAR1对转录因子(AP-1和SP-1)的表达无影响,但其影响转录因子SP-1、c-Jun和 c-Fos对Cx43基因启动子的结合,最终导致转录因子SP-1和AP-1结合Cx43启动子的作用减弱,证实了PAR1调节Cx43的表达发生在转录水平。本研究结果也表明,PAR1可能通过调节下游的靶基因Cx43影响鼻咽癌细胞的增殖和侵袭。Revilla等[22]在比较肿瘤细胞转移能力时发现,高转移细胞系间的缝隙连接通讯功能明显低于低转移细胞系;肿瘤细胞缝隙连接通讯功能降低与肿瘤转移有关。提示Cx43蛋白表达与癌细胞的转移有关,Cx43蛋白表达越少,缝隙连接的建立越少,机体对细胞的监视和调控作用减弱,细胞过度克隆生长,癌细胞转移能力越强;反之,Cx43蛋白表达越强,可促进间隙连接的组装,增加细胞间信号的交流,使细胞之间的生长相互控制[23],癌细胞转移能力则越弱[24]。
综上所述,本研究结果表明,PAR1被激活后,Cx43表达下降,鼻咽癌细胞的侵袭、迁移能力加强;而PAR1被抑制后,Cx43表达增加,鼻咽癌细胞的侵袭、迁移能力降低,提示Cx43可成为鼻咽癌早期治疗的新靶点。
[1] CZYZ J. The stage-specific function of gap junctions during tumourigenesis [J]. Cell Mol Biol Lett, 2008, 13(1): 92-102.
[2] 皮国良, 王涛. PAR-1促进肿瘤恶性行为机制的研究进展[J]. 实用医学杂志, 2008, 24(4): 499-501.
[3] KAILDOUZ M, BATIST G. Gap junctions and connexins as therapeutic targets in cancer [J]. Expert Opin Ther Targets, 2010, 14(7): 681-692.
[4] 马向东, 隋延仿, 王文亮, 等. 肝癌细胞及正常肝细胞中间隙连接蛋白Cx32、Cx43的表达 [J]. 中国癌症杂志, 2000, 10: 1-2.
[5] VILLARES G J, DOBROFF A S, WANG H, et al. Overexpression of protease-activated receptor-1 contributes to melanoma metastasis via regulation of connexin 43 [J]. Cancer Res, 2009, 69(16): 6730-6737.
[6] ZHU Q, LUO J, WANG T, et al. The activation of proteaseactivated receptor 1 mediates proliferation and invasion of nasopharyngeal carcinoma cells [J]. Oncol Rep, 2012, 28(1): 255-261.
[7] AHN H S, FOSTER C, BOYKOW G, et al. Inhibition of cellular action of thrombin by N3-cyclopropyl-7-{[4-(1-methylethyl)phenyl]methyl} -7H-pyrrolo[3, 2-f]quinazoline-1, 3-diamine (SCH 79797), a nonpeptide thrombin receptor antagonist [J]. Biochem Pharmacol, 2000, 60: 1425-1434.
[8] HILLS C E, BLAND R, BENNETT J, et al. TGF-beta1 mediates glucose-evoked up-regulation of connexin-43 cellto-cell communication in HCD-cells [J]. Cell Physiol Biochem, 2009, 24(3-4): 177-186.
[9] 夏之柏, 浦佩玉, 黄强, 等. 连接蛋白基因Cx43抑制胶质瘤细胞增殖及其机理的初步探讨 [J]. 中华肿瘤杂志, 2003, 25: 4-8.
[10] BATES D C, SIN W C, AFTAB Q, et al. Connexin43 enhances glioma invasion by a mechanism involving the carboxy terminus [J]. Glia, 2007, 55(15): 1554-1564.
[11] KANCZUGA-KODA L, SULKOWSKI S, LENCZEWSKI A, et al. Increased expression of connexins 26 and 43 in lymph node metastases of breast cancer [J]. J Clin Pathol, 2006, 59(4): 429-433.
[12] LIN J H, TAKANO T, COTRINA M L, et al. Connexin 43 enhances the adhesivity and mediates the invasion of malignant glioma cells [J]. J Neurosci, 2002, 22(11): 4302-4311.
[13] COTRINA M L, LIN J H, NEDERGAARD M. Adhesive properties of connexin hemichannels [J]. Glia, 2008, 56: 1791-1798.
[14] EL-SABBAN M E, PAULI B U. Cytoplasmic dye transfer between metastatic tumor cells and vascular endothelium[J]. J Cell Biol, 1991, 115: 1375-1382.
[15] POLLMANN M A, SHAO Q, LAIRD D W, et al. Connexin 43 mediated gap junctional communication enhances breast tumor cell diapedesis in culture [J]. Breast Cancer Res, 2005, 7: R522-R534.
[16] EL-SABBAN M E, PAULI B U. Adhesion-mediated gap junctional communication between lung-metastatatic cancercells and endothelium [J]. Invasion Metastasis, 1994-1995, 14(1-6): 164-176.
[17] ELZARRAD M K, HAROON A, WILLECKE K, et al. Connexin43 upregulation in micrometastases and tumor vasculature and its role in tumor cell attachment to pulmonary endothelium [J]. BMC Med, 2008, 6: 20.
[18] GERSHON E, PLAKS V, DEKEL N. Gap junctions in the ovary: expression, localization and function [J]. Mol Cell Endocrinol , 2008, 282(1-2): 18-25.
[19] SHEN Y, KHUSIAL P R, LI X, et al. SRC utilizes Cas to block gap junctional communication mediated by connexin43 [J]. J Biol Chem, 2007, 282(26): 18914-18921.
[20] HAASS N K, SMALLEY K S, HERLYN M. The role of altered cell-cell communication in melanoma progression [J]. J Mol Histol, 2004, 35(3): 309-318.
[21] HSU M, ANDL T, LI G, et al. Cadherin repertoire determines partner-specific gap junctional communication during melanoma progression [J]. J Cell Sci, 2000, 113 (Pt 9): 1535-1542.
[22] REVILLA A, BENNETT M V, BARRIO L C. Molecular determinants of membrane potential dependence in vertebrate gap junction channels [J]. Proc Natl Acad Sci USA , 2000, 97(26): 14760-14765.
[23] SU Y A, BITTNER M L, CHEN Y, et al. Identification of tumor suppressor genes using human melanoma cell lines UACC903, UACC903(+6), and SRS3 by comparison of expression profiles[J]. Mol Carcinog, 2000, 28(2): 119.
[24] MAASS K, GHANEM A, KIM J S, et al. Defective epidermal barrier in neonatal mice lacking the C-terminal region of connexin43 [J]. Mol Biol Cell, 2004, 15(10): 4597-4608.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
The effect of protease-activated receptor 1 on the migration and invasion of cancer cells and connexin 43 expression in nasopharyngeal carcinoma cell line CNE1-LMP1
ZHANG Xiao-ling1, WANG Tao1, PENG Gang1, ZHANG Li-ling1, LI Yue-hua2, LI Pin-dong1, REN Jing-hua1(1.Cancer Center, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei 430022, China; 2.Department of Radiation Oncology, the First Affiliated Hospital of Nanhua University, Hengyang Hunan 421001, China)
WANG Tao E-mail: shuiyueyang0520@163.com
Background and purpose: Protease-activated receptor 1 (PAR1) is a key player in the migration and invasion of tumor, but its role in the migration and invasion of nasopharyngeal carcinoma remains unclear. The purpose of this study was to investigate PAR1 on the proliferation and invasion of nasopharyngeal carcinoma cells (CNE1-LMP1) and its mechanism. Methods: Cultured human nasopharyngeal carcinoma cells CNE1-LMP1 were treated with PAR1 synthetic activating peptide SFLLRN or PAR1 antagonist SCH79797, MTT assay, wound-healing and Transwell invasion assay were used to investigate the proliferation, migration and invasion of CNE1-LMP1 cells. Then the expression of connexin 43 (Cx43) was detected using Western blot and RT-PCR. Results: PAR1 synthetic activating peptide SFLLRN promoted CNE1-LMP1 cell proliferation, migration and invasion, and significantly reduced Cx43 mRNA and protein expression (P<0.05) compared with the control group. PAR1 antagonist SCH79797 significantly inhibited CNE1-LMP1 cell proliferation, migration, and in vitro invasion ability, and significantly increased Cx43 mRNA and protein expression (P<0.05) compared with control group. Conclusion: The activation ofPAR1 promotes CNE1-LMP1 proliferation, migration and invasion, and decreases the expression of Cx43 mRNA and protein; the inhibition of PAR1 inhibits CNE1-LMP1 proliferation, migration and invasion, and increases the expression of Cx43 mRNA and protein.
NPC; Protease-activated receptor 1; Migration invasion; Cx43; Metastasis
10.3969/j.issn.1007-3969.2013.03.006
R739.62
:A
:1007-3639(2013)03-0188-07
2012-10-31
2013-01-04)
武汉市科技攻关计划项目(No:201260523172-2)。
王涛 E-mail:shuiyueyang0520@163.com
