Sorcin沉默表达对人卵巢癌耐药细胞SKOV3/CDDP耐药性的影响及机制
2013-06-09
天津市中心妇产科医院,天津300100
Sorcin沉默表达对人卵巢癌耐药细胞SKOV3/CDDP耐药性的影响及机制
刘明艳 张虹
天津市中心妇产科医院,天津300100
背景与目的:肿瘤细胞多药耐药性的产生是卵巢癌化疗失败的主要原因之一,Sorcin被发现在多种耐药肿瘤细胞中过度表达,可作为逆转肿瘤细胞多药耐药性(multi-dncg resistance,MDR)的靶点。本研究探讨Sorcin沉默表达对逆转人卵巢癌耐药细胞SKOV3/CDDP耐药性的作用及机制。方法:构建Sorcin稳定沉默SKOV3/CDDP细胞系后,采用MTS、流式细胞术、蛋白质印迹法(Western blot)、RT-PCR及荧光报告质粒等方法,观察肿瘤细胞药物敏感性、细胞内罗丹明123含量、细胞凋亡率、细胞周期的变化,MDR基因(multi-drug resistance gene,MDR1)、MDR相关蛋白(multi-drug resistance-associated protein,MRP1)、Survivin及Bcl-2 mRNA及蛋白水平表达的变化,Akt磷酸化水平及NF-κB转录活性的变化。结果:Sh-Sorcin-1和Sh-Sorcin-2沉默Sorcin表达可提高SKOV3/CDDP细胞对顺铂的敏感性,提高肿瘤细胞凋亡率并将细胞周期阻滞在G2/M期,Sh-Sorcin-1和Sh-Sorcin-2肿瘤细胞中罗丹明123含量相比未转染对照组分别提高了1.64倍和2.46倍,MDR1、MRP1、Survivin及Bcl-2蛋白表达显著下降,MDR1 mRNA表达分别是未转染对照组的42.3%和26.5%,MRP1 mRNA表达分别是对照组的33.2%和18.9%,Survivin mRNA表达分别是未转染对照组的36.2%和29.6%,Bcl-2 mRNA表达分别是未转染对照组的54.6%和46.7%,Akt磷酸化水平显著下降,NF-κB转录活性分别是未转染对照组的56.3%和38.4%。结论:抑制Sorcin表达可逆转SKOV3/CDDP细胞MDR性,提高肿瘤细胞药物敏感性,其机制可能与降低细胞Akt磷酸化水平、降低NF-κB活性有关。
卵巢癌;Sorcin;肿瘤耐药
[Key words]Ovarian Cancer; Sorcin; Drug resistance
卵巢癌(ovarian cancer)是妇女常见的恶性肿瘤之一,严重威胁妇女生命健康,据2011年发表的全球肿瘤统计数据显示,2008年全球发达地区卵巢癌发病率为9.4/100 000,死亡率达5.1/100 000[1]。目前卵巢癌公认和有效的根治性手段为外科手术加铂类化疗药物为主的联合化疗,但肿瘤细胞多药耐药性(multi-drug resistance,MDR)的产生往往引起化疗失败,肿瘤复发率达40%~60%,5年生存率仅为30%[2]。Sorcin是相对分子质量为22×103的钙结合蛋白,在多种MDR肿瘤细胞中表达明显增高,表明其可能在肿瘤的MDR中起着重要的作用,有可能作为逆转肿瘤细胞MDR的靶点[3-4]。但是Sorcin在肿瘤MDR发生中确切的作用和机制仍然很不清楚。因此我们通过慢病毒介导的shRNA干扰Sorcin基因表达,研究干扰Sorcin表达对卵巢癌MDR表型的逆转作用及机制。
1 材料与方法
1.1 材料
顺铂(cisplatin,CDDP)为南京制药厂有限公司产品。鼠抗人Sorcin、MDR基因MDR1、MDR相关蛋白MRP1、Survivin及Bcl-2单克隆抗体购自美国 Abcam 公司,Akt抗体及其磷酸化抗体来自Cell Signaling公司;青霉素、链霉素、胎牛血清和DMEM培养基来自GIBCO公司;Sorcin shRNA慢病毒转导颗粒及对照control-shRNA、嘌呤霉素均购自上海Sigma公司;TRIzol RNA提取试剂购自Invitrogen公司,逆转录试剂盒、SYBGREE实时定量PCR试剂盒为Takara公司产品,Bradford 蛋白浓度测定试剂盒为碧云天生物技术研究所产品,ECL化学发光试剂为GE公司产品,双荧光素酶报告试剂盒来自美国Promega公司,NF-κB荧光报告质粒3xNF-κB-pGL3购自Addgene,罗丹明123购自上海Sigma公司。
1.2 细胞培养及处理
卵巢癌顺铂耐药细胞 SKOV3/CDDP为本实验室保存。细胞用含 10%胎牛血清、100 U/mL青霉素和 100 U/mL链霉素的DMEM培养基在37 ℃、饱和湿度、CO2体积分数为5%的培养箱中常规传代培养。细胞密度80%时,经0.25%胰酶消化后吹打成单细胞悬液常规传代。
1.3 RNA干扰及筛选
取对数生长期细胞,于96孔板中分别接种1.5×104/孔实验组和对照组细胞,培养24 h后分别于实验组细胞和阴性对照组细胞加入5 μL表达Sorcin-shRNA或control-shRNA慢病毒,转导慢病毒72 h后用含嘌呤霉素(0.5 μg/mL)的培养基筛选2周,得到稳定干扰的细胞株,蛋白质印迹法(Western blot)检测干扰效率,并用于进一步实验,分为SKOV3母细胞组(Parent)、SKOV3/ CDDP未转染对照组(Control)、SKOV3/CDDP空载体转染阴性对照组(Negative)、SKOV3/CDDP Sorcin-shRNA转染实验1和2组(sh-Sorcin-1和2)。
1.4 MTS法检测细胞增殖
取对数生长期的空白组、对照组及实验细胞,经 0.25%胰酶消化后吹打成单细胞悬液,调整细胞密度为2×105个/mL,接种于 96 孔培养板中,每孔 100 μL。培养24 h 后,弃原培养液,按照0.5、1、5、10、50、100 mg/L梯度稀释的CDDP加入新培养液,每个浓度设5个平行复孔。置于37 ℃、CO2体积分数为5%的条件下培养48 h,每孔加MTS溶液20 μL,继续温育2~4 h,用酶标仪检测各孔波长 490 nm 处的吸光度(A)值。实验重复3次。记录结果,以时间为横坐标,A值为纵坐标绘制细胞生长曲线,计算SKOV3/CDDP细胞IC50,按照公式耐药倍数(RI)=IC50DDP/IC50parent,计算SKOV3/CDDP细胞在Sorcin干扰后耐药性变化。
1.5 细胞周期及凋亡检测
取对数生长期的空白组、对照组及实验组细胞,用10 mg/L CDDP作用24 h,经 0.25%胰酶消化后吹打成单细胞悬液,调整细胞密度为2×106个/mL,3 mL PBS洗涤1次,300×g离心5 min去除PBS,加入冰预冷的70%乙醇4 ℃固定2 h,300×g离心弃去固定液,3 mL PBS重悬5 min,400目的筛网过滤1次,300×g离心5 min,弃去PBS,用1 mL 1 mg/mL PI染液4 ℃避光染色30 min,流式细胞仪检测细胞周期及凋亡。
1.6 罗丹明-123蓄积实验
各组细胞经胰蛋白酶消化后制成单细胞悬液,800 r/min离心5 min,弃去上清液,重悬于含5 mmol/L罗丹明-123的培养液中, 37 ℃、CO2体积分数为5%的温箱中培养30 min,以培养液洗涤细胞3次,继续用DMEM培养液培养10 min后,用培养液洗涤细胞3次,然后以1 mL预冷的DMEM培养液重悬细胞,用流式细胞仪检测细胞的荧光强度。
1.7 荧光定量PCR检测耐药相关基因mRNA变化
按TRIzol试剂盒说明书提取实验组与对照组细胞总RNA,琼脂糖凝胶电泳鉴定其完整性,紫外分光光度计测定260和280 nm光密度值,计算RNA的纯度与浓度,使用1%DEPC水调节RNA至相同浓度。按照试剂盒说明书进行反转录、PCR反应。引物由上海生工生物工程股份有限公司合成。GAPDH:上游引物: 5’-ACCACCATGGAGAAGGCTGG-3’,下游引物:5’-CTCAGTGTAGCCCAGGATGC-3’;MDR1 :上游引物:5’-GAATCTGGAGGAAGAC ATGACC-3’,下游引物:5’-TCCAAT TTTGTCACCAATTCC-3’; MRP1:上游引物:5’-TCAGCCCTTCCTGACAAGCT-3’,下游引物: 5’-TCTCTGCTGCAGGAGGTCCG-3’;Survivin :上游引物:5’-GCCCAGTGTTTCTT CTGCTT-3’;下游引物: 5’-CCGGACGAATGC TTTTTATG-3’;Bcl-2上游引物:5’-GTGGAGGAGCTCTTCAGGGA-3’;下游引物:5’-AGGCACCCAGGGTGATGCAA-3’。
1.8 Western blot检测耐药相关蛋白表达变化
各组细胞用0.9%NaCl溶液清洗3次,加入适量预冷的细胞裂解液冰浴裂解30 min,移至1.5 mL EP管中,4 ℃ 13 000×g离心20 min,吸取上清液至新的EP管中,Bradford法测定蛋白浓度。取40 μg总蛋白经聚丙烯酰胺凝胶(PAGE,4%浓缩胶、10%分离胶)80 V电压下电泳3 h后,电转印至PVDF膜上。5%脱脂奶粉室温封闭1 h后,加入相应一抗,4 ℃温育过夜。TBST洗膜6次后,加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000),室温温育30~45 min,TBST洗膜6次后与ECL化学发光试剂显色1~2 min,X胶片曝光。
1.9 双荧光素酶报告系统检测启动子活性
将1 μg NF-κB荧光报告质粒以及0.02 μg对照质粒转染进入对照组和实验组细胞,24 h后按照说明书检测荧光素酶活性。
1.10 统计学处理
2 结 果
2.1 Sorcin稳定沉默表达细胞系的鉴定
使用表达Sorcin-shRNA及Control-shRNA慢病毒干扰的SKOV3/CDDP细胞,经嘌呤霉素(0.5 μg/mL)筛选2周,得到稳定干扰细胞株。Western blot检测结果显示,MDR卵巢癌细胞株SKOV3/CDDP表达Sorcin蛋白,经shRNA干扰后,与SKOV3/CDDP未转染对照组(Control)相比,SKOV3/CDDP空载体转染阴性对照组(Negative)细胞Sorcin蛋白表达无明显变化, Sh-Sorcin-1组和Sh-Sorcin-2组细胞Sorcin蛋白表达量明显减少(图1)。
2.2 Sorcin沉默增加SKOV3/CDDP细胞对顺铂的敏感性
MTS法检测结果显示,SKOV3/CDDP细胞干扰Sorcin表达后,顺铂对细胞的杀伤明显增加(P<0.05);并且随着药物浓度的增加,杀伤作用明显增加,呈现剂量依赖性,SKOV3的IC50为7.26 mg/L,SKOV3/CDDP的IC50为23.66 mg/L,耐药指数为3.26,Sh-Sorcin-1组IC50为18.54 mg/L,耐药指数为2.56,Sh-Sorcin-2组IC50为12.33 mg/L,耐药指数为1.70,表明干扰Sorcin后可提高卵巢癌耐药细胞SKOV3/CDDP对顺铂的药物敏感性(图2)。

图 2 Sorcin沉默对SKOV3/CDDP细胞顺铂敏感性的影响Fig.2 The effect of Sorcin silencing on cisplatin drug sensitivity of SKOV3/CDDP cells
2.3 Sorcin沉默对SKOV3/CDDP细胞凋亡及细胞周期的影响
流式细胞仪检测结果显示,采用10 mg/L顺铂作用24 h后,Control组、Sh-Sorcin-1和Sh-Sorcin-2组细胞凋亡率分别为22.3%、43.4%、56.6%,实验组细胞凋亡率明显升高,Control组、Sh-Sorcin-1和Sh-Sorcin-2组的G2/M期细胞百分率为8.73%、 21.43%、28.2%,差异有统计学意义(P<0.05),Sorcin沉默后Sh-Sorcin-1和Sh-Sorcin-2组细胞被阻滞在G2/M期,提示细胞耐药性发生逆转,而Control组与Negative细胞组差异无统计学意义(P>0.05,图3、4)。
2.4 Sorcin沉默对SKOV3/CDDP细胞罗丹明-123蓄积的影响
罗丹明-123的蓄积实验显示,Sh-Sorcin-1和Sh-Sorcin-2组细胞中罗丹明-123含量较Control组分别提高了1.64倍和2.46倍(图5)。由此提示,Sorcin沉默增加耐药肿瘤细胞的药物敏感性,与其细胞膜上的糖蛋白泵出药物的活性有关。
2.5 Sorcin沉默对SKOV3/CDDP细胞耐药相关基因mRNA水平的影响
以GAPDH为内参,RT-PCR检测结果显示,Sh-Sorcin-1和Sh-Sorcin-2组MDR1 mRNA表达分别是Control组的42.3%和26.5%,MRP1 mRNA表达分别是Control组的33.2%和18.9%,Survivin mRNA表达分别是Control组的36.2%和29.6%,Bcl-2 mRNA表达分别是Control组的54.6%和46.7%(图6)。
2.6 Sorcin沉默对SKOV3/CDDP细胞耐药相关蛋白的影响
Western blot检测结果显示,与Control组相比,Sorcin沉默表达后SKOV3/CDDP细胞MDR1、MRP1和Survivin、Bcl-2表达减少,说明Sorcin沉默能下调耐药肿瘤细胞耐药相关蛋白MDR1、MRP蛋白和凋亡抑制蛋白的表达,逆转细胞耐药(图7)。
2.7 Sorcin沉默对SKOV3/CDDP细胞信号通路的影响
Sorcin沉默表达后SKOV3/CDDP细胞Akt蛋白表达变化不明显,但磷酸化水平显著下降,双荧光素酶报告系统结果显示,Sh-Sorcin-1和Sh-Sorcin-2组 NF-κB启动子活性分别是Control组的56.3%和38.4%(图8),表明Sorcin沉默抑制了Akt的磷酸化以及NF-κB的活化。

图 3 Sorcin沉默对SKOV3/CDDP细胞凋亡的影响Fig. 3 The effect of Sorcin silencing on apoptosis of SKOV3/CDDP cells
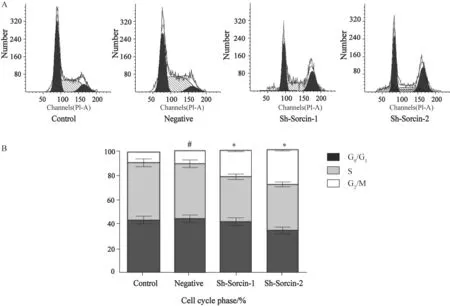
图 4 Sorcin沉默对SKOV3/CDDP细胞周期的影响Fig. 4 The effect of Sorcin silencing on cell cycle of SKOV3/CDDP cells
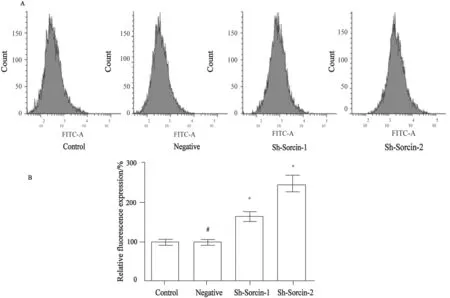
图 5 Sorcin沉默对SKOV3/CDDP细胞Rh-123蓄积的影响Fig.5 The effect of Sorcin silencing on Rh-123 content of SKOV3/CDDP cells

图 6 Sorcin沉默对SKOV3/CDDP细胞耐药相关基因mRNA表达的影响Fig. 6 The effect of Sorcin silencing on mRNA expression of drug resistance related gene of SKOV3/CDDP cells

图 7 Sorcin沉默对SKOV3/CDDP细胞耐药相关基因蛋白表达的影响Fig. 7 The effect of Sorcin silencing on protein expression of drug resistance related genes of SKOV3/CDDP cells

图 8 Sorcin沉默对SKOV3/CDDP细胞信号通路的影响Fig. 8 The effect of Sorcin silencing on signal transduction pathway of SKOV3/CDDP cells
3 讨 论
卵巢癌是妇女发病率较高的癌症之一,化疗是卵巢癌术后的主要治疗手段,但MDR的形成往往导致化疗效果欠佳。因此寻找MDR逆转剂成为肿瘤研究中的一个热点。
肿瘤细胞MDR的形成是一个复杂的、多因素参与的过程,其机制主要有药物外排能力增加、药物代谢酶活性的变化、凋亡抵抗力增加及药物亲和力改变等,分子表型主要表现为药物转运蛋白包括MDR基因MDR1编码的P糖蛋白(p-Glycoprotein,P-gP)、MDR相关蛋白(multidrug resistance-associated protein,MRP)等表达增加,这些转运蛋白通过ATP提供能量,将细胞毒类药物泵出细胞外,降低细胞内药物浓度,从而使细胞产生对多种药物的耐药性。因此,逆转MDR必须要抑制肿瘤细胞耐药相关基因表达。
本研究发现,在人卵巢癌耐药细胞SKOV3/ CDDP中Sorcin蛋白处于高表达状态,而以慢病毒为载体的shRNA可以有效地干扰Sorcin的表达。细胞毒性实验和罗丹明-123蓄积实验表明,干扰Sorcin可有效逆转细胞耐药,使肿瘤细胞对顺铂的敏感性分别提高了2.56倍和1.70倍。而RT-PCR和Western blot检测表明,MDR1和MRP mRNA水平与蛋白质水平均明显降低,显示干扰Sorcin可抑制MDR1和MRP的表达及活性,从而逆转细胞耐药。胃癌中的研究已表明,Sorcin与胃癌的侵袭转移、TNM分期以及淋巴结转移状态等密切相关[4],过表达Sorcin可以上调MDR基因的表达,而MDR抑制剂可以逆转Sorcin诱导的MDR[5],大肠癌中的研究也表明,Sorcin可诱导大肠癌细胞的MDR表型[6]。非小细胞肺癌中的研究表明Sorcin的表达与吉西他滨的耐药密切相关[7]。在急性髓性白血病中,Sorcin过表达的患者临床预后往往较差,并且与MDR1的表达正相关[8]。这与本研究的结果一致。但也有研究表明,干扰Sorcin表达可以上调MDR1 mRNA水平的表达[9]。因此,Sorcin在肿瘤MDR中的作用仍然需要进一步深入研究。
本研究结果也表明,干扰Sorcin可使凋亡抑制基因Survivin及Bcl-2蛋白表达显著下降。已有文献报道,Sorcin可以通过调节线粒体中钙离子浓度从而抑制细胞色素C的释放和caspase的激活,从而抑制细胞凋亡的发生[10]。白血病中的研究也表明,过表达Sorcin可以上调Bcl-2蛋白表达而下调Bax蛋白的表达,表明Sorcin可能通过调节凋亡来参与MDR的形成[11]。研究表明,Sorcin可以与凋亡通路中的重要蛋白TRAP1直接作用,增加TRAP1蛋白的稳定性,从而影响细胞的凋亡的发生[12]。因此,Sorcin在肿瘤细胞MDR中的作用可能与其凋亡抑制作用相关。
本研究通过蛋白印迹和荧光素酶报告实验发现,干扰Sorcin可抑制Akt蛋白的磷酸化,降低NF-κB的活性。PI3K/Akt信号通路在肿瘤发生、发展过程中起着重要作用,Akt是该信号通路中的关键性效应分子。近年来的研究表明PI3K/Akt信号通路在肿瘤MDR也起着重要作用[13-15]。而转录因子NF-κB可通过促进细胞增殖、抑制分化、抑制凋亡、促进肿瘤细胞的侵袭和转移等在肿瘤形成及发展过程中发挥重要作用。同时,NF-κB可以结合MDR1、MRP1基因启动子区的结合位点,促进MDR1的转录、翻译表达,从而导致肿瘤细胞的耐药。对Akt磷酸化和对NF-κB活性的抑制可能是干扰Sorcin逆转肿瘤细胞MDR的内在机制。
综上所述,本研究发现,Sorcin可作为逆转卵巢癌MDR的靶位点,干扰Sorcin表达可降低耐药基因MDR1和MRP表达,同时降低凋亡抑制基因表达,从而提高耐药细胞的药物敏感性,其机制可能与抑制PI3K/Akt信号通路、下调NF-κB活性有关。本研究将进一步研究Sorcin对奈达铂等铂类抗肿瘤药耐药性的逆转作用,为卵巢癌的临床治疗提供依据。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] 史惠蓉, 吴开元, 张海玲, 等. DLC1基因对人卵巢癌细胞OVCAR-3顺铂耐药性的影响[J]. 中国癌症杂志, 2011, 21(2): 103-109.
[3] HE Q, ZHANG G, HOU D, et al. Overexpression of sorcin results in multidrug resistance in gastric cancer cells with upregulation of P-gp[J]. Oncol Rep, 2011, 25(1): 237-243.
[4] ZHENG B B, ZHANG P, JIA W W, et al. Sorcin, a potential therapeutic target for reversing multidrug resistance in cancer [J]. J Physiol Biochem, 2012, 68(2): 281-287.
[5] DENG L, SU T, LENG A, et al. Upregulation of soluble resistance-related calcium-binding protein (sorcin) in gastric cancer [J]. Med Oncol, 2010, 27(4): 1102-1108.
[6] HE Q, ZHANG G, HOU D, et al. Overexpression of sorcin results in multidrug resistance in gastric cancer cells with upregulation of p-gp [J]. Oncol Rep, 2011, 25(1): 237-243.
[7] MADDALENA F, LAUDIERO G, PISCAZZI A, et al. Sorcin induces a drug-resistant phenotype in human colorectal cancer by modulating Ca(2+) homeostasis [J]. Cancer Res, 2011,71(24): 7659-7669.
[8] QU Y, YANG Y, LIU B, et al. Comparative proteomic profiling identified sorcin being associated with gemcitabine resistance in non-small cell lung cancer [J]. Med Oncol, 2010, 27(4): 1303-1308.
[9] TAN Y, LI G, ZHAO C, et al. Expression of sorcin predicts poor outcome in acute myeloid leukemia [J]. Leuk Res, 2003, 27(2): 125-131.
[10] KAWAKAMI M, NAKAMURA T, OKAMURA N, et al. Knock-down of sorcin induces up-regulation of mdr1 in hela cells [J]. Biol Pharm Bull, 2007, 30(6): 1065-1073.
[11] SUAREZ J, MCDONOUGH P M, SCOTT B T, et al. Sorcin modulates mitochondrial Ca2+ handling and reduces apoptosis in neonatal rat cardiac myocytes [J]. Am J Physiol Cell Physiol, 2013, 304(3): 248-256.
[12] QI J, LIU N, ZHOU Y, et al. Overexpression of sorcin in multidrug resistant human leukemia cells and its role in regulating cell apoptosis [J]. Biochem Biophys Res Commun, 2006, 349(1): 303-309.
[13] LANDRISCINA M, LAUDIERO G, MADDALENA F, et al. Mitochondrial chaperone trap1 and the calcium binding protein sorcin interact and protect cells against apoptosis induced by antiblastic agents [J]. Cancer Res, 2010, 70(16): 6577-6586.
[14] ABEDINI M R, MULLER E J, BERGERON R, et al. Akt promotes chemoresistance in human ovarian cancer cells by modulating cisplatin-induced, p53-dependent ubiquitination of flice-like inhibitory protein [J]. Oncogene, 2010, 29(1): 11-25.
[15] KIM S H, JUHNN Y S, SONG Y S. Akt involvement in paclitaxel chemoresistance of human ovarian cancer cells [J]. Ann N Y Acad Sci, 2007, 1095: 82-89.
[16] KIM D, DAN H C, PARK S, et al. Akt/pkb signaling mechanisms in cancer and chemoresistance [J]. Front Biosci, 2005, 10: 975-987.
The effect and mechanism of Sorcin silencing on drug resistance of human ovarian cancer SKOV3/ CDDP cell lines
LIU Ming-yan, ZHANG Hong (Tianjin Central Hospital of Gynecology Obstetrics, Tianjin 300100, China)
LIU Ming-yan E-mail: batistuta211@163.com
Background and purpose: Multi-drug resistance is a major reason for the chemotherapy failure of human ovarian cancer. Sorcin was found overexpression in drug resistance tumors and it may be the target of multidrug resistance reversal. The present article was aimed to study the effect and mechanism of Sorcin silencing on drug resistance of human ovarian cancer SKOV3/CDDP cell lines. Methods: The stable Sorcin silencing SKOV3/CDDP cell lines were established. MTS assay, flow cytometry was used to analyze the intra-cellular Rh-123 content, cells apoptosis and cycle. Real-time, Western blot and report gene assay were used to analyze the expression changes of genes, including MDR1, MPR1, Survivin, Bcl-2, p-Akt and NF-κB. Results: Sorcin inhibition enhanced the drug sensitivity of SKOV3/CDDP cells, increased the intra-cellular Rh-123 content and cell apoptosis, and arrested cell cycle in G2/M. The protein levels of MDR1, MPR1, Survivin, Bcl-2, p-Akt were down-regulated, the mRNA levels of MDR1 of Sh-Sorcin-1 and Sh-Corcin-2 group were decreased to 42.3% and 26.5% of untransfected control, MRP1 were decreased to 33.2% and 18.9% of untransfected control, Survivin were decreased to 36.2% and 29.6% of untransfected control, Bcl-2 were decreased to 54.6% and 46.7% of untransfected control, transcriptional activity of NF-κB were decreased to 56.3% and 38.4% of untransfected control respectively inSKOV3/CDDP cell lines after Sorcin silence. Conclusion: Sorcin silencing could reverse SKOV3/CDDP drug resistance and enhance drug sensitivity, which involves the decreased phosphorylation level of Akt and transcriptional activity of NF-κB.
10.3969/j.issn.1007-3969.2013.06.007
R737.31
:A
:1007-3639(2013)06-0439-08
2013-03-04
2013-06-05)
刘明艳 E-mail:batistuta211@163.com
