miR-301在结肠癌细胞增殖和凋亡中的作用
2013-06-09
南昌大学第二附属医院胃肠外科,江西 南昌 330006
miR-301在结肠癌细胞增殖和凋亡中的作用
张忠来 熊欢 张兵 朱培谦
南昌大学第二附属医院胃肠外科,江西 南昌 330006
背景与目的:miR-301在多种恶性肿瘤中表达上调,然而其在结肠癌中的表达及功能尚不清楚。本研究旨在检测微小RNA miR-301在结肠癌组织中的表达,并在体内外研究miR-301反义寡核苷酸技术(ASO)对结肠癌细胞增殖和凋亡的影响。方法:运用荧光定量PCR定量分析120例结肠癌患者癌组织及对应癌旁组织中miR-301的表达;通过miR-301ASO降低结肠癌SW620细胞中miR-301的表达,采用MTT、克隆形成实验、流式细胞技术及体内实验观察miR-301ASO对SW620细胞产生的生物学效应。结果:在120例结肠癌患者中,63.33%(76/120)的结肠癌组织miR-301表达明显高于对应癌旁组织(P=0.00);与对照组miR-301的表达量(0.50±0.07)相比,miR-301ASO组可以显著降低miR-301的表达(0.09±0.01,P=0.00);MTT实验结果显示,转染miR-301 ASO组24、48、96 h SW620细胞的存活数量均明显低于对照组(P<0.05);克隆形成实验结果显示,miR-301ASO组克隆形成率(5.33%±0.74%)较对照组(33.33%±8.38%)显著降低(P=0.00);体内研究进一步证实miR-301ASO可以抑制肿瘤细胞的增殖,从而导致肿瘤生长较对照组慢(P=0.01),肿瘤的体积较对照组明显减小(P=0.01);流式细胞仪检测显示,转染miR-301ASO组SW620细胞凋亡指数(15.68±1.46)较随机染转染ASO组(3.36±0.88)明显增高(P=0.02);另外,降低miR-301的表达发现Bcl-2的mRNA和Bcl-2蛋白均明显下降(P=0.00,P=0.00)。结论:miR-301在结肠癌组织中表达上调,降低miR-301的表达可有效抑制结肠癌细胞生长、促进细胞凋亡。miR-301有可能成为结肠癌基因表达调控的新靶点。
miR-301;结肠癌;反义单核苷酸
微小RNA(microRNA,miRNA)是一种内源性的非编码小分子RNA,广泛分布于动植物细胞体内。研究发现,miRNA在恶性肿瘤细胞的发生、发展中发挥重要作用,其中包括调控细胞的增殖、分化和凋亡[1-2]。Shi等[3]报道miR-301在乳腺癌中过表达,抑制乳腺癌细胞miR-301的表达后,细胞增殖、侵袭及迁移能力明显减弱,说明miR-301在乳腺癌中发挥重要作用。Lee等[4]研究报道,胰腺癌细胞系和组织中miR-301高表达,且与胰腺癌的侵袭转移密切相关。另外,Jiang等[5]研究也发现,miR-301在肝癌组织中呈过表达。本实验采用TagMan MGB探针法检测miR-301在结肠癌组织中的表达情况, 同时利用反义寡核苷酸技术(antisense oligonucleotide,ASO)抑制miR-301在结肠癌细胞中的表达,分析miR-301对结肠癌细胞增殖和凋亡的影响。
1 材料和方法
1.1 材料
收集2006年1月—2011年1月南昌大学第二附属医院胃肠外科结肠癌及对应癌旁组织手术标本(n=120)。 所有标本均经病理学检查确诊,其中男性106例,女性14例,年龄32~69岁。所有患者术前均未接受放化疗。
1.2 主要试剂和仪器
结肠癌SW620细胞由本实验室保存;TaqMan miRNA分析试剂盒购自美国ABI公司;L-15培养基购自美国Gibco公司、胎牛血清购自美国Hyclone公司、脂质体LipfectamineTM2000购自美国Invitrogen公司;miR-301 ASO购自宝生物工程(大连)有限公司;Annexin V-FITC凋亡检测试剂盒购自南京凯基公司;总蛋白提取试剂盒购自上海碧云天生物技术有限公司;鼠抗人Bcl-2单克隆抗体购自美国Santa Cruz公司;实时荧光定量PCR分析仪购自美国ABI公司,流式细胞仪购自美国BD公司。
1.3 方法
1.3.1 实时荧光定量PCR检测miR-301的表达
采用TRIzol试剂提取结肠癌组织及对应癌旁照组织中总RNA,采用紫外分光光度计测定浓度,-80 ℃保存,运用miR-301检测试剂盒检测miR-301的表达。首先取2 μg总RNA为反应模板与3 μL逆转录酶相互混合,反应体系为20 μL,反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。反应结束后,收集cDNA,将其稀释150倍,然后取1 μL稀释的cDNA与2 μL TaqMan引物相混合,20 μL反应体系:95 ℃ 10 min,95 ℃ 15 s,59 ℃ 60 s,40个循环。相对miRNA表达采用ct值精确计算,将U6 snRNA作为内参。
1.3.2 反义miR-301单核苷酸序列设计
MiRBase提供的miRNA基因序列获取人miR-301的序列,并设计其反义寡核苷酸序列,同时运用核酸序列数据库检索程序以排除其他的同源序列。另外,同时设计一条随机对照序列,如下所示:miR-301顺义链:5’-AGUCACUAGUGGUUCCGUUUA-3’,反义miR-301 反义链:5’-TAAACGGAACCA CTAGTGACT-3’,随机序列顺义链:5’-UUCUCCGAACGUGUCACGUTT-3’,反义链:5’-ACGUGACACGUUCGGAGAATT-3’,送Invitrogen公司合成,PAGE纯化,全硫代修饰。
1.3.3 细胞培养和ASO转染
将SW620结肠癌细胞接种于L-15培养基(含10%胎牛血清),37 ℃、CO2体积分数为5%的条件下培养。严格遵照LipfectamineTM2000转染试剂盒操作程序进行转染,miR-301 ASO终浓度分别为:50、100、150、200 nmol/L,本实验组前期初步筛选出最佳终干扰浓度为100 nmol/L。转染后培养时间分别为24、48、72 h,初步筛出最佳作用时间为48 h。将荧光素(FITC)标记的硫代磷酸ASO转染后放置于倒置荧光显微镜下进行观察,上述操作重复3次。转染效率(不同视野镜下观察发光的细胞和总的细胞比)为88.5%±6.4%(图1)。
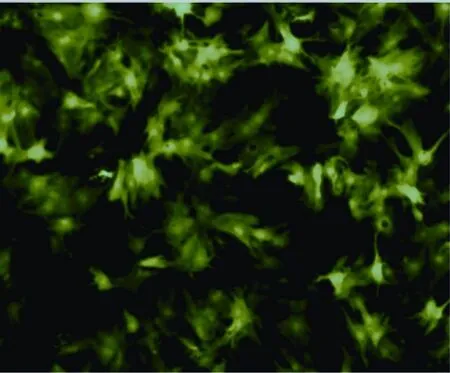
图 1 转染荧光素标记的硫代磷酸反义寡核苷酸效果图Fig. 1 The figure of transfection effect
1.3.4 转染miR-301 ASO后对miR-301表达的影响
转染miR-301 ASO与随机ASO 48 h后,提取总RNA,测定浓度,逆转录为cDNA(反应条件同1.3.1),测定cDNA浓度。运用miR-301检测试剂盒检测miR-301的表达(反应条件同1.3.1)。上述操作重复3次。
1.3.5 克隆形成实验检测SW620细胞的增殖
结肠癌SW620细胞经转染后,取对数生长期的细胞,用3%胰蛋白酶消化细胞。接种于6孔培养皿中,大约500~600个细胞/孔,置于37 ℃、CO2体积分数为5%、饱和湿度的条件下,培养2~3周。观察细胞生长情况,当培养皿中出现肉眼可见的克隆细胞团时,终止培养。移去上清液,运用PBS漂洗2次。加4%甲醛溶液固定20 min,去除固定液,加适量Giemsa应用染色液染30 min,用ddH2O清洗染色液,经干燥后在显微镜下计数>50个细胞的克隆数,克隆形成率=克隆数/接种细胞数×100%。上述操作重复3次。
1.3.6 MTT检测SW620细胞增殖情况
收集SW620细胞,将各组细胞悬液在离心管内反复充分打匀,接种于96孔培养板(6×103/孔),24 h后换液。实验分组同1.2.4,每组设有6个复孔。转染后1~4 d每孔加入MTT试剂(浓度为5 mg/mL)20 μL,在37 ℃、CO2体积分数为5%的条件下继续温育4 h。用移液器吸取各孔上清,每孔加入DMSO 150 μL,在室温条件下摇10 min(置水平摇床)以充分完全溶解MTT结晶。测定各孔490 nm处的吸光度(A)值。每组重复3次。按下列公式计算细胞生长抑制率(%):细胞生长抑制率=(A490实验组平均值-A490对照组平均值)/A490对照组平均值×100%。上述操作重复3次。
1.3.7 活体内检测miR-301 ASO对SW620细胞增殖的影响
将18只(4~5周龄)裸鼠(上海斯莱克公司)饲养于SPF无菌环境下。在SW620细胞转染miR-301 ASO或随机ASO后,取对数期生长的细胞(约2×106个)制成150 μL细胞悬液,运用微量注射器接种于裸鼠左侧大腿背部皮下。成瘤后定期测量肿瘤的体积,并运用公式V=D×d2×π/6(D、d分别代表肿瘤的最大直径和最小直径)计算肿瘤的体积[6],绘制肿瘤生长曲线。饲养6周后处死裸鼠,取瘤称重。经4%甲醛溶液固定、石蜡包埋、HE染色后,在光镜下观察肿瘤组织的病理学特征。
1.3.8 流式细胞术分析细胞早期凋亡
实验分组同1.2.4,将细胞接种于6孔板中,转染miR-301 ASO。经48 h后收集细胞并制备为单细胞悬液,采用PBS漂洗2次,离心、弃上清液。最后运用Annexin Ⅴ-FITC早期凋亡试剂盒和流式细胞仪检测各组细胞的早期凋亡情况。上述操作重复3次。
1.3.9 检测各组细胞Bcl-2 mRNA的表达水平
各组培养细胞加入TRIzol裂解液,提取总RNA,逆转录为cDNA,运用SYBR Green Realtime PCR Master Mix通过荧光定量PCR方法检测Bcl-2的mRNA表达。Bcl-2的引物序列为上游:5’-AACTGGGG GAGGATTGTGGC-3’;下游:5’-GATCCAGGTGTGCAGGTGCC-3’。反应条件:95 ℃变性45 s,58 ℃退火45 s,72 ℃延伸30 s,40个循环。以GAPDH作为内参。在ABI7500反应平台上进行PCR反应。
1.3.10 检测各组细胞Bcl-2蛋白的表达水平
收集转染miR-301 ASO的SW620细胞,运用总蛋白提取试剂盒提取总蛋白,经10%SDSPAGE电泳后转膜,将膜放在含5%脱脂奶粉的TBST缓冲液中37 ℃封闭2 h,加一抗稀释液1∶500稀释鼠抗人Bcl-2单克隆抗体在4 ℃温育过夜,每次用TBST缓冲液洗膜10 min,共3次,加辣根过氧化物酶标记的山羊抗鼠IgG(1∶1 000稀释),置于37 ℃温育2 h,每次用BST缓冲液洗膜10 min,共3次,运用ECL化学发光法检测目的蛋白条带。以β-actin作为内参。
1.4 统计学处理
2 结 果
2.1 结肠癌组织miR-301的表达情况
利用实时荧光定量PCR检测120例结肠癌患者癌及对应癌旁组织miR-301的表达,结果发现:63.33%(76/120)例患者结肠癌组织miR-301的表达明显高于对应癌旁组织,差异有统计学意义(P<0.05,图2),其余36.67%(44/120)例患者结肠癌组织miR-301的表达与对应癌旁组织相比,差异无统计学意义(P>0.05)。
2.2 降低miR-301的表达对SW620细胞存活率的影响
通过荧光定量PCR方法检测发现,转染miR-301 ASO组,miR-301的相对表达量(0.09±0.01)较对照组(0.50±0.07)明显降低(P=0.00,图3A)。同时MTT检查结果发现,转染miR-301 ASO组细胞生长较对照组明显降低,其24、48、96 h的细胞生长抑制率分别为53.57%、59.13%和70.08%,差异均有统计学意义(P<0.05,图3B)。
2.3 降低miR-301的表达对体外SW620细胞增殖的影响
克隆形成实验结果提示,转染miR-301 ASO组SW620细胞克隆形成率5.33%±0.74%,较对照组33.33%±8.38%明显降低(P=0.00,图4)。
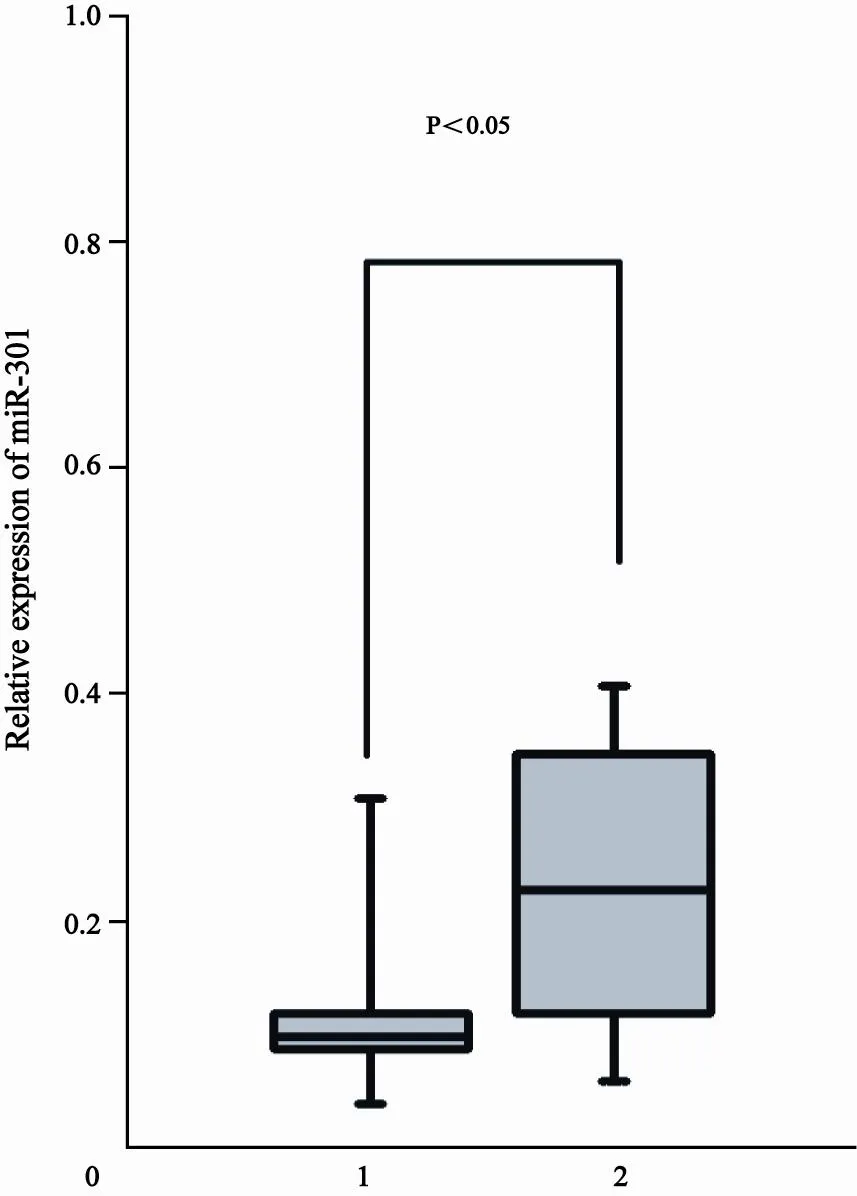
图 2 实时荧光定量PCR检测120例结肠癌患者癌及对应癌旁组织miR-301表达的盒须图Fig. 2 The box-plot of miR-301 expression level in 120 groups of colon cancer and adjacent normal tissues using quantitative PCR
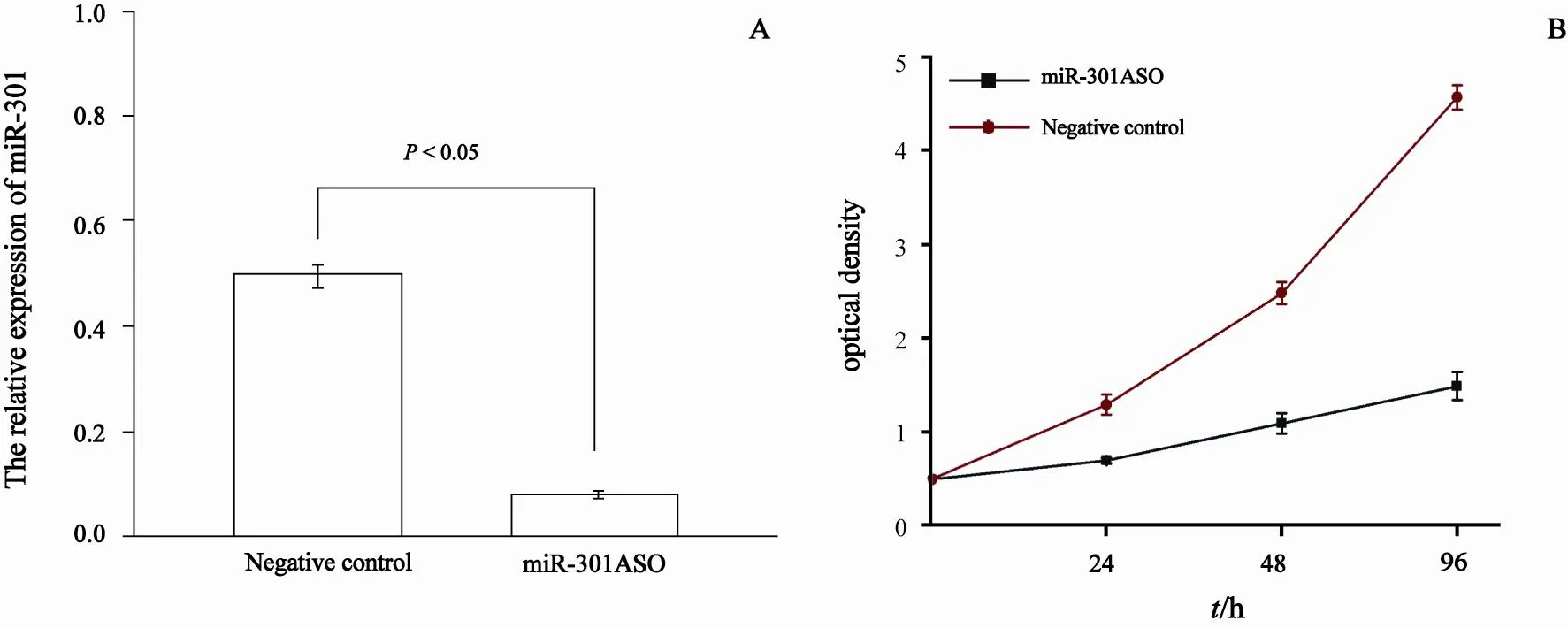
图 3 转染miR-301 ASO后SW620细胞miR-301的表达和生长情况变化Fig. 3 The expression of miR-301 and the growth of SW620 after transfection of miR-301 ASO

图 4 转染miR-301 ASO后SW620细胞克隆形成率明显降低Fig. 4 The colony formation rate of SW620 cell was significantly reduced after transfection of miR-301 ASO
2.4 降低miR-301的表达对活体肿瘤增殖的影响
本实验所有的裸鼠肿瘤成瘤率为100%,实验结果发现,转染miR-301ASO组的肿瘤生长较对照组明显缓慢,差异有统计学意义(P=0.01,图5)。
2.5 降低miR-301的表达对SW620细胞凋亡的影响
结肠癌细胞SW620转染miR-301 ASO后,流式细胞仪检测细胞凋亡的结果显示,转染miR-301 ASO组SW620细胞凋亡指数为15.68±1.46,较随机转染ASO组3.36±0.88明显增高(P=0.02,图6)。

图 5 活体内miR-301ASO转染的SW620细胞所形成肿瘤的体积变化Fig. 5 Tumor growth curves after transfection of miR-301 ASO
2.6 降低miR-301的表达对Bcl-2 mRNA和Bcl-2蛋白表达的影响
miR-301 ASO转染SW620细胞后,利用荧光定量PCR和Western blot检测各组细胞中Bcl-2 mRNA和Bcl-2蛋白表达水平,结果发现转染miR-301 ASO组Bcl-2 mRNA(1.05±0.04)和Bcl-2蛋白(0.21±0.03)的相对表达水平明显低于随机转染ASO组(4.87±0.96,0.88±0.09),差异均有统计学意义(P=0.00,图7)。
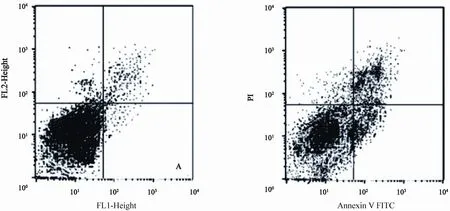
图 6 流式细胞仪检测miR-301 ASO转染后的SW620细胞凋亡情况Fig. 6 Apoptosis in SW620 cells after transfection of miR-301 ASO
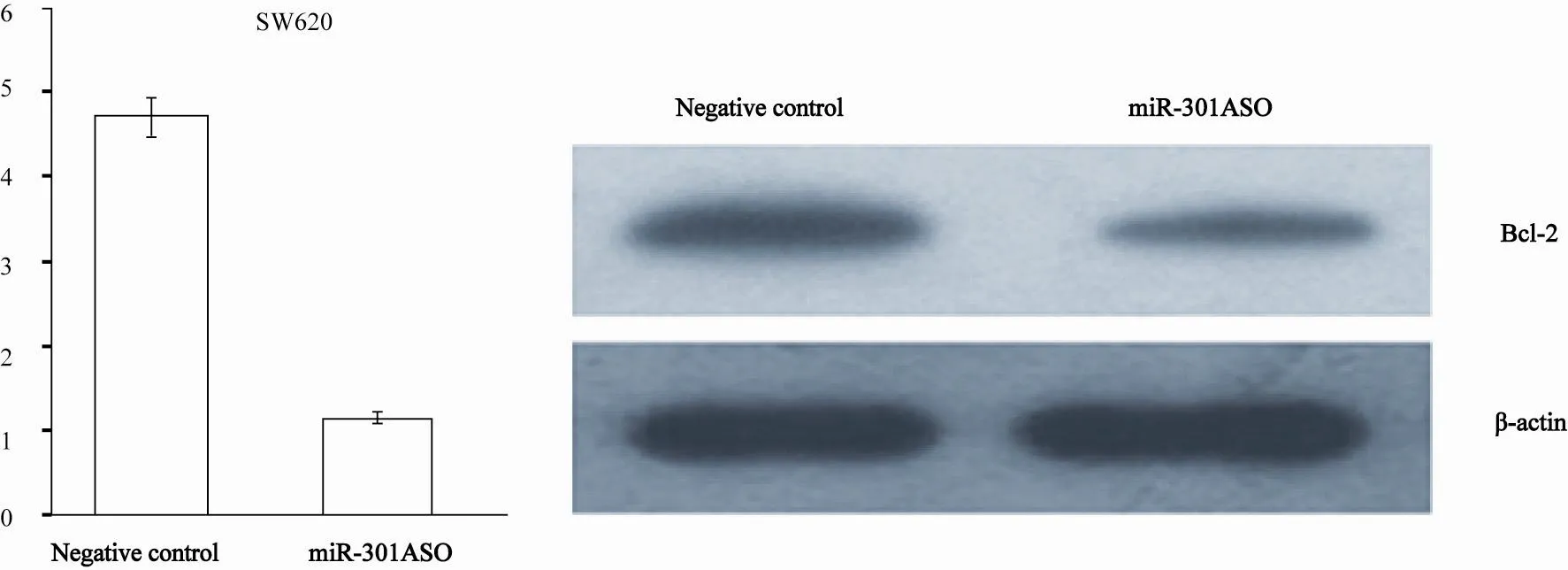
图 7 Bcl-2 mRNA和蛋白在转染miR-301 ASO 的SW620细胞中的表达情况Fig. 7 Bcl-2mRNA and protein level in SW620 cell after transfection of miR-301 ASO
3 讨 论
结肠癌是全球最常见的恶性肿瘤之一,尤其常见于西方发达国家,在中国结肠癌发病率的增长速度是全球平均增长水平的2倍[12]。在确诊为结肠癌患者中,约50%以上属于临床晚期,治疗效果不理想。因此,急需寻找新的肿瘤标志物来进一步提高结肠癌的早期诊疗效果。miRNAs是一类新的基因调控因子,在控制细胞的生长、分化、血管形成及凋亡等过程中发挥着非常重要的作用[7-8]。随着越来越多的miRNA被发现和深入研究,证实miRNAs与恶性肿瘤密切相关,大约有调控miRNAs编码基因位的52%位于肿瘤相关染色体区域[9-10]。另外,研究认为miRNA可以作为癌基因或者抑癌基因在肿瘤的发生、发展中起作用。因此,miRNAs可能成为诊断肿瘤新的分子标志和判断肿瘤治疗及预后的分子靶点。miRNAs在转录后水平调节靶基因的表达,更有助于恶性肿瘤的早期发现、早期诊断和早期治疗,其必将具有广阔的临床应用前景[11]。
本实验首先在检测发现,miR-301在结肠癌组织中表达上调,与miR-301在乳腺癌及胰腺癌的表达明显上调相符[3-4],表明miR-301在结肠癌发生发展中可能发挥重要作用。ASO是一类经人工合成或构建的反义表达载体表达的寡核苷酸片段,长度多为15~30个核苷酸,通过碱基互补原理,干扰基因的解旋、复制、转录、mRNA的剪接加工乃至输出和翻译等各个环节。为了进一步分析miR-301对结肠癌细胞功能的影响,本实验通过转染miR-301 ASO降低结肠癌细胞SW620中miR-301的表达,同时利用MTT方法检测降低miR-301的表达后SW620细胞生长情况,结果发现转染miR-301 ASO的SW620细胞存活率明显降低。此外我们运用克隆形成实验,观察到转染miR-301 ASO后,SW620细胞克隆形成率比随机ASO组明显减少。同时本实验在活体内实验进一步证实转染miR-301 ASO组SW620细胞皮下形成肿瘤的体积较随机ASO组显著减小,差异有统计学意义(P<0.05)。表明miR-301在结肠癌细胞的生长中起着非常重要的作用。
为了分析降低miR-301表达对结肠癌细胞凋亡情况的影响,本实验运用流式细胞技术检测SW620细胞凋亡情况,结果发现转染miR-301 ASO组细胞凋亡指数较随即转染ASO组明显增高(15.68±1.46 vs 3.36±0.88)。众所周知,Bcl-2与细胞凋亡的关系密切。为证实miR-301与Bcl-2有关联,本实验检测了各组Bcl-2 mRNA和Bcl-2蛋白表达水平,结果发现,转染miR-301 ASO组Bcl-2 mRNA和Bcl-2蛋白表达水平明显低于随机转染ASO组。表明miR-301可能通过调节Bcl-2的表达影响细胞的凋亡,从而进一步达到对肿瘤细胞增殖能力的调控。
综上所述,miR-301在调控结肠癌细胞的增殖和凋亡方面发挥重要作用,很可能成为诊断结肠癌新的分子标志物,为结肠癌临床基因治疗提供新的靶点。但其具体的作用机制,如miR-301如何调控结肠癌细胞的增殖及miR-301如何调控Bcl-2而影响细胞凋亡的问题还有待于进一步深入研究。
[1] KALA R, PEEK G W, HARDY T M, et al. MicroRNAs: an emerging science in cancer epigenetics[J]. J Clin Bioinforma, 2013, 3(1): 6.
[2] GURTAN A M, SHARP P A. The Role of miRNAs in Regulating Gene Expression Networks[J]. J Mol Biol, 2013. pii: S0022-2836(13)00154-X. doi: 10.1016/ j.jmb.2013.03.007. [Epub ahead of print].
[3] SHI W, GERSTER K, ALAJEZ N M, et al. MicroRNA-301 mediates proliferation and invasion in human breast cancer[J]. Cancer Res, 2011, 71(8): 2926-2937.
[4] LEE E J, GUSEV Y, JIANG J, et al. Expression profiling identifies microRNA signature in pancreatic cancer[J]. Int J Cancer, 2007, 120(5): 1046-1054.
[5] JIANG J, GUSEV Y, ADERCA I, et al. Association of MicroRNA expression in hepatocellular carcinomas with hepatitis infection, cirrhosis, and patient survival[J]. Clin Cancer Res, 2008, 14(2): 419-427.
[6] BHATTACHARYA A, TUROWSKI S G, SAN MARTIN I D, et al. Magnetic resonance and fluorescence-protein imaging of the anti-angiogenic and anti-tumor efficacy of selenium in an orthotopic model of human colon cancer[J]. Anticancer Res, 2011, 31(2): 387-393.
[7] CROCE C M. Causes and consequences of microRNA dysregulation in cancer[J]. Nat Rev Genet, 2009, 10(10): 704-714.
[8] STEFANI G, SLACK F J. Small non-coding RNAs in animal development[J]. Nat Rev Mol Cell Biol, 2008, 9(3): 219-230.
[9] MANIKANDAN J, AARTHI J J, KUMAR S D, et al. Oncomirs: the potential role of non-coding microRNAs in understanding cancer[J]. Bioinformation, 2008, 2(8): 330-334.
[10] NANA-SINKAM S P, CROCE C M. Clinical applications for microRNAs in cancer[J]. Clin Pharmacol Ther, 2013, 93(1): 98-104.
[11] KHALID U, SALEEM T, IMAM A M, et al. Pathogenesis, diagnosis and management of primary melanoma of the colon[J]. World J Surg Oncol, 2011, 9(14): 120-127.
[12] CHEN W Q, ZENG H M, ZHENG R S, et al. Cancer incidence and mortality in China, 2007[J]. Chin J Cancer Res, 2012, 24(1): 1-8.
The role of miR-301 in colon cancer cell proliferation and apoptosis
ZHANG Zhong-lai, XIONG Huan, ZHANG Bing, ZHU Pei-qian (Gastrointestinal Surgery, the Second Affiliated Hospital of Nanchang University Nanchang, Nanchang Jiangxi 330006, China)
ZHU Pei-qian E-mail: zhupeiqian@163.com
Background and purpose: The miR-224 in a variety of malignant tumors is overexpression, however, its expression and function in colon cancer are not clear. The aim of this study was to investigate the expression of miR-301 in colon cancer tissues and demonstrate the regulative effects of miR-301 ASO on the proliferation and apoptosis of colon cancer cell in vitro and in vitro. Methods: The expression of miR-301 in 120 colon cancer tissues and their adjacent tissues was detected by real-time quantitative PCR method. After transfection with miR-301ASO, the biological effects of miR-301 in SW620 cells were measured by MTT assay, the colony formation experiment, flow cytometry and the in vivo experiment. Results: The expression level of miR-301 was found to be overexpressed in 63.33% (76/120) of the colon cancer cases (P<0.05). miR-301 expression in SW620 cells (transfection with miR-301 ASO, 0.09±0.01) was significantly less than control group (0.50±0.07, P=0.00). MTT assay results showed that SW620 cells survived rate at 24, 48 and 96 h decreased greatly after transfection with miR-301ASO (P=0.00). Clone formation assay revealed that miR-301 ASO group colony formation rate (5.33%±0.74%) was significantly lower than the control group (33.33%±8.38%, P=0.00). In vivo study further confirmed that miR-301ASO could inhibit the proliferation of SW620 cells (P<0.05), and miR-301ASO group grew substantially slow compared with the negative control group (P=0.00). Flow cytometry indicated that the apoptotic index in miR-301 ASO group (15.68±1.46) was significantly higher than the control group (3.36±0.88, P=0.02). In addition, the Bcl2 mRNAand protein were significantly decreased after reduce the expression of miR-301 (P=0.00, P=0.00). Conclusion: MiR-301 was overexpressed in human colon cancer. Reduce the expression of miR-301 can effectively inhibit the growth of colon cancer cells and promote apoptosis. MiR-301 may become a new target for the regulation of gene expression in colon cancer.
MiR-301; Colon cancer; Antisense oligonucleotides
10.3969/j.issn.1007-3969.2013.06.006
R735.3+5
:A
:1007-3639(2013)06-0432-07
2013-02-25
2013-05-13)
朱培谦 E-mail:zhupeiqian@163.com
