原发性宫颈及阴道恶性黑色素瘤51例的临床分析
2013-06-09
复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海200032
原发性宫颈及阴道恶性黑色素瘤51例的临床分析
杨莉 吴小华 张志毅 李子庭 王华英 臧荣余 程玺
复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:原发性宫颈及阴道恶性黑色素瘤是一类罕见的、恶性程度高、预后极差的肿瘤。本研究旨在探讨原发性宫颈及阴道恶性黑色素瘤患者的临床特点、治疗方式及预后。方法:对复旦大学附属肿瘤医院1998年12月—2011年7月收治的51例宫颈及阴道恶性黑色素瘤患者的临床资料进行回顾性分析。结果:2、4年无进展生存率分别为32.8%、13.1%,2、4年总生存率分别为67.2%、39.8%,3例带瘤生存超过5年。随访期内,29例(56.9%)患者发生复发转移,主要部位为阴道残端/盆腔(10例,34.5%)、肝(4例,13.9%)、肺(3例,10.3%)、骨(3例,10.3%)和外阴(3例,10.3%)等。单因素分析显示,肿瘤大小和脉管癌栓是影响患者总体生存的重要因素(P<0.05),盆腔淋巴结转移是影响无进展生存的重要因素(P=0.05)。术后联合放化疗和免疫治疗组中位疾病进展时间为17个月,而单纯化疗组为9个月,单纯免疫治疗组为11个月。结论:原发性宫颈及阴道恶性黑色素瘤预后差。手术、放化疗和免疫综合治疗具有控制疾病进展、延长患者生存的作用。
阴道黑色素瘤;宫颈黑色素瘤;手术;化疗;放疗;免疫治疗;预后
恶性黑色素瘤是起源于上皮基底层黑色素细胞的恶性肿瘤,好发于皮肤和黏膜。原发性女性生殖道恶性黑色素瘤少见,占女性恶性肿瘤的0.4%~0.8%,主要发生于外阴,原发于阴道者少见,原发于宫颈者罕见[1]。临床个案报道宫颈及阴道恶性黑色素瘤恶性程度高,易复发转移,手术、放疗、化疗疗效均不佳,预后极差,5年生存率不足25%[2]。采取何种治疗方式以提高阴道、宫颈恶性黑色素瘤的治疗效果及其预后,是临床亟需探讨的问题。
本研究通过回顾性分析原发性阴道及宫颈恶性黑色素瘤患者的临床病理及预后资料,对该病的临床表现、复发转移方式、手术、放疗、化疗及免疫治疗的疗效及患者预后等进行探讨。
1 资料和方法
1.1 临床资料
1998年12月—2011年7月复旦大学附属肿瘤医院妇瘤科共收治原发性阴道恶性黑色素瘤患者49例,原发性宫颈恶性黑色素瘤患者6例,排除临床病理或随访资料不完整患者4例,共51例(阴道45例,宫颈6例)纳入分析。
1.2 治疗方法
手术治疗方式为广泛性子宫、阴道切除手术或肿瘤局部扩大切除术±淋巴结清扫术。其中,广泛性手术方式为广泛子宫、全阴道或部分阴道切除术,具体手术方式根据肿块所在部位确定。病灶位于阴道上1/3时淋巴结清扫范围以盆腔淋巴结为主,位于阴道下1/3时以腹股沟淋巴结清扫为主。由于阴道部位特殊,局部扩大切除术指切除肿瘤时切缘距肿瘤1~2 cm。
放疗主要用于不能手术者或术后切缘阳性患者。化疗主要以氮烯咪胺(dacarbazine,DTIC)为主,联合顺铂(cisplatin,DDP)或卡铂(carboplatin,CBP) ±长春碱类静脉化疗,疗程为3~6个周期。免疫治疗采用皮下注射干扰素-α1b或2b 300万单位,隔日注射或每周2次。
1.3 随访
随访时间从患者确诊日期开始,至患者复发、转移或死亡,随访截止时间为2012年4月,中位随访时间为57个月(7~156个月)。无进展生存期(progression-free survival,PFS)为初次治疗时间至肿瘤复发时间,总生存期(overall survival,OS)为初次治疗时间至死亡时间或最后随访时间。肿瘤进展时间(time to progression,TTP)为初次治疗到发现肿瘤进展的时间。
1.4 统计学处理
采用SPSS 13.0统计软件对数据进行分析,Kaplan-Meier法绘制生存曲线并计算生存率,采用Log-Rank检验对预后因素进行分析。疗效评价采用国际实体瘤治疗疗效评价标准(RECIST 1.0)[3]。P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料
51例患者平均年龄为56岁(23~84岁)。多见于绝经后妇女(36/51,70.6%)。31例(60.8%)患者首发症状为阴道流血,其次为阴道肿块、阴道分泌物增多。中位肿瘤直径为2.5 cm(0.6~7.0 cm)。22例(43.1%)患者为多中心发生,15例(29.4%)患者病灶位于阴道下1/3。12例(23.5%)患者病灶为无色素性。阴道黑色素瘤的临床分期参照国际妇产科联盟(FIGO)2000年的分期标准[4],宫颈黑色素瘤采用FIGO2009年的分期标准[5],5例ⅣB期患者均为术前体检即发现腹股沟淋巴结肿大患者。
术前细胞学检查发现宫颈细胞异常者占33.3%(5/15)。42例患者行阴道或宫颈肿瘤活检,术前病理诊断为恶性黑色素瘤者35例(83.3%),鳞状细胞癌者3例(7.1%),软组织肉瘤者1例(2.4%),病理学上未发现异常者3例(7.1%)。3例诊断为鳞状细胞癌及1例病理无异常发现的患者为体检检查未发现色素沉着者。免疫组化结果显示,HMB45抗原阳性率为90.5%(19/21),S-100阳性率为94.4%(17/18),VIM阳性率为93.3%(14/15)。
43例(84.3%)患者采取手术治疗,8例(15.7%)患者未行手术治疗。
在手术治疗的43例患者中,12例(27.9%)患者接受术后单纯化疗,6例(13.9%)接受术后单纯免疫治疗,20例(46.5%)接受术后免疫治疗联合化疗、放疗(表1)。

表 1 51例患者的临床病理资料Tab. 1 Patients’ clinicopathologic characteristics

FIGO: International Federation of Gynecology and Obstetrics; RAH: Radical abdominal hysterectomy; UIO: Unilateral inguinal lymphadenectomy; BIO: Bilateral inguinal lymphadenectomy.
2.2 复发转移情况
在随访期内,29例(56.9%)患者发生、复发或转移。其中,13例(44.8%)发生远处转移,10例(34.5%)为局部复发,1例(3.5%)同时发生阴道残端复发及肺转移,5例(17.2%)记录不详。远处转移中8例患者为多发性。常见复发转移部位依次为阴道残端及盆腔(10例,34.5%)、肝(4例,13.9%)、肺(3例,10.3%)、骨(3例,10.3%)和外阴(3例,10.3%),阴道残端及肺(1例,3.5%),不详(5例,17.2%)。
2.3 术后辅助治疗疗效评价
手术联合不同辅助治疗方式的疗效评估(表2)。采用联合放化疗和免疫治疗者中位TTP 17个月,较单纯应用化疗者(9个月)及单纯应用免疫治疗者(11个月)延长。

表 2 术后辅助治疗疗效评价Tab. 2 Responses to adjuvant therapy in patients with primary malignant melanomas of the cervix and vagina
2.4 生存预后分析
51例患者的中位PFS为15个月(95%CI:11.9~18.0个月)。1年无进展生存率为62.1%,2年为32.8%,3年为26.2%,4年为13.1%。中位OS为40个月(95%CI:27.2~52.8个月)。1年总生存率为85.7%,2年为67.2%,3年为53.1%,4年为39.8%。3例患者生存时间超过5年(表3)。51例患者的PFS和OS曲线(图1)。
由于文献报道提示,肿瘤<3 cm的患者预后较好[6],本研究将肿瘤大小同时作为连续性变量及分类变量进行分析。单因素分析结果显示,肿瘤≥3 cm的患者中位OS(28个月)显著低于肿瘤<3 cm的患者(>40个月,P=0.03,图2)。脉管癌栓患者中位OS(6个月)明显低于无脉管癌栓患者(40个月,P<0.01)。盆腔淋巴结转移患者中位PFS(16个月)显著低于无转移患者(5个月,P<0.05)。而年龄、肿瘤部位、有无色素沉着、有无肿瘤家族史、FIGO分期、手术方式、区域淋巴结清扫、肌层浸润深度、切缘等因素未发现与PFS或OS显著相关(表4)。

图 1 51例患者的无进展生存曲线及总生存曲线Fig. 1 PFS curve and OS curve of 51 patients
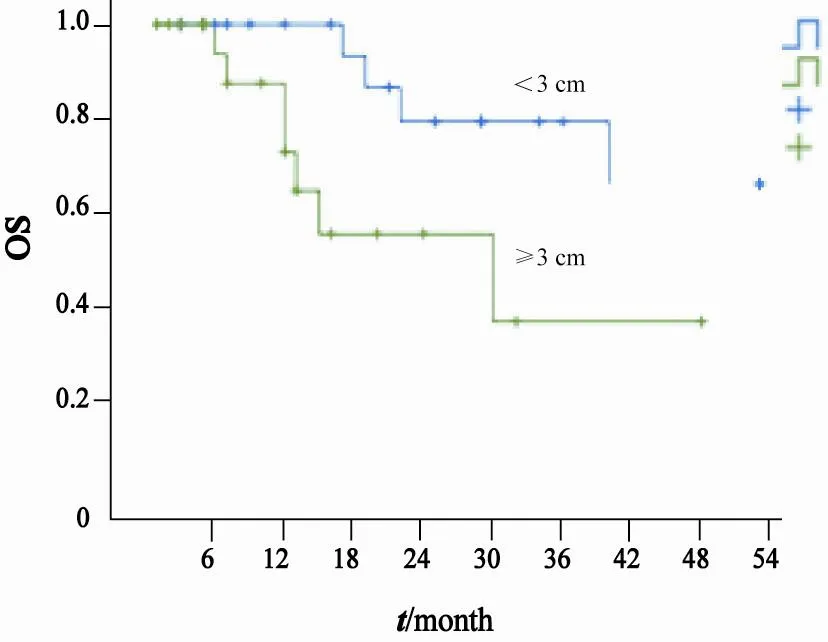
图 2 不同肿瘤大小患者的总生存曲线Fig. 2 OS curves of patients with different tumor size


表 4 单因素预后分析(Log-Rank检验)Tab. 4 Univariate analysis of PFS and OS (Log-Rank test)
3 讨 论
目前,手术是阴道及宫颈恶性黑色素瘤首选的治疗手段[7],方式包括局部扩大切除术、广泛子宫、阴道切除术及盆腔脏器去除术等[2,6]。既往多数文献报道,广泛性手术与局部扩大切除术相比并不能提高局部控制率或延长生存期[6,8]。在本研究中,单因素分析显示,广泛性手术与局部扩大切除术的中位PFS及OS差异无统计学意义。由于阴道及宫颈部位特殊,毗邻尿道、直肠及肛门等重要结构,因而阴道及宫颈恶性黑色素瘤的手术范围与皮肤恶性黑色素瘤不同,要求切缘距肿瘤1~2 cm,避免手术范围过大而引发严重的并发症。
区域淋巴结清扫的价值存在争议。本组中8例患者行腹股沟淋巴结清扫,其中5例为术前已触及腹股沟淋巴结肿大患者,术后病理提示3例转移(3/5,60%),且3例的原发灶均位于阴道下1/3。因此对原发灶位于阴道下段且临床检查提示腹股沟淋巴结肿大者应行腹股沟淋巴结清扫。25例患者接受了盆腔淋巴结清扫,术后病理诊断结果提示,淋巴结转移率为16%(4/25)。单因素分析显示,发生盆腔淋巴结转移患者中位PFS(5个月)显著低于未转移患者(16个月,P=0.05)。由于阴道、宫颈恶性黑色素瘤的病例数少,目前尚无大样本的前瞻性临床研究结果证实淋巴结清扫的意义。如今前哨淋巴结检测技术的发展对于准确判断淋巴结转移具有重要意义,可以避免不必要的淋巴结清扫,值得在阴道及宫颈恶性黑色素瘤中进一步研究[9-10]。
在黑色素瘤的综合治疗中,免疫治疗是治疗黑色素瘤有效方式之一,在皮肤转移性黑色素瘤中已有随机临床试验证实,干扰素-α治疗能延长术后患者的总生存期及无瘤生存期[11]。化疗是重要的辅助治疗手段[12],DTIC是单药治疗黑色素瘤有效化疗药物,其与口服制剂替莫唑胺有效率为12%~20%[13-14]。目前美国国家癌症综合网(NCCN)推荐用于黑色素瘤治疗的化疗方案包括DTIC或替莫唑胺单药治疗、CVD方案(DTIC+DDP+长春碱类)及紫杉醇单药治疗或TP方案(紫杉醇联合铂类)[15]。在转移性黑色素瘤患者中前瞻性随机临床试验表明,与单纯化疗相比,采用不同化疗方案联合免疫治疗可提高疗效[16]。本研究的术后辅助治疗患者中,化疗组中位TTP为9个月,免疫治疗组为11个月,化疗联合免疫治疗组为13个月,提示术后联合应用辅助化疗及免疫治疗可能具有协同作用。
目前特异性免疫治疗及靶向治疗的迅速发展为宫颈及阴道恶性黑色素瘤的治疗提供了新的治疗手段。2011年,FDA批准了针对细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte antigen,CTLA-4)的特异性抑制剂伊匹单抗(ipilimumab)以及针对MAPK通路下游效应因子BRAF突变的特异性抑制剂维罗非尼(vemurafenib)用于晚期黑色素瘤的治疗[17-20]。黏膜黑色素瘤中KIT突变较常见,可发生于大约25%的患者[21]。Ⅱ期临床试验中表明,KIT的小分子抑制剂伊马替尼(imatinib)在治疗25例肢端、黏膜或慢性光损伤部位发生的晚期黑色素瘤的过程中,分别获得2例完全缓解及4例部分缓解,中位TTP和OS分别为12周和46.3周[22],值得在阴道及宫颈恶性黑色素瘤中进一步研究。
总之,原发性阴道及宫颈恶性黑色素瘤是一类恶性程度高、极易局部复发和远处转移、预后差的肿瘤。采用局部治疗(手术、放疗)联合化疗及免疫治疗的综合治疗方法,有望改善预后,提高患者的生活质量。靶向治疗在阴道及宫颈恶性黑色素瘤患者中的应用前景值得期待。
[1] 曹泽毅主编. 中华妇产科学(下册)[M]. 2版, 北京, 卫生人民出版社, 1999: 2069.
[2] FRUMOVITZ M, ETCHEPAREBORDA M, SUN C C, et al. Primary malignant melanoma of the vagina[J]. Obstet Gynecol, 2010, 116(6): 1358-1365.
[3] THERASSE P, ARBUCK S G, EISENHAUER E A, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatmentof Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3): 205-216.
[4] FIGO Committee on Gynecologic Oncology. Current FIGO staging for cancer of the vagina, fallopian tube, ovary, and gestational trophoblastic neoplasia[J]. Int J Gynaecol Obstet, 2009, 105(1): 3-4.
[5] PECORELLI S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium[J]. Int J Gynaecol Obstet, 2009, 105(2): 103-104.
[6] MINER T J, DELGADO R, ZEISLER J, et al. Primary vaginal melanoma: A critical analysis of therapy[J]. Ann Surg Oncol, 2004, 11(1): 34-39.
[7] PIURA B. Management of primary melanoma of the female urogenital tract[J]. Lancet Oncol, 2008, 9(10): 973-981.
[8] TCHEUNG W J, SELIM M A, HERNDON J N, et al. Clinicopathologic study of 85 cases of melanoma of the female genitalia[J]. J Am Acad Dermatol, 2012, 67(4): 598-605.
[9] DHAR K K, DAS N, BRINKMAN D A, et al. Utility of sentinel node biopsy in vulvar and vaginal melanoma: report of two cases and review of the literature[J]. Int J Gynecol Cancer, 2007, 17(3): 720-723.
[10] WONG S L, BALCH C M, HURLEY P, et al. Sentinel lymph node biopsy for melanoma: American Society of Clinical Oncology and Society of Surgical Oncology joint clinical practice guideline[J]. J Clin Oncol, 2012, 30(23): 2912-2918.
[11] MOCELLIN S, PASQUALI S, ROSSI C R, et al. Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis[J]. J Natl Cancer Inst, 2010, 102(7): 493-501.
[12] 安菊生, 吴令英, 李宁, 等. 生殖系统原发性恶性黑色素瘤42例临床分析[J]. 中华妇产科杂志, 2007, 42(5): 320-324.
[13] YI J H, YI S Y, LEE H R, et al. Dacarbazine-based chemotherapy as first-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia[J]. Melanoma Res, 2011, 21(3): 223-227.
[14] SERRONE L, ZEULI M, SEGA F M, et al. Dacarbazine-based chemotherapy for metastatic melanoma: thirty-year experience overview[J]. J Exp Clin Cancer Res, 2000, 19(1): 21-34.
[15] NCCN clinical practice guidelines of melanoma. Version 3.2012. Available at: www.nccn.com[EB/OL].
[16] IVES N J, STOWE R L, LORIGAN P, et al. Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients[J]. J Clin Oncol, 2007, 25(34): 5426-5434.
[17] ROBERT C, THOMAS L, BONDARENKO I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J]. N Engl J Med, 2011, 364(26): 2517-2526.
[18] HODI F S, O’DAY S J, MCDERMOTT D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. N Engl J Med, 2010, 363(8): 711-723.
[19] CHAPMAN P B, HAUSCHILD A, ROBERT C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J]. N Engl J Med, 2011, 364(26): 2507-2516.
[20] FLAHERTY K T, PUZANOV I, KIM K B, et al. Inhibition of mutated, activated BRAF in metastatic melanoma[J]. N Engl J Med, 2010, 363(9): 809-819.
[21] CARVAJAL R D, ANTONESCU C R, WOLCHOK J D, et al. KIT as a therapeutic target in metastatic melanoma[J]. JAMA, 2011, 305(22): 2327-2334.
[22] VAYSSE C, PAUTIER P, FILLERON T, et al. A large retrospective multicenter study of vaginal melanomas: implications for new management[J]. Melanoma Res, 2013, 23(2): 138-146.
Prognosis of 51 patients with primary malignant melanomas of the cervix and vagina
YANG Li, WU Xiao-hua, ZHANG Zhi-yi, LI Zi-ting, WANG Hua-ying, ZANG Rong-yu, CHENG Xi (Department of Gynecological Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
CHENG Xi E-mail: cheng_xi1@hotmail.com
Background and purpose: Primary malignant melanomas of the uterine cervix and vagina are rare neoplasms with very poor prognosis. This article aimed at investigating the clinicopathologic characteristics, treatment and prognosis of primary malignant melanomas of the cervix and vagina. Methods: The clinical data of 51 patients with primary malignant melanomas of the cervix and vagina treated at Fudan University Shanghai Cancer Center from Dec.1998 to Jul. 2011 were reviewed. Results: The 2- and 4-year progression-free survival (PFS) rates were 32.8% and 13.1%, respectively. The 2- and 4-year overall survival (OS) rates were 67.2% and 39.8%, respectively. Three patients survived more than 5 years. Twenty-nine (56.9%) patients had a recurrence. The common sites were vaginal stump/ pelvis (10 patients, 34.5%), liver (4 patients, 13.9%), lung (3 patients, 10.3%), bone (3 patients, 10.3%) and vulva (3 patients, 10.3%). Larger tumor size and lymphovascular space invasion were the independent predictors of poor OS (P<0.05). Pelvic lymph nodes metastases were associated with shorter PFS (P=0.05). Among them, those who
combined immunotherapy and chemoradiotherapy achieved longer median time to progression (TTP) (17 months) compared with patients who had chemotherapy alone (9 months) or immunotherapy alone (11 months). Conclusion: Primary melanomas of cervix and vagina have a very poor prognosis. The multidisciplinary treatment of combining surgery, chemoradiotherapy, and immunotherapy can improve the patients’ prognosis.
Vaginal melanoma; Cervical melanoma; Surgery; Chemotherapy; Radiotherapy; Immunotherapy; Prognosis
10.3969/j.issn.1007-3969.2013.07.011
R737.34
:A
:1007-3639(2013)07-0540-07
2012-12-28
2013-05-30)
程玺 E-mail:cheng_xi1@hotmail.com
