AQP3对体外培养的牛卵母细胞胞质直径的影响
2013-06-07张亚伟张德锋刘明兰雷安民
安 鹏, 张亚伟, 张德锋, 刘明兰, 雷安民
西北农林科技大学动物医学院,陕西省干细胞工程技术研究中心,陕西杨凌712100
AQP3对体外培养的牛卵母细胞胞质直径的影响
安 鹏, 张亚伟, 张德锋, 刘明兰, 雷安民*
西北农林科技大学动物医学院,陕西省干细胞工程技术研究中心,陕西杨凌712100
哺乳动物卵母细胞的体外成熟培养技术与显微实时摄影技术相互结合,使得体外培养卵母细胞成熟过程的全程记录监控成为可能。本研究利用这一技术对牛卵母细胞体外培养过程的形态学变化进行了观测并进行了一些初步分析,用以监测卵母细胞体外成熟的过程,初步探索掌握牛卵母细胞体外成熟过程的形态学变化规律,为相关领域的深入研究提供参考。在CO2培养箱内、外分别进行牛卵母细胞的体外成熟培养,在确定环境对卵成熟影响的基础上,利用显微实时摄像系统监控牛卵母细胞体外培养过程中的形态变化与第一极体排出率。结果表明,在CO2培养箱内、外的不同环境下培养,牛卵母细胞成熟率没有显著差异(P>0.05)。通过实时监测卵母细胞成熟过程,发现部分卵母细胞存在一个短时间的胞质膨涨并随之恢复原体积的过程,而且这类卵母细胞最终死亡,造成这种现象的原因推测是与卵子中一种叫做AQP3的水通道蛋白有关。
牛;卵母细胞;体外培养;形态观察;AQP3
随着胚胎工程逐步深入的研究,卵母细胞的体外成熟技术逐步完善,利用体外成熟卵母细胞作为核受体的体细胞克隆在众多的实验室都已经获得成活动物,同时卵母细胞的体外成熟技术也作为人类辅助生殖技术的一个基本支撑技术而在临床治疗中发挥作用。但人们对于卵母细胞的成熟调控机理的认识仍然很局限,临床上卵母细胞的体外成熟效率与卵母细胞的体外成熟质量仍有改善提高的空间[1]。只有通过对卵母细胞成熟进行更为深入的研究,更加深入探索卵母细胞减数分裂的调控因素,才能够解决上述问题。对卵母细胞的体外成熟机制开展研究就需要对卵母细胞成熟过程中涉及的重要蛋白的功能进行研究。目前在对特定蛋白功能进行研究时,多利用哺乳动物卵母细胞的体外成熟培养技术与显微实时摄影技术相互结合,通过对卵母细胞成熟过程的有效记录和监控来分析研究靶蛋白的调控作用。
目前研究发现,卵母细胞的直径和卵泡的直径大小与卵母细胞成熟之间具有一定的关系。在一定范围内,卵母细胞直径相对大一些的卵子经历正常的减数分裂的比率更高[2,3]。对于牛卵泡大小对卵母细胞质量的影响,有报道称,选取直径大于4 mm的卵泡所得的卵母细胞质量更好[4,5]。但是,对于卵母细胞在体外成熟过程中形态变化的文献却鲜见报道。
体外成熟过程通常将卵丘细胞扩散并排出第一极体作为卵子成熟的标志。卵母细胞的成熟分为核成熟和质成熟。受精前卵细胞核会发生生发泡破裂、染色质浓缩和第一极体排出几个明显的形态变化[5],从而达到核成熟;质成熟过程则是在对应于极体排出的部位形成无微绒毛的区域,细胞质周隙扩大,线粒体发生重新分布[6]。卵母细胞成熟过程中细胞质的一系列复杂的变化过程,对卵母细胞以后的受精和发育都具有重要的影响[2]。而形态学上目前并没有对细胞质成熟给出一个确切的评定标准。
本研究利用卵母细胞体外成熟培养技术并结合显微实时摄影技术对牛卵母细胞体外培养过程的形态学变化进行了监测,为深入研究牛卵母细胞的体外成熟调控机制提供参考。
1 材料和方法
1.1 仪器和试剂
实验所用主要仪器设备包括:PCR扩增仪、CO2培养箱、Leica恒温板、保温遮光罩、Eppendorf微量移液器、封口膜、Eppendorf显微镜、实时摄影系统、体式显微镜、一次性35 mm塑料皿(购自NUNC公司)和一次性0.22μm滤器(购自Milipore公司)。
主要试剂为:TCM-199(购自Sigma公司)、牛血清白蛋白(BSA)(购自Amresco)、胎牛血清(FBS)(购自HyClone)、新生牛血清(NBS)、胰岛素-转铁蛋白-亚硒酸钠(ITS)(购自Gibco)、人尿促性素(hMG)(丽珠集团丽珠制药厂)、矿物油(Sigma公司)、注射用青霉素(购自哈药集团制药总厂)、注射用硫酸链霉素(购自华北制药股份有限公司)、尿嘧啶、谷氨酰胺、丙酮酸钠、0.25%透明质酸酶、表皮生长因子(EGF)、雌二醇、卵母细胞裂解液、Takara反转录试剂盒、HgCl2(购自Sigma)、Takara SYBR®Premix Ex TaqTM II等。
1.2 牛卵母细胞的采集
自西安市屠宰场采集性成熟牛的卵巢组织,放入无菌生理盐水(30℃,含有双抗),在6 h内运回实验室进行后续处理。剪去卵巢附属组织,用无菌生理盐水(37℃,含有双抗)清洗3次,选择卵巢表面直径为2~8 mm的卵泡抽取卵泡液,放入10 mL离心管中,静置5 min,弃去上清液,加入6~8 mL的卵母细胞洗液,轻轻吹打后静置3~5 min,再弃去上清液,反复3次,将沉淀物转移到60 mm的培养皿中,体视显微镜下挑选胞质均匀,并有3层以上卵丘细胞紧密包围的卵丘卵母细胞复合体(cumulus-oocyte complexes,COCs)。
1.3 CO2培养箱外卵母细胞的培养
用配制好的新鲜牛卵母细胞成熟液在35 mm塑料nuclone平皿内做80μL液滴,并在其上覆盖不少于2 mL的矿物油直至将液滴完全覆盖。在CO2培养箱中平衡细胞成熟培养液2 h,清洗挑选的COCs 3遍,随机分配到液滴内,每个液滴收集卵母细胞数不超过30枚,将平皿用封口膜封口,放于提前预热至38.5℃的恒温板上,放置一皿洁净的水以保持相对湿度,同时覆盖保温避光罩,稳定培养21~22 h后,用口吸管将COCs移入含0.25%透明质酸酶的培养液内,在38.5℃环境下作用5 min之后,将1 000μL微量移液器调至量程为200μL反复吹打有卵母细胞的培养液,然后将卵母细胞移入牛卵母细胞操作液中,将卵丘细胞仍未剥离干净的卵母细胞继续吹打,在牛卵母细胞操作液里清洗3次完全除去卵母细胞外围的卵丘细胞。在体视显微镜下观察裸卵第一极体(PBI)的排出情况,统计各组数据并计算成熟率。试验过程中设置培养箱内培养的对照组,每组实验设3个重复。
1.4 牛卵母细胞体外培养的形态变化观察
用平衡后的成熟液清洗COCs3遍后,随机分配到含有成熟培养液的培养容器中,在38.5℃、5%(V/V)CO2和最大饱和湿度的培养箱中培养8~10 h。用配制好的新鲜牛卵母细胞成熟液在35 mm塑料培养皿中做液滴,每个液滴10μL,并用矿物油完全覆盖液滴,在CO2培养箱中提前平衡2 h。将COCs移入牛卵母细胞操作液中,清洗3次,再移入含0.25%透明质酸酶的培养液内,38.5℃放置5 min后反复吹打,去除卵母细胞周围的颗粒细胞层,再清洗3次以完全除去卵丘细胞。挑选颗粒细胞被剥离干净而且状态良好的裸卵,移入平衡后的操作液中恢复30 min,然后用成熟液清洗3次,将卵母细胞移入已准备好的10μL液滴中,每个液滴中放的卵母细胞的数目不超过20枚。转移过程中力求将卵母细胞集中在液滴中心位置,将此培养皿用封口膜封口。在Eppendorf显微镜下观察,并结合实时摄影系统对成熟培养11 h的卵母细胞进行连续实时拍摄观察,拍摄时间间隔为4min/帧,连续拍摄12 h,拍摄过程中显微镜观察倍数为200倍视野,观察卵母细胞在此过程中的形态变化。
1.5 卵母细胞中AQP3基因的表达
分别收集实验中胞质膨大与未膨大的卵母细胞以及培养箱中对照组的卵母细胞,用台式酸去除透明带,各取20枚去除透明带的卵子用5μL卵母细胞裂解液裂解,放于-80℃低温冰箱中反复冻融,以求充分裂解,以此为模板进行RT-PCR以获取cDNA,通过半定量PCR检测卵母细胞中AQP3基因的表达。
1.6 卵母细胞胞质膨大的原因
用平衡后的成熟培养液清洗COCs3次,随机分配到含有成熟培养液的培养容器中,在38.5℃、5%(V/V)CO2和最大饱和湿度的培养箱中培养8~10 h后,随机选取部分COCs将其脱去卵丘细胞,随后将其分别置于以下4种不同的环境下培养:①低渗环境中,将已经配制好的成熟液中加入适量的水以配制成低渗成熟液,在35 mm平皿内用20μL低渗成熟液做液滴,表面覆盖矿物油,取20枚卵母细胞置于其中;②低渗成熟液+HgCl2,在配制好的低渗成熟液中添加HgCl2(50μmol/L)以此做20μL的液滴并同样覆盖矿物油,同样取20枚卵母细胞置于此液滴中;(正常成熟液中添加HgCl2(50μmol/L)依上法同样做20μL液滴并将20枚卵母细胞置于其中;(将同样数量的卵母细胞置于用正常成熟液做成的液滴中。将这4种条件下的卵母细胞置于Eppendorf显微镜200倍视野下观察,并结合实时摄影系统对其进行连续实时监测,拍摄时间间隔为4 min/帧,连续拍摄12 h,同时在培养箱中正常培养一组同样数量的卵母细胞,作为阴性对照组。实验进行3次重复。
2 结果与分析
2.1 CO2培养箱外培养卵母细胞成熟率的统计
在CO2培养箱外培养牛卵母细胞并统计卵母细胞成熟率,以在培养箱内正常培养的牛卵母细胞为对照组。结果表明,牛卵母细胞在CO2培养箱外培养,保证卵母细胞培养环境在38.5℃温度恒定,并保证培养环境的饱和湿度,其成熟率与在CO2培养箱内部正常培养的卵母细胞成熟率没有显著差异(P>0.05)(表1)。

表1 不同培养条件下对卵母细胞成熟的影响Table 1 The effect of different culture conditions on oocytesmaturation.
2.2 牛卵母细胞体外培养的形态变化观察
在显微镜下观察发现,卵母细胞胞质内活动剧烈,可以明显看到胞质内成分的运动,随着培养过程的进行,在体外成熟培养18~20 h时,部分卵母细胞出现胞质膨大的现象(图1),胞质直径由119μm上升到121.5μm(表2),持续时间不少于10 min,而且具体持续时间长短视不同的卵母细胞有差异;随后又会有一个恢复到原来状态的过程。但是随后观察发现,胞质内运动剧烈的卵母细胞在发生膨大前剧烈运动停止,表明卵母细胞的生长状态不佳,且最终都死亡。

图1 牛卵母细胞体外培养的形态变化(200×)Fig.1 Morphological changes of bovine oocytes cultured in vitro(200×).

图2 卵母细胞体外培养过程中的直径变化Fig.2 Oocytes cultured in vitro in the process of change in diameter.
2.3 AQP3基因在牛卵母细胞中的表达
水通道蛋白(aquaporins,AQPs)是一种普遍存在于多种类型细胞内的膜通道蛋白(25~34 kDa)有多种亚型[7]。目前已克隆的哺乳动物水通道蛋白家族有13个成员(AQP0~AQP12)[8,9],而且其中11个成员(AQP0~AQP10)已经在雄性和雌性生殖分泌系统中得到鉴定[10]。AQP3作为水通道蛋白家族中的一员,已经在小鼠卵母细胞中发现。研究发现AQP3在小鼠卵母细胞的质量控制以及体外受精率等方面发挥重要作用。取胞质膨大与未膨大及对照组的卵母细胞,裂解后分别经过半定量PCR进行检测,胞质膨大组以及对照组检测到AQP3基因的存在,而胞质未膨大组却没有AQP3基因。由此,我们认为牛卵母细胞胞质是否发生膨大现象与水通道蛋白AQP3的表达与否有重要联系。
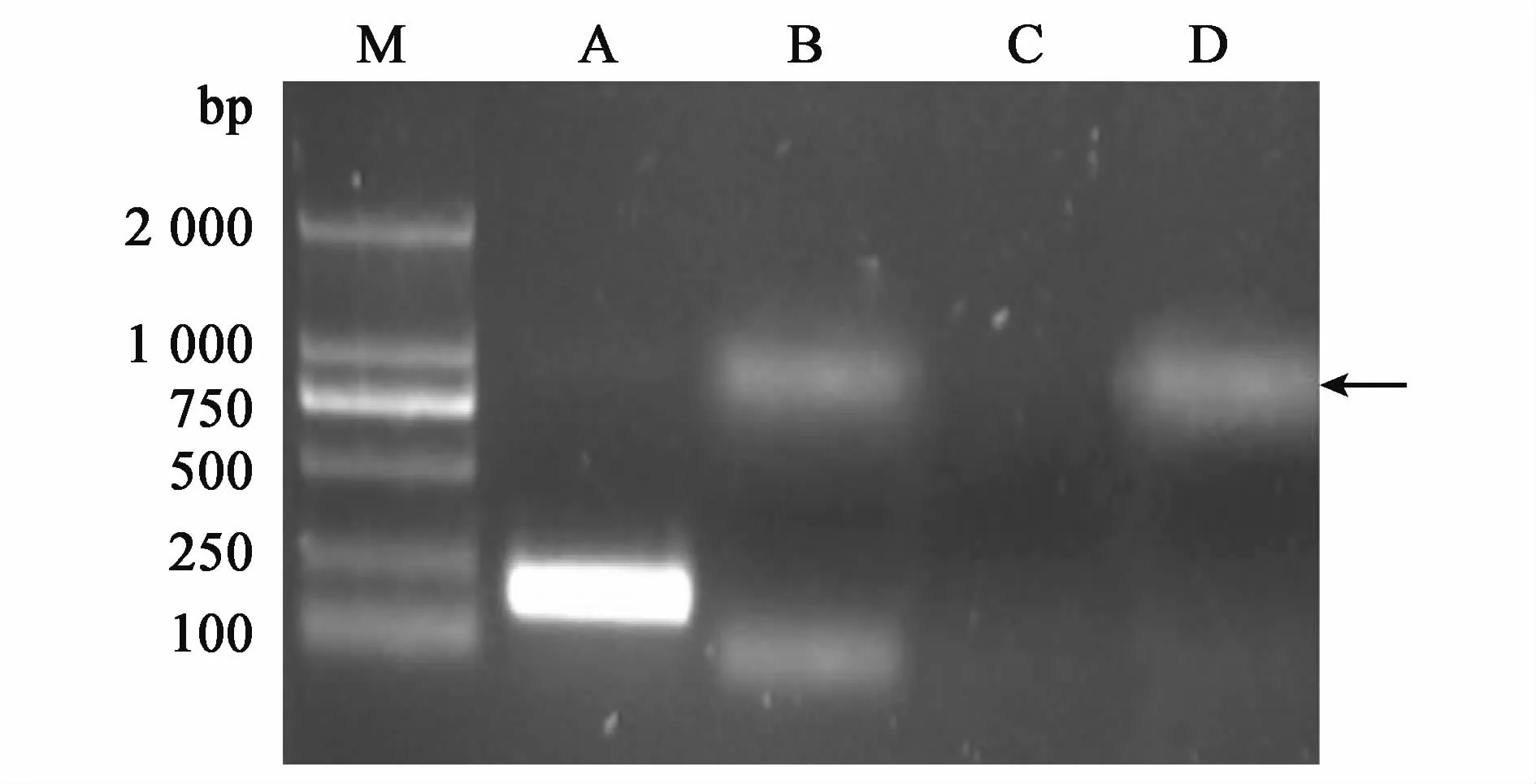
图3 PCR检测AQP3基因在牛卵母细胞中的表达Fig.3 Expression of AQP3 gene in bovine oocytes by PCR.
2.4 牛卵母细胞胞质膨大的原因及与AQP3基因的关系
卵母细胞在低渗成熟液中培养出现胞质膨大的比例高达88.83%,这与正常成熟液中的出现的7.30%的比例相比差异极显著。而在含有HgCl2的低渗成熟液中培养,出现胞质膨大现象的卵母细胞也仅占到8.63%,这与低渗成熟液条件下培养的超过八成的比例有很明显的降低,同时其与正常成熟液培养条件下出现胞质膨大比例的差异不显著(图4)。由此推测,卵母细胞出现胞质膨大现象的直接原因就是低渗环境使细胞外部的水等非电解质通过AQP3通道蛋白进入细胞内部造成的。

图4 不同培养条件下卵母细胞胞质发生膨大的情况Fig.4 The oocyte cytoplasm occurs swollen under different culture conditions.
3 讨论
卵母细胞体外成熟培养技术是哺乳动物生殖研究中必要的一种技术,已经被广泛应用。但是卵母细胞的体外培养技术仍然只局限于实验室中操作,对于所需仪器设备要求严格,所需环境比较苛刻,一些基层科研单位和普通生产单位并不能得以满足,不利于基层单位开展与之相关的研究与应用工作,而且携带不方便。在此之前本实验室曾经利用密闭气袋的方式体外培养牛卵母细胞,并得出应用简易密闭气袋进行体外卵母细胞培养,能够发育到囊胚并且其体外成熟率、卵裂率和囊赔率与正常CO2培养箱中培养相比略有升高的结论[11]。本文中采用的技术不用整个过程都需要CO2培养箱,仅需要矿物油和恒温热板即可,第一极体的排除率相对于正常培养箱组的卵母细胞没有明显的差异。而且本技术的应用,使在显微镜下对卵母细胞发育过程中的形态变化进行实时观察更加便利。
目前为止,牛卵母细胞体外成熟培养技术已经相对成熟。但是卵母细胞在第一次减数分裂过程其形态变化的观察却鲜见报道。卵母细胞的成熟是一个复杂的、动态的过程,有许多代谢事件发生,除了进行积极的mRNAs转录、蛋白质合成外,还有其他一些物质的降解[12]。众所周知,哺乳动物卵母细胞发育过程中会发生两次或三次停滞,第一次停滞发生在第一次减数分裂前期的双线期,即生发泡期[13]。当卵母细胞恢复减数分裂时,发生生发泡破裂(GVBD),继而染色体发生凝集,形成MI期纺锤体,之后进入AI/TI期,排出第一极体(PBI),同时发育停滞在MII期,当受精或者孤雌激活之后,卵母细胞恢复并完成第二次减数分裂排出第二极体(PBII)。
本研究中,我们借助实时摄影技术观察牛的卵母细胞在体外培养过程中形态的变化,卵母细胞在发生膨大前卵胞质的剧烈运动停止,随后出现明显的逐渐胀大随后又恢复到原来的大小,最后趋于死亡的现象。经过多次实时监测发现,不同批次的卵母细胞发生胞质膨大的概率不同,我们认为这可能与卵母细胞的批次不同有关,也可能与卵母细胞的个体差异有关。造成这种膨大现象的原因我们认为可能与一种被称为AQP3的水通道蛋白有关,进一步试验发现其直接原因应该是培养液的低渗环境,使培养液中的水分等非电解质通过AQPs通道蛋白顺利进入卵母细胞内部,进而使卵母细胞体积瞬间膨大,从而影响卵母细胞的质量。
迄今为止,在哺乳动物体内发现至少有13种水通道蛋白(AQP0~AQP12)。在所有已知的AQP中,AQP3为水-甘油亚家族,除对水有高的通透性外,对尿素和甘油也有较高的通透性[14]。发生胞质膨大的卵母细胞可能与AQP3蛋白表达有一定关系。本研究中,我们分别将发生膨大组与未发生膨大组的卵母细胞分别取样,通过PCR检测牛卵母细胞中AQP3基因的表达发现,对照组卵母细胞以及发生膨大的卵母细胞中均存在AQP3的表达,而未发生胞质膨大的卵母细胞中却没有检测到AQP3。随后我们分别通过向等渗和低渗成熟培养液中添加或不添加AQPs的特异性抑制剂HgCl2,实时监测4组卵母细胞体外培养过程中的变化情况,发现低渗培养液中未添加HgCl2组的卵母细胞大部分发生膨大现象并最终趋于死亡。这与我们预期的结果是一致的。Edashige等[15]首次在小鼠MII期卵母细胞中发现了AQP3和AQP7的表达。随后发现诱导AQP3的表达会提高对水和甘油的通透性,对于维持卵子的受精能力有一定作用。试验中发现,低渗培养液造成的卵母细胞的膨大由于HgCl2的参与而受到抑制,Hg2+作为AQPs的特异性抑制剂,特异的抑制卵母细胞水通道蛋白的作用,从而可以抑制低渗溶液中水分等进入卵母细胞,由此可见AQP3在卵母细胞的水分转运方面起着很重要的作用。这与之前的报道结果相符[16]。
[1] 熊炤成,苏雷.哺乳动物卵母细胞体外成熟培养的研究进展[J],中国畜牧兽医,2007,34:71-74.
[2] Lechniak D,Kaczmarek D,StanislawskiD,et al..The ploidy of in vitro matured bovine oocytes is related to the diameter[J].Theriogenology,2002,57:1303-1308.
[3] Lechniak D,Szczepankiewicz D,Kauss D,et al..IVM media,oocyte diameter and donor genotype at RYR1 locus in relation to the incidence of porcine diploid oocytes after maturation in vitro[J].Theriogenology,2005,64:202-212.
[4] Yousaf M R,Chohan K R.Nuclearmorphology,diameter and meiotic competence of buffalo oocytes relative to follicle size[J].Reprod.Fertil.Dev.,2003,15(4):223-229.
[5] Fulka JJ,First N L,Moor R M.Nuclear and cytoplasmic determinants involved in the regulation of mammalian oocyte maturation[J].Mol.Hum.Reprod.,1998,4(1):41-49.
[6] Alpizar E,Spicer L J.Effects of interleukin-6 on proliferation and follicle-stimulating hormone-induced estradiol production by bovine granulosa cells in vitro:dependence on size of follicle[J].Biol.Reprod.,1994,50:38-43.
[7] Verkman A,Mitra A K.Structure and function of aquaporin water channels[J].Am.J.Physiol.Renal Physiol.,2000,278(1):13-28.
[8] Agre P,King L S,Yasui M,et al..Aquaporin water channels-from atomic structure to clinical medicine[J].J.Physiol.,2002,542:3-16.
[9] Agre P,Kozono D.Aquaporin water channels:molecular mechanisms for human diseases[J].FEBS Lett.,2003,555:72-78.
[10] Huang H F,He RH,Sun CC,et al..Function of aquaporins in female and male reproductive systems[J].Hum.Reprod.Update,2006,12(6):785-795.
[11] 赵贵民,吴苏君,刘文强,等.密闭气袋在牛卵母细胞体外成熟培养中的应用[J].中国兽医学报,2011,31:1362 -1365.
[12] 孙韬,李裕强.卵母细胞的体外成熟培养研究进展[J].草食家畜,2003,2:30-34.
[13]Tripathi A,Kumar K V,Chaube SK.Meiotic cell cycle arrest inmammalian oocytes[J].J.Cell Physiol.,2010,223:592 -600.
[14] 毛春蓉,仲建新,练云,等.水通道蛋白在卵巢上皮癌中的表达及意义[J].江苏医药,2012,38:412-415.
[15] Edashige K,Sakamoto M,Kasai M.Expression ofmRNAs of the aquaporin family in mouse oocytes and embryos[J].Cryobiology,2000,40:171-175.
[16] Meng Q X,Gao H J,Xu C M,et al..Reduced expression and function of aquaporin-3 in mouse metaphase-Ⅱ oocytes induced by controlled ovarian hyperstimulation were associated with subsequent low fertilization rate[J].Cell.Physiol.Biochem.,2008,21:123-128.
Effects of AQP3 on Bovine Oocytes Cytoplasm Diameter During IVM
AN Peng,ZHANG Ya-wei,ZHANG De-feng,LIU Ming-lan,LEIAn-min*
Shaanxi Center of Stem Cell Engineering& Technology,College of Veterinary Medicine,Northwest A& F University,Shaanxi Yangling 712100,China
Combination of the IVM of mammalian oocytes and microstructure of real-time photographic technique makes the monitoring of the entire process of oocyte IVM possible.We observed morphological changes of bovine oocytes cultured in vitro using this technology and made preliminary analysis.The purpose of this study ismonitoring oocytematuration process in vitro,exploring and mastering the morphological variation pattern of bovine oocytes maturation process in vitro,so as to provide a reference for in-depth study of related fields.Bovine oocytes matured in vitro inside and outside CO2incubator,respectively.Base on confirming the impactofenvironmenton the oocytesmaturation,microscopic real-time camera system was used tomonitor morphological changes of bovine oocytesmaturation process in vitro and the rate of the first polar body emission in the process.The results showed thatbovine oocytematuration rate indicated no significant differences(P>0.05)under differentenvironments such as inside or outside the CO2incubator.Through real-timemonitoring oocytematuration process,we found that partof oocyte cytoplasm would swelland restore subsequently in a short period of time,and then died eventually.The cause of this phenomenon was presumably associated with a called AQP3 water channel protein in oocytes.
bovine;oocytes;IVM;morphological observation;AQP3
10.3969/j.issn.2095-2341.2013.01.07
2012-12-30;接受日期:2013-01-09
国家自然科学基金项目(31172280)资助。
安鹏,硕士研究生,研究方向为动物胚胎工程。E-mail:ap-315@163.com。*通讯作者:雷安民,主要从事卵母细胞减数分裂调控以及核移植。Tel:029-87080068;E-mail:anminleiryan@nwsuaf.edu.cn
