下调组蛋白去乙酰化酶1对胰腺癌细胞DNA损伤修复及放化疗抵抗的影响
2013-06-07
复旦大学附属肿瘤医院胰腺肝胆外科,胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032
下调组蛋白去乙酰化酶1对胰腺癌细胞DNA损伤修复及放化疗抵抗的影响
徐近 朱文伟 秦毅 许文彦 吉顺荣 虞先濬
复旦大学附属肿瘤医院胰腺肝胆外科,胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:组蛋白去乙酰化酶1(sirtuin type 1,SIRT1)在胰腺癌等恶性肿瘤中高表达,可能与肿瘤的恶性表型相关。本研究采用RNA干扰技术下调胰腺癌PANC1细胞中SIRT1的表达,探讨其对DNA损伤修复及放化疗抵抗的影响。方法:用彗星试验检测细胞敲除SIRT1后DNA损伤修复能力;蛋白质印迹法(Western blot)检测NBS1、γH2AX DNA修复相关蛋白的表达水平;最后用克隆存活实验和细胞增殖实验观察胰腺癌细胞对放化疗的敏感性。结果:下调SIRT1显著抑制了胰腺癌细胞的DNA损伤修复能力;抑制了DNA损伤修复相关蛋白NBS1磷酸化活化;增强了细胞对放化疗的敏感性。结论:SIRT1基因表达下调可抑制胰腺癌细胞DNA损伤修复能力,提高其对放化疗的敏感性,机制上可能与SIRT1下调后NBS1磷酸化活化受抑制相关。
组蛋白去乙酰化酶1;胰腺癌;DNA损伤修复;NBS1
放化疗抵抗是胰腺癌治疗失败、疾病进展的主要原因[1-2]。目前已知多种机制参与调控胰腺癌的治疗抵抗[3]。既往研究证实,肿瘤细胞DNA损伤修复不仅是肿瘤发生、发展的重要原因,而且和肿瘤的放化疗抵抗密切相关[4-6]。
组蛋白去乙酰化酶1(sirtuin type 1,SIRT1)是一种依赖于烟酰胺腺嘌呤二核苷酸(nicotin-amide adenine dinucleotide,NAD)的去乙酰化酶,与多种细胞生物学功能如基因转录沉默、细胞生长周期调节、能量代谢包括糖异生和脂质累积、胰岛素分泌、血管生成、神经保护、病毒感染以及细胞衰老有着密切关联[7]。近期研究还发现,SIRT1与肿瘤的发生、发展,甚至与肿瘤的化疗耐药密切相关[8]。
本研究采用RNA干扰技术抑制SIRT1基因在胰腺癌细胞系PANC1中的表达,研究PANC1细胞DNA损伤修复及放化疗敏感性的差异变化;并检测DNA损伤修复关键蛋白NBS1磷酸化表达水平,初步分析SIRT1在胰腺癌细胞DNA损伤修复中的作用机制。
1 材料和方法
1.1 材料
人胰腺癌细胞株PANC1购自中国典型培养物保藏中心。总RNA提取试剂TRIzol和脂质体LipofectamineTM2000购自Invitrogen公司,TAKARA逆转录及实时定量PCR试剂盒购自宝生物工程(大连)有限公司,DMEM高糖培养基购自美国GibcoBRL公司,SIRT1抗体、HRPB标记二抗、NBS1抗体、p-NBS1抗体、γH2AX抗体及GAPDH抗体均购自美国Cell Signaling Technology(CST)公司,HRP显色试剂盒购自Piece公司。实验中涉及的引物由上海Sangon公司合成,MTT细胞增殖试剂盒购自碧云天公司,Comet assay检测试剂盒购自美国Trevigen公司。
1.2 方法
1.2.1 shRNA的设计及载体构建
依据Ambion公司网页上在线软件设计针对SIRT1的shRNA表达序列,由生工合成寡核苷酸片段。PCR反应条件:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,共30个循环。PCR产物经1.0%的琼脂糖凝胶电泳后在紫外光下切下目的条带,用Axygen胶回收试剂盒回收纯化,经EcoRⅠ和XhoⅠ双酶切2 h,置于16 ℃ T4DNA连接酶连接过夜,用DH5α感受态细菌转化,挑取单个菌落小提质粒,酶切鉴定条带位置正确后送上海英骏生物技术有限公司测序鉴定。测序正确的质粒采用质粒大量抽提试剂盒(德国Eppendoff公司),按使用说明书抽提纯化质粒,-20 ℃冻存备用。
1.2.2 细胞培养和shRNA转染
人胰腺癌细胞株PANC1在含10%小牛血清的高糖型DMEM培养基中,于37 ℃、CO2体积分数为5%的条件下培养传代。细胞以3×105个/孔的密度接种于6孔板。当细胞生长密度达到50%~70%时,用脂质体法转染,具体操作按试剂说明书进行。实验组每孔分别加入含有终浓度为200 nmol/L的shRNASIRT1-1、shRNASIRT1-2及shRNASIRT1-3质粒的OPTIMEM无血清培养基,同时设立对照组(转染不针对任何靶基因的shRNA-SCR和野生型细胞WT)。
1.2.3 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测
采用TRIzol法提取细胞总RNA,紫外分光光度法测定RNA浓度。RNA逆转录的方法按试剂盒说明书进行,这个过程置于冰上操作。对mRNA样本经紫外分光光度仪定量后,以500 ng mRNA为模板采用逆转录试剂盒进行逆转录,然后以100 ng cDNA为模板根据引物进行PCR扩增,RT-PCR产物在2%琼脂糖凝胶上电泳鉴定。此后采用TAKARA实时定量PCR试剂盒处理样品并在Eppendorf Mastercycler Realplex型实时定量PCR仪上进行扩增,同时加做熔点曲线步骤检测引物特异性,记录各孔的CT值。
1.2.4 蛋白质印迹法(Western blot)检测
收集细胞,加入150 μL细胞裂解液进行裂解。于冰上裂解20 min,所得裂解液以14 000×g,4 ℃离心1 min。BCA法检测蛋白浓度,蛋白加上样缓冲液95 ℃变性5 min后进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后将蛋白转至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入一抗(SIRT1、GAPDH、NBS1、p-NBS1和γH2AX;Cell signaling technology)杂交,4 ℃过夜,PBST洗膜3次,加羊抗兔IgGHRP,室温杂交1 h,PBST洗膜3次。用化学发光法显色,Las3000曝光机器曝光,根据膜显影情况,适度调节曝光时间。
1.2.5 MTT增殖及克隆形成检测
1.2.5.1 MTT增殖实验
取生长良好的两种细胞shSCR-PANC1和shSIRT1-PANC1,消化并计数制备成单细胞悬液,均匀地接种于96孔培养板上,每孔200 μL,含细胞5 000个,均设8个复孔。各组细胞贴壁24 h后,分别加入相应浓度顺铂(0、5、10和20 μg/mL)处理48 h后每孔加入MTT溶液(5 mg/mL)20 μL,继续培养4 h,弃上清液,每孔再加上DMSO 150 μL,振荡10 min,选择490 nm波长测定各孔吸光度值(A)。
1.2.5.2 克隆形成实验
将shSCR-PANC1和shSIRT1-PANC1细胞制成单细胞悬液,分别加入6孔板内,待细胞贴壁48 h后置于6 MV直线加速器接受外照射,剂量分别为2、4和8 Gy。细胞继续培养2周后,纯甲醛固定30 min,Giemsa染色15 min,晾干。计算细胞数大于50个的克隆数。
1.2.6 彗星检测试验(Comet Assay)
shSCR-PANC1和shSIRT1-PANC1细胞分别接种2孔到6孔板中。其中1孔细胞不处理,1孔细胞用20 ng/mL的放线菌素D(ActD)处理6 h诱导凋亡。6 h后,吸弃培养基,胰酶消化重悬细胞,定量至106个/mL。用75 μL 0.5%(in PBS)低熔点胶和10 000个细胞(10 μL)混匀,滴加在正常熔点琼脂糖胶上,裂解细胞,琼脂糖胶凝固后,4 ℃浸泡在裂解缓冲液中2 h使细胞充分裂解。电泳(电泳前载玻片浸泡在电泳缓冲液中20 min,使其DNA充分解旋),设定电压24 V(大约0.74 V/cm),电泳时间30 min。中和液中浸泡玻璃板5 min,重复3次,载玻片上琼脂糖胶上滴加染色缓冲液,使其覆盖整个区域,暗处放置10 min,然后在蒸馏水中清洗0.5 h。荧光显微镜下(红色通道)拍照记录。每个样品中至少随机挑选25个细胞测定,每组测定重复3次取平均值。
1.3 统计学处理
采用SPSS 16.0统计学软件进行分析,实验数据以x±s 表示,组间差异采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 转染shRNA对PANC1细胞SIRT1 mRNA及蛋白表达的影响
设计针对SIRT1基因的3条小RNA干扰序列(shSIRT1-1-3)和随机对照序列(shSCR),转染人胰腺癌PANC1细胞48 h后,RT-PCR及Western blot检测结果显示,与WT和shSCR的对照细胞相比,表达干扰序列shSIRT1-3的细胞中SIRT1 mRNA和蛋白水平下调最显著,抑制率可达90%以上(P<0.001,图1)。
2.2 下调SIRT1对细胞DNA损伤修复能力的影响
运用20 ng/mL的ActD处理细胞诱变DNA损伤,测定对照细胞和SIRT1敲除细胞彗星率变化的差异。结果显示,对照组(shSCR)和SIRT1敲除组细胞在放线菌素D的作用下,彗星率较各自未处理组显著增高,但SIRT1敲除细胞在ActD处理后彗星率增高更为明显,差异有显著的统计学意义(P<0.01,图2)。
2.3 沉默SIRT1对DNA损伤修复相关蛋白NBS1磷酸化表达水平的影响
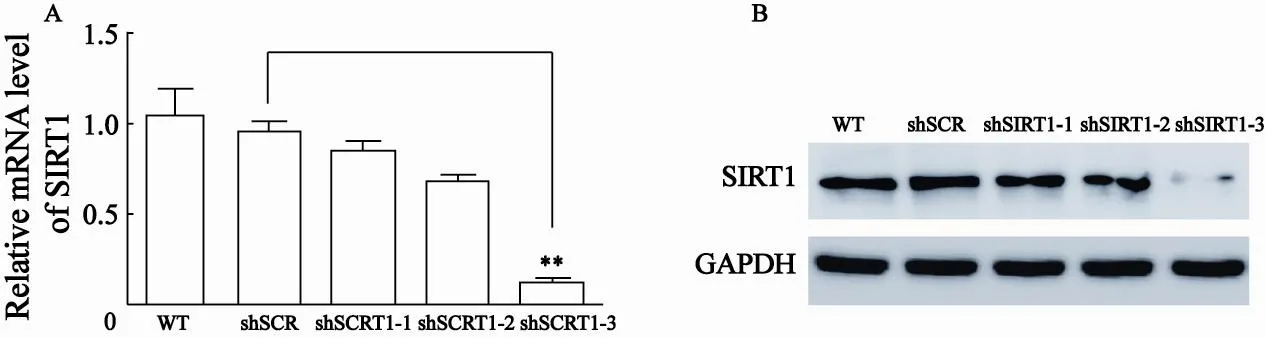
图 1 RT-PCR及Western blot检测shRNA转染后48 h SIRT1mRNA及蛋白表达水平变化Fig. 1 RT-PCR and Western blot analysis of SIRT1 expression after transfect of SIRT1 shRNA for 48 h

图 2 沉默SIRT1对PANC1细胞DNA损伤修复的影响Fig. 2 Effect of specific silencing of SIRT1 on cell DNA damage repair of PANC1 pancreatic cancer cell
Western blot检测结果显示,与对照细胞相比,ActD处理细胞后,细胞内磷酸化NBS1蛋白表达水平显著上调,而总蛋白水平在各组细胞中无显著变化。而转染针对SIRT1基因的shRNA后,shSIRT1-PANC1细胞磷酸化NBS1蛋白表达水平较对照细胞shSCR-PANC1显著下调,差异有统计学意义(P<0.01,图3)。
2.4 转染shRNA对PANC1细胞放化疗敏感性的影响
细胞增殖实验结果显示,沉默SIRT1后PANC1细胞对顺铂的药物敏感性显著高于对照组,差异有统计学意义(P<0.01,图4A)。同时,克隆存活实验表明,下调SIRT1亦显著增加胰腺癌细胞株PANC1对放射线照射的敏感性(P<0.01,图4B)

图 3 Western blot检测SIRT1沉默对磷酸化NBS1和γH2AX蛋白表达的影响Fig. 3 Western blot analysis of phosphorylation NBS1 and γH2AX after down-regulation of SIRT1

图 4 抑制SIRT1基因表达对胰腺癌PANC1细胞放化疗敏感性的影响Fig. 4 Specific silencing of SIRT1 on chemo-and radiosensitivity of PANC1 pancreatic cancer cell.
3 讨 论
放射线或部分化疗药物造成细胞DNA损伤的一个最常见保护性反应是G2/M期延长或停滞[9]。G2/M期具有细胞周期检查点的活性,负责监督细胞对DNA损伤的修复。DNA损伤修复是恢复正常DNA序列结构和维持遗传信息相对稳定有关的细胞反应。DNA损伤修复基因可修复不同原因导致的DNA损伤,从而保护遗传信息的完整性[10]。
DNA损伤修复过程中,染色质的重构是非常重要的一部分,通过染色质的重塑修复受损的DNA,保护细胞免受伤害[11]。既往的研究结果证实,SIRT家族成员之一的SIRT1在真核细胞的DNA损伤修复中起了重要的作用[12]。本研究结果进一步证实了前期发现,利用RNA干扰技术沉默胰腺癌细胞PANC1中SIRT1的表达能显著抑制其DNA损伤修复反应。同时,Western blot结果显示,沉默SIRT1能显著抑制DNA修复关键蛋白NBS1的磷酸化活化。NBS1是激活DNA损伤修复信号传导的关键分子,其在维持细胞基因组的稳定和DNA的损伤修复过程中均具有重要作用[13]。因此我们认为,SIRT1可通过促进NBS1磷酸化活化,进而促进胰腺癌细胞DNA的损伤修复能力。
现有的多种临床治疗肿瘤的手段中,通过靶向肿瘤细胞DNA,促进其断裂是放疗和部分化疗药物的主要作用原理[14]。胰腺癌细胞有着天然对放化疗高度耐药的生物学行为[15],因此其对各种治疗手段导致的DNA损伤可能存在极强的自身修复能力。已有文献报道,SIRT1在胰腺癌细胞中呈显著高表达,而且其表达和胰腺癌细胞的化疗的耐药性有一定关系[16]。本研究结果也证实,抑制SIRT1能部分恢复胰腺癌细胞对放疗和化疗的敏感性。提示,通过检测SIRT1的表达水平不仅可以预测胰腺癌患者对放化疗的疗效反应,而且还可以作为干预胰腺癌放化疗抵抗的重要靶点。靶向SIRT1进行干预并同时联合放化疗这一新的治疗策略,有可能使对常规放化疗不敏感的胰腺癌由不治之症变成部分可治。
综上所述,SIRT1可通过促进NBS1磷酸化,促进胰腺癌细胞的DNA损伤修复反应进而促进其对放化疗抵抗。本研究为胰腺癌的治疗提供了新的思路,也为逆转局部进展期或晚期胰腺癌的放化疗抵抗提供了新的分子靶标。
[1] GARRIDO-LAGUNA I, USON M, RAJESHKUMAR N V, et al. Tumor engraftment in nude mice and enrichment in stroma-related gene pathways predict poor survival and resistance to gemcitabine in patients with pancreatic cancer[J]. Clin Cancer Res, 2011, 17(17): 5793-5800.
[2] TERRY S Y, VALLIS K A. Relationship between chromatin structure and sensitivity to molecularly targeted auger electron radiation therapy [J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1298-1305.
[3] SHI S, YAO W, XU J, et al. Combinational therapy: new hope for pancreatic cancer? [J]. Cancer Lett, 2012, 317(2): 127-135.
[4] WONG H H, LEMOINE N R. Pancreatic cancer: molecular pathogenesis and new therapeutic targets [J]. Natl Rev Gastroenterol Hepatol, 2009, 6(7): 412-422.
[5] SANCAR A, LINDSEY-BOLTZ L A, UNSAL-KACMAZ K, et al. Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints [J]. Annu Rev Biochem, 2004, 73: 39-85.
[6] ZHOU B B, ELLEDGE S J. The DNA damage response: putting checkpoints in perspective [J]. Nature, 2000, 408(6811): 433-439.
[7] GRUNSTEIN M. Histone acetylation in chromatin structure and transcription [J]. Nature, 1997, 389(6649): 349-352.
[8] LIU T, LIU P Y, MARSHALL G M. The critical role of the class Ⅲ histone deacetylase SIRT1 in cancer [J]. Cancer Res, 2009, 69(5): 1702-1705.
[9] JIRAWATNOTAI S, HU Y, MICHOWSKI W, et al. A function for cyclin D1 in DNA repair uncovered by protein interactome analyses in human cancers [J]. Nature, 2011, 474(7350): 230-234.
[10] KIM M P, GALLI G E. Gemcitabine resistance in pancreatic cancer: picking the key players [J]. Clin Cancer Res, 2008, 14(5): 1284-1285.
[11] WU L, LUO K, LOU Z, et al. MDC1 regulates intra-S-phase checkpoint by targeting NBS1 to DNA double-strand breaks[J]. Proc Natl Acad Sci U S A, 2008, 105(32): 11200-11205.
[12] FAN W, LUO J. SIRT1 regulates UV-induced DNA repair through deacetylating XPA [J]. Mol Cell, 2010, 39(2): 247-258.
[13] WILLIAMS R S, DODSON G E, LIMBO O, et al. Nbs1 flexibly tethers Ctp1 and Mre11-Rad50 to coordinate DNA doublestrand break processing and repair [J]. Cell, 2009, 139(1): 87-99.
[14] STUCKI M, CLAPPERTON J A, MOHAMMAD D, et al. MDC1 directly binds phosphorylated histone H2AX to regulate cellular responses to DNA double-strand breaks [J]. Cell, 2005, 123(7): 1213-1226.
[15] PARSELS L A, MORGAN M A, TANSKA D M, et al. Gemcitabine sensitization by checkpoint kinase 1 inhibition correlates with inhibition of a Rad51 DNA damage response in pancreatic cancer cells [J]. Mol Cancer Ther, 2009, 8(1): 45-54.
[16] ZHAO G, CUI J, ZHANG J G, et al. SIRT1 RNAi knockdown induces apoptosis and senescence, inhibits invasion and enhances chemosensitivity in pancreatic cancer cells [J]. Gene Ther, 2011, 18(9): 920-928.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
Impact of SIRT1 silencing on DNA damage repair and chemoradiotherapy resistance in human pancreatic cancer
XU Jin, ZHU Wen-wei, QIN Yi, XU Wen-yan, JI Shun-rong, YU Xian-jun (Department of Pancreas and Hepatobiliary Surgery, Pancreas Cancer Institute, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China) Correspondence to: YU Xian-jun E-mail: yuxianjun88@hotmail.com
Background and purpose:SIRT1 is widely up-regulated in different cancers including pancreatic cancer (PC) and may be involved in the cellular malignant transformation. This study was designed to investigate the effects of down-regulated SIRT1 expression on the DNA damage repair capacity as well as chemoradiosensitivity of PC cells. Methods:DNA damage repair was analyzed by comet assay under the condition of SIRT1 suppression. Western blot was performed to investigate the expression of DNA repair associated proteins including, NBS1 and γH2AX. Clonogenic survival assay and MTT assay were used to detect the chemoradiosensitivity following SIRT1 silencing. Results:Knockdown of SIRT1 significantly impaired DNA damage repair capacity while increased the sensitivity of PANC1 cells to radiation and chemotherapy. Mechanically, down-regulation of SIRT1 inhibited NBS1 activation in the presence of DNA damage repair. Conclusion:Down-regulated SIRT1 expression inhibits the activation of NBS1 and thus is involved in DNA damage repair arrest and restoration of chemoradiosensitivity.
SIRT1; Pancreatic cancer; DNA damage repair; NBS1
R735.9
:A
:1007-3639(2013)02-0093-06
2012-12-10
2013-01-20)
虞先濬 E-mail:yuxianjun88@hotmail.com
DOI: 10.3969/j.issn.1007-3969.2013.02.003
