CBX7在胃癌干细胞样细胞中的表达及其功能研究
2013-06-07赵丽琴郭伟剑张晓伟屈晓飞王小凤倪苏婕黄明主
赵丽琴郭伟剑张晓伟屈晓飞王小凤倪苏婕黄明主
1.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032;
2.华中科技大学同济医学院附属协和医院肿瘤中心,湖北 武汉 430022
CBX7在胃癌干细胞样细胞中的表达及其功能研究
赵丽琴1郭伟剑1张晓伟1屈晓飞2王小凤1倪苏婕1黄明主1
1.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032;
2.华中科技大学同济医学院附属协和医院肿瘤中心,湖北 武汉 430022
背景与目的:色素框同源蛋白7(chromobox protein homolog 7,CBX7)是一种参与调控细胞增殖衰老的转录抑制因子,属于PcG家族成员,其在维持胚胎干细胞自我更新和全能性中发挥重要作用,但CBX7在肿瘤干细胞中的表达和作用鲜见报道。本研究旨在探讨CBX7在胃癌干细胞样细胞中的表达及其对胃癌干细胞相关特性的调节作用。方法:采用无血清悬浮培养法从MKN28胃癌细胞系中分离干细胞样亚群,蛋白质印迹法(Western blot)检测干细胞相关因子Oct4、β-catenin和CBX7蛋白表达。脂质体法将CBX7干扰质粒(CBX7i)和对照质粒(Ctrli)分别转染入MKN28胃癌细胞,转染后荧光显微镜观察转染效率,Western blot检测CBX7下调效果,无血清悬浮培养检测细胞自我更新能力,平板克隆检测细胞克隆增殖能力改变。结果:无血清培养MKN28细胞,极少数细胞能形成干细胞样悬浮球,其高表达Oct4、β-catenin两个干细胞相关因子,且明显高表达PcG家族蛋白CBX7。基因转染下调CBX7表达后,胃癌细胞无血清培养成球率降低,克隆形成率下降。结论:CBX7在胃癌干细胞样细胞中高表达,其在调控胃癌干细胞自我更新和增殖能力中发挥重要作用。
色素框同源蛋白7;胃癌干细胞;自我更新;细胞增殖
[Key words] CBX7; Gastric cancer stem cells; Self-renewal; Cell proliferation
肿瘤干细胞(cancer stem cells)是肿瘤中一小部分具有干细胞性质的细胞群体,具有自我更新、无限增殖能力和不定向分化潜能,是形成不同分化程度肿瘤细胞和肿瘤不断扩展的源泉。目前,国内外学者已从白血病及乳腺癌等多种实体肿瘤中分离鉴定了肿瘤干细胞[1-2]。胃癌干细胞的研究起步不久,研究者们已初步从胃癌细胞系或胃癌组织中分离出胃癌干细胞或干细胞样亚群[3-4]。色素框同源蛋白7(chromobox protein homolog 7,CBX7)是一种参与调控细胞增殖衰老的转录抑制因子,其与Bmi-1、EZH2等同属于PcG家族成员。已有研究报道CBX7在维持胚胎干细胞(embrynic stem cell,ESC)的自我更新及全能性、抑制ESC的分化中发挥重要作用[5],但CBX7在肿瘤干细胞中的表达及其对肿瘤干细胞特性的调节作用鲜见报道。本研究旨在探讨CBX7在胃癌干细胞样细胞中的表达及其对胃癌干细胞相关特性的调节作用。
1 材料和方法
1.1 材料
本实验所用人胃癌细胞系MKN28由上海消化外科研究所保种;胎牛血清FBS、RPMI-1640培养基、DMEM/F12培养基和低黏附性细胞培养板购于美国Hyclone公司,人表皮细胞生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、B27、脂质体LipofectamineTM2000购于美国Invitrogen公司;带有绿色荧光标记的CBX7干扰质粒pGCL-GFP-CBX7i及对照质粒由上海吉凯基因化学技术有限公司设计并构建;质粒抽提试剂盒购于北京天根生化科技有限公司;细胞蛋白裂解液、BCA蛋白浓度测定试剂盒购于美国Promega公司;一抗:Oct4、CBX7、β-actin抗体为英国Abcam公司产品,β-catenin为美国Santa Cruz公司产品;二抗:Rabbit IgG-HRP为美国KPL公司产品,Mouse IgG-HRP为美国Santa Cruz公司产品。ECL发光液购于中国江苏碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养
胃癌细胞系MKN28在含有10%胎牛血清的RPMI-1640培养基中,37 ℃、CO2体积分数为5%条件下培养,2~3 d传代1次。
1.2.2 无血清悬浮培养
本实验采用无血清悬浮培养法分离胃癌干细胞样亚群。选取MKN28胃癌细胞系对数生长期细胞,胰酶消化并吹打成单细胞悬液,用1×PBS洗涤2次,配制含EGF(20 ng/mL)、bFGF(10 ng/mL)、B27(1∶50)等生长因子的DMEM/F12无血清培养基,用DMEM/F12无血清培养基重悬洗涤后的MKN28细胞,计数后培养于低黏附性细胞培养板中,6孔板每孔中加入约5万个细胞,加入无血清培养液2 mL,每4天换液1次。
1.2.3 蛋白质印迹法(Western blot)检测
将无血清培养1周后形成的悬浮球收集到15 mL离心管中,静置15 min,弃上清液以去除死亡的细胞,1×PBS洗涤2次,按细胞蛋白裂解液说明书操作,提取悬浮球细胞蛋白。完全培养基培养的MKN28贴壁胃癌细胞,选取对数生长期细胞,1×PBS洗涤2次,按细胞蛋白裂解液说明书操作提取细胞蛋白。BCA法测定悬浮球细胞和贴壁细胞蛋白浓度。按每通道50 μg蛋白上样,5%浓缩胶80 V,10%分离胶120 V,电泳分离约150 min,经150 mA 120 min湿转至PVDF膜上。5%脱脂奶粉室温封闭90 min,分别加入一抗Oct4(1∶1 000)、β-catenin(1∶500)、CBX7(1∶1 000)、内参β-actin(1∶2 000),分别4 ℃温育过夜,TBST洗膜3次,每次5 min;HRP偶联的二抗(1∶3 000)室温温育2 h,TBST洗膜3次,每次5 min;后用ECL发光液显影,曝光。
1.2.4 CBX7i和Ctrli质粒转染MKN28胃癌细胞与筛选
将处于对数生长期的MKN28细胞铺到6孔板,每孔35万个细胞,第2天用脂质体LipofectamineTM2000转染,设置CBX7干扰质粒(CBX7i)和空载体对照质粒(Ctrli)转染组。基因转染步骤参照LipofectamineTM2000说明书进行,转染后6 h换液。24 h后在荧光显微镜下观察绿色荧光蛋白的表达,以判断转染效率;用400 μg/ mL浓度G418筛选3 d后提取蛋白,Western blot检测目的蛋白CBX7下调效果。
1.2.5 无血清悬浮培养成球实验
本实验中通过检测无血清培养成球率来判断细胞自我更新能力改变。将转染并筛选后的MKN28胃癌细胞按1 000个/孔接种到低黏附性96孔板中,进行无血清悬浮培养,CBX7i组和Ctrli组各设10复孔。培养1周后,计数每个孔悬浮球数目,计算两组平均悬浮球形成率。悬浮球形成率=悬浮球数/接种细胞数×100%。
1.2.6 平板克隆实验
将转染并筛选后的MKN28细胞按2 000个/孔接种到6 cm细胞培养皿中,CBX7i组和Ctrli组各设3复孔,每个培养皿加入完全培养基4 mL,5 d换液1次。培养2周后,吸除培养基,用1×PBS洗涤2次,4%多聚甲醛固定10 min,PBS洗涤2次,结晶紫染色15 min,双蒸水缓慢冲洗至克隆清晰可见,拍照进行克隆计数,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
1.3 统计学处理
采用SPSS 17.0软件进行统计分析。数据以x±s 表示,采用总体均数的假设检验(t检验)比较两组悬浮球形成率和克隆形成率的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 无血清培养形成干细胞样悬浮球
MKN28胃癌细胞在无血清、低黏附培养条件下,3 d后绝大部分细胞死亡,极少数细胞能形成悬浮球体,随培养时间延长,球体逐渐增大,其内部细胞排列致密,不能分辨细胞轮廓(图1)。
2.2 Oct4、β-catenin和CBX7表达情况
Western blot检测结果显示,悬浮球细胞较普通贴壁细胞高表达干细胞相关因子Oct4和β-catenin,同时明显高表达PcG家族蛋白CBX7(图2)。

图 1 MKN28细胞无血清培养形成干细胞样悬浮球Fig. 1 MKN28 cells can initiate stem-like floating spheres in serum-free culture

图 2 贴壁细胞和悬浮球中Oct4、β-catenin和CBX7表达的差异Fig. 2 Different expression level of Oct4, β-catenin and CBX7 in adherent cells and floating spheres
2.3 转染后转染效率观察及CBX7蛋白检测
对照Ctrli组和CBX7i质粒组转染24 h后,荧光倒置显微镜下观察两组细胞中绿色荧光,转染效率均在80%以上。Western blot检测CBX7表达,CBX7i组较Ctrli组CBX7表达明显降低(图3)。
2.4 CBX7干扰后细胞悬浮成球率
CBX7干扰后,转染CBX7i质粒组10复孔平均悬浮球形成率为(1.97±0.47)%,而转染对照Ctrli质粒组为(3.9±0.66)%,差异有统计学意义(P<0.01,图4)。
2.5 CBX7干扰后细胞克隆形成率
CBX7干扰后,转染CBX7i质粒组平均细胞克隆形成率为(3.92±0.35)%;而对照Ctrli组为(8.72±0.95)%,差异有统计学意义(P<0.01,图5)。
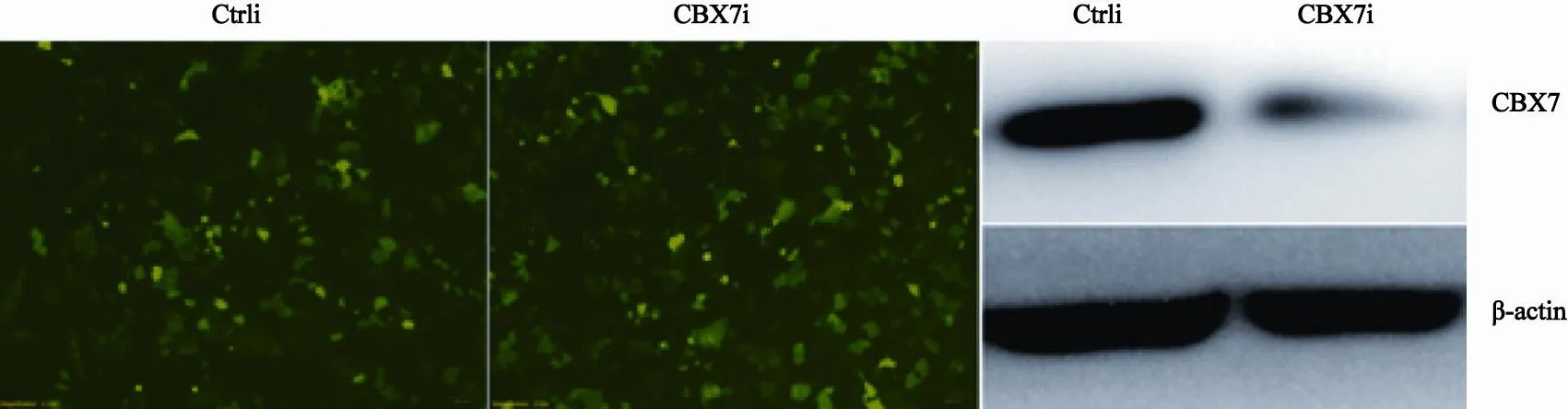
图 3 转染后荧光显微镜观察及CBX7蛋白检测Fig. 3 Observation of transfection efficiency under fluorescence microscope and detection of CBX7 expression level by Western blot

图 4 CBX7干扰后细胞悬浮成球率检测Fig. 4 Detection of sphere-forming efficiency after downregulation of CBX7

图 5 CBX7干扰后细胞克隆形成率检测Fig. 5 Detection of colony-forming efficiency after downregulation of CBX7
3 讨 论
肿瘤干细胞虽仅占肿瘤细胞的极少部分,但由于其具有不断的自我更新能力、对放化疗等治疗的抵抗和高转移等特性,而成为肿瘤治疗失败、日后复发转移的根源[6-8]。肿瘤干细胞研究已成为目前的研究热点与今后的重要发展方向之一。现在已有越来越多的证据显示肿瘤干细胞的存在[1-2,9-10],但干细胞特性的调控机制仍了解有限。如能阐明肿瘤干细胞的调控机制,可能带来肿瘤治疗疗效的突破。
干细胞的分离方法有无血清悬浮培养法、表面标记物免疫磁珠或流式细胞仪分选、侧群(SP)细胞分选等,其中无血清悬浮培养法同时具有分离干细胞与鉴定干细胞特性的双重作用,观察在无血清培养条件下形成悬浮球可以检测干细胞自我更新能力。虽然目前研究者们已初步分离了胃癌干细胞,但是胃癌干细胞的表面标志物尚存在争议。CD44、CD24、CD133等是胃癌干细胞可能的表面标志分子[11-13]。
PcG家族基因为外源性基因沉默因子,在维持干细胞特性、早期胚胎发育、调控细胞衰老与凋亡以及肿瘤的发生中发挥重要作用。PcG蛋白通常组成Polycomb 抑制型复合物(polycomb repressive complex,PRC)来发挥作用,如PRC1 和PRC2。已有研究报道,PcG家族成员Bmi-1、EZH2在调节干细胞和(或)肿瘤干细胞特性中发挥重要作用[14-16]。CBX7属于PcG家族成员,是一种参与调控细胞增殖衰老的转录抑制因子,为PRC1的成员之一[17]。研究表明,CBX7 mRNA在人的大脑、心脏、肾和骨骼肌中高表达,可参与维持多种正常细胞的生长,并能使小鼠成纤维细胞永生化[18]。在分子水平,CBX7可不依赖于Bmi-1抑制INK4a/ ARF基因座[18],与Bmi-1的部分功能、机制作用相似。最近研究发现,CBX7在维持ESC的自我更新与全能性、抑制ESC的分化中发挥重要作用[5]。我们以往的研究已证实,CBX7在调控胃癌细胞衰老、迁移等过程中发挥作用,其机制可能是通过抑制p16表达[19]。
如何将肿瘤干细胞分离出来进行培养,并保持其未分化状态,是进行肿瘤干细胞研究的前提。Singh等[20]利用添加生长因子的无血清培养基从胶质瘤、髓母细胞瘤中分离和培养出脑肿瘤干细胞,在肿瘤干细胞的分离培养方面取得了突破性进展。本研究通过无血清悬浮培养分离胃癌干细胞样亚群,Western blot检测发现悬浮球中干细胞相关因子Oct4和β-catenin高表达,进一步说明分离得到的是干细胞样亚群。更为重要的是,我们发现在干细胞样亚群中PcG蛋白CBX7明显高表达,提示CBX7在调节胃癌干细胞特性中可能发挥重要作用。在CBX7调节干细胞相关特性的研究中,首先采用基因转染的方法,下调胃癌细胞中CBX7表达水平,进而观察CBX7表达下调后无血清悬浮培养成球率的变化以及克隆形成率的变化。从实验结果可以看出,CBX7表达下调后无血清悬浮培养成球率明显降低,克隆形成率下降。
综上所述,CBX7在胃癌干细胞样细胞中呈明显高表达,其在调控胃癌干细胞自我更新和增殖中发挥重要作用,有望成为针对胃癌干细胞治疗胃癌的一个靶点。但是,CBX7调控胃癌干细胞特性的具体机制和作用靶点有待进一步研究。
[1] BONNET D, DICK J E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J]. Nat Med, 1997, 3(7): 730-737.
[2] AL-HAJJ M, WICHA M S, BENITO-HEMANDEZ A, et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100(7): 3983-3988.
[3] NISHII T, YASHIRO M, SHINTO O, et al. Cancer stem celllike SP cells have a high adhesion ability to the peritoneum in gastric carcinoma[J]. Cancer Sci, 2009, 100(8): 1397-1402.
[4] TAKAISHI S, OKUMURA T, WANG T C. Gastric cancer stem cells[J]. J Clin Oncol, 2008, 26(17): 2876-2882.
[5] O’LOGHLEN A, MUNOZ-CABELLO A M, GASPAR-MAIA A, et al. MicroRNA regulation of Cbx7 mediates a switch of polycomb orthologs during ESC differentiation[J]. Cell Stem Cell, 2012, 10(1): 33-46.
[6] YU F, YAO H, ZHU P, et al. let-7 regulates self renewal and tumorigenicity of breast cancer cells[J]. Cell, 2007, 131(6): 1109-1123.
[7] CHARAFE-JAUFFRET E, GINESTIER C, IOVINO F, et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer[J]. Clin Cancer Res, 2010, 16(1): 45-55.
[8] LAWSON J C, BLATCH G L, EDKINS A L. Cancer stem cells in breast cancer and metastasis[J]. Breast Cancer Res Treat, 2009, 118(2): 241-254.
[9] COLLINS A T, BERRY P A, HYDE C, et al. Prospective identification of tumorigenic prostate cancer stem cells[J]. Cancer Res, 2005, 65(23): 10946-10951.
[10] LI C W, HEIDT D G, DALERBA P, et al. Identification of pancreatic cancer stem cells[J]. Cancer Res, 2007, 67(3): 1030-1037.
[11] TAKAISHI S, OKUMURA T, TU S P, et al. Identification of gastric cancer stem cells using the cell surface marker CD44[J]. Stem Cells, 2009, 27(5): 1006-1020.
[12] 张朝军, 李晨蔚, 杨桦, 等. 肿瘤干细胞与胃癌[J]. 中国生物化学与分子生物学报, 2009, 25(10): 889-895.
[13] ISHIGAMI S, UENO S, ARIGAMI T, et al. Prognostic impact of CD133 expression in gastric carcinoma[J]. Anticancer Res, 2010, 30(6): 2453-2457.
[14] PARK I K, QIAN D L, KIEL M, et al. Bmi-1 is required for maintenance of adult self-renewing haematopoietic stem cells[J]. Nature, 2003, 423(6937): 302-305.
[15] LESSARD J, SAUVAGEAU G. Bmi-1 determines the proliferative capacity of normal and leukaemic stem cells[J]. Nature, 2003, 423(6937): 255-260.
[16] SUVA M L, RIGGI N, JANISZEWSKA M, et al. EZH2 is essential for glioblastoma cancer stem cell maintenance[J]. Cancer Res, 2009, 69(24): 9211-9218.
[17] GIL J, BERNARD D, PETERS G. Role of polycomb group proteins in stem cell self-renewal and cancer[J]. DNA Cell Biol, 2005, 24(2): 117-125.
[18] GIL J, BERNARD D, MARTINEZ D, et al. Polycomb CBX7 has a unifying role in cellular lifespan[J]. Nat Cell Biol, 2004, 6(1): 67-72.
[19] ZHANG XW, ZHANG L, QIN W, et al. Oncogenic role of the chromobox protein CBX7 in gastric cancer[J]. J Exp Clin Cancer Res, 2010, 29: 114.
[20] SINGH S K, CLARKE I D, TERASAKI M, et al. Identification of a cancer stem cell in human brain tumors[J]. Cancer Res, 2003, 63(18): 5821-5828.
《抗癌》杂志征稿启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会,杂志刊号:CN31-1664/R ISSN 1008-3065。征稿栏目及内容如下。
一、《抗癌博客》栏目
记录癌症患者自强不息、热爱生活、勇敢面对病痛和生活压力的故事,能够启发其他患者自信和勇敢的精神,帮助他们建立积极、知足、感恩和达观的生活态度。可以是你的亲身经历,也可以是医生治疗患者时的所见所闻,或是你身边发生的故事。
二、《正谊明道、大医精诚》栏目
真实记录医生对患者的关怀;或是爱岗敬业、精益求精富有专业精神的事迹,能让更多医道同仁敬重和学习。可以讲述患者眼里的医生,也可以记录你的同事。
以上稿件《抗癌》杂志编辑部在发表时有修改的权力,如果不同意修改请注明,谢谢!欢迎各位作者踊跃投稿。
来稿请寄:上海市东安路270号6号楼3楼《抗癌》杂志社
邮 编:200032 电 话:021-64043766
传 真:021-64043766 E-mail:anti-cancer@163.com
The expression and function of CBX7 in gastric cancer stem-like cells
ZHAO Li-qin1, GUO Wei-jian1, ZHANG Xiao-wei1, QU Xiao-fei2, WANG Xiao-feng1, NI Su-jie1, HUANG Ming-zhu1(1. Department of Medical Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China. 2. Center of Oncology, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei 430022, China)
Correspondence to: GUO Wei-jian E-mail: guoweijian1@sohu.com
[Abstract] Background and purpose:Chromobox protein homolog 7(CBX7) is a PcG family protein that regulates cell proliferation and senescence acting as a transcriptional repressor. It plays an important role in maintaining self-renewal and totipotency of embryonic stem cells. However, the expression and function of CBX7 in cancer stem cells haven’t been reported. This study aimed to investigate the expression of CBX7 in gastric cancer stem-like cells and its function in regulating gastric cancer stem cells’ properties. Methods:Gastric cancer stem-like cells were seperated from gastric cancer cell line MKN28 via serum-free culture. The expression of stem cell related factors(Oct4, β-catenin) and CBX7 were assayed by Western blot. CBX7 interfering plasmid (CBX7i) and its control plasmid (Ctrli) were respectively tranfected into MKN28 cells using LipofectamineTM2000. After transfection, a fluorescence microscope was used to observe transfection efficiency, and CBX7 expression level was determined by Western blot. The ability of selfrenewal was assayed by serum-free culture, and anchorage independent growth was analyzed using colony formation assay. Results:A very small number of MKN28 cells could initiate stem-like floating spheres. Cells in these spheres expressed higher level of Oct4, β-catenin and CBX7 than adherent cells. After the downregulation of CBX7 by gene transfection in MKN28 cells, both the sphere-forming efficiency and the capability of clonogenecity were decreased. Conclusion:CBX7 is highly expressed in gastric cancer stem-like cells. It plays important roles in regulating selfrenewal and proliferation of gastric cancer stem cells.
R735.2
:A
:1007-3639(2013)02-0114-06?
2012-09-13
2012-11-20)
国家自然科学基金(No:81041074)。
郭伟剑 E-mail:guoweijian1@sohu.com
DOI: 10.3969/j.issn.1007-3969.2013.02.006
