尿液中Zimp7早期诊断前列腺癌的潜在价值
2013-06-07曹达龙孙自捷万方宁姚旭东张世林戴波张海梁沈益君朱耀朱一平施国海马春光肖文军秦晓健林国文叶定伟
曹达龙孙自捷万方宁姚旭东张世林戴波张海梁沈益君朱耀朱一平施国海马春光肖文军秦晓健林国文叶定伟
1.复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032;
2.美国斯坦福大学医学院泌尿外科,美国 加利福尼亚州,94305-5328;
3.美国斯坦福大学医学院遗传学系,美国 加利福尼亚州,94305-5328
尿液中Zimp7早期诊断前列腺癌的潜在价值
曹达龙1孙自捷2,3万方宁1姚旭东1张世林1戴波1张海梁1沈益君1朱耀1朱一平1施国海1马春光1肖文军1秦晓健1林国文1叶定伟1
1.复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032;
2.美国斯坦福大学医学院泌尿外科,美国 加利福尼亚州,94305-5328;
3.美国斯坦福大学医学院遗传学系,美国 加利福尼亚州,94305-5328
背景与目的:雄激素受体(androgen receptor,AR)辅助因子失调将激活AR并直接促进前列腺癌的发生、发展。Zimp7(human zinc finger-containing,Miz1,PIAS-like protein on chromosome 7)是一新发现的AR辅助因子,本研究的前期工作证实,其在中国前列腺癌组织标本中高表达,预示着其可能是前列腺癌的一种特异性标志物。本研究旨在探讨尿液中Zimp7在前列腺癌早期诊断中的应用价值。方法:收集97例患者的尿液标本,其中42例前列腺癌患者,50例前列腺良性病变患者,5例膀胱癌患者。采用实时荧光定量PCR技术(real-time quantitative polymerase chain reaction,RT-PCR)检测Zimp7 mRNA的表达。结果:当前列腺特异抗原(prostate specific antigen,PSA)为4~10 ng/mL时Zimp7的受试者工作特征曲线下面积(AUC)为0.850(P=0.002),Zimp7阈值设定为53.00时其诊断前列腺癌的灵敏度、特异度、阳性预测值、阴性预测值分别为77.8%、84.6%、63.6%和91.7%;当不进行PSA分层时,Zimp7的AUC值为0.684(P=0.004);当阈值设定为17.26时,其灵敏度、特异度、阳性预测值、阴性预测值分别为66.7%、63.0%、60.5%和69.0%。另外,未发现Zimp7与年龄、PSA值和Gleason值之间有显著相关性。结论:检测尿液中Zimp7 mRNA是一种无创的、可行的前列腺癌早期诊断方法。
前列腺癌;早期诊断;Zimp7;尿液
雄激素受体(androgen receptor,AR)介导的雄激素信号通路已被证实是前列腺癌发生、发展中最重要的通路[1-4]。同时,一系列证据显示AR辅助因子能增强AR促进细胞增殖的能力[4],AR辅助因子失调将激活AR并直接促进前列腺癌的进展[5]。新发现的Zimp7(human zinc finger-containing,Miz1,PIAS-like protein on chromosome 7)已被证实不仅是AR辅助因子,而且能增强AR的转录活性[6],本研究的前期工作显示,Zimp7蛋白高表达于中国人前列腺癌组织标本中。据此,Zimp7的这些特性预示着其可能是前列腺癌的一种特异性标志物,并在前列腺癌的发生、发展中发挥作用。由于尿液不仅容易获得,而且前列腺多个肿瘤位点的脱落细胞和分泌物易于进入尿液,所以尿液中生物标志物的检测不仅具有非侵袭性的特点,而且不会忽视肿瘤的异质性[7-8]。本研究旨在探讨尿液中Zimp7是否为前列腺癌早期诊断的特异性标志物及其应用价值。
1 材料和方法
1.1 研究对象
自2011年10月—2012年10月收集92例拟行前列腺穿刺患者的前列腺按摩后的尿液标本,其中前列腺癌患者42例,前列腺良性疾病患者50例,平均年龄66.36岁(35~83岁);同时收集5例膀胱癌患者尿液标本。每例患者收集50 mL尿液,并立即置于冰上,1 h内转移至实验室并在4 ℃,700×g下离心10 min,PBS洗2次,取沉淀物,加入1 mL TRIzol试剂,保存于-80 ℃冰箱。
1.2 主要试剂
TRIzol试剂购自Invitrogen公司,RevertAidTM第一链cDNA合成试剂盒购自Fermentas公司,SYBR Green PCR试剂盒购自KAPA生物公司。目的基因和内参基因的引物由ABI公司Primer Express Software 2.0设计,目的基因Zimp7上游引物5’-ACCCTTGCTGAGTTCACCCC-3’和下游引物5’-GGTTTGAATGGTGCAGCTGG-3’以及内参基因β2微球蛋白(β2-M)上游引物5’-CTCACGTCATCCAGCAGAGA-3’和下游引物5’-ACGGCAGGCATACTCATCTT-3’由华大基因公司合成。
1.3 RNA提取及cDNA合成
根据TRIzol 试剂的说明书, 抽提每个标本中的总RNA,然后进行反转录合成cDNA。20 μL第一链cDNA合成反应体系包括5 μL总RNA (0.1~5.0 μg)、200 U反转录酶、20 U RNA酶抑制剂、4 μL 5×反应缓冲液、2 μL 10 mmol/L三磷酸脱氧核糖核苷(dNTP)混合液、1 μL 100 μmol/L随机引物、1 μL 100 μmol/L的Oligo(dT)18和5 μL DEPC处理水。反应条件:25 ℃使引物与总RNA模板退火5 min,42 ℃反应60 min以合成cDNA,70 ℃反应5 min使酶失活。
1.4 荧光定量RT-PCR检测Zimp7的表达水平
采用ABI公司的荧光定量PCR仪定量Zimp7 mRNA和β2-M mRNA表达水平。荧光定量RTPCR反应体系包括8.2 μL DEPC处理水、10 μL KAPA SYBR FAST qPCR Master Mix、0.2 μL上游引物、0.2 μL下游引物、0.4 μL ROX和1 μL cDNA模板。反应条件为:95 ℃预变性2 min;接着94 ℃变性10 s,61 ℃退火10 s,72 ℃延伸40 s,共40个循环。同时进行熔解曲线分析以及对PCR扩增产物进行电泳和测序以检测PCR反应的特异性。阴性对照以无RNA酶的水代替cDNA模板,每例样本及阴性对照均设3个平行复孔并取其平均值。反应结束后,取各个样本的Ct值并行2-⊿⊿Ct分析以量化各基因的表达水平。
1.5 统计学处理
2 结 果
2.1 PCR扩增产物的特异性
基因扩增后所进行的熔解曲线分析中Zimp7和β2-M均只有一个特异的熔解峰(图1),表明Zimp7和β2-M的扩增反应是特异的。另外,对扩增产物进行电泳和基因测序亦证实Zimp7和β2-M扩增产物与基因库中的相应序列相一致。
2.2 Zimp7 mRNA在尿液中表达水平
本研究共收集97例患者的尿液,42例前列腺癌患者中共有3例、50例前列腺良性疾病患者中共有4例最终因样本质量问题被剔除。当不根据前列腺特异抗原(prostate specific antigen,PSA)进行分层时,前列腺癌患者组尿液中Zimp7 mRNA表达量(125.43±30.67)显著高于前列腺良性疾病患者组(25.57±5.21,P=0.003)。另外,当PSA为4~10 ng/mL时,前列腺癌患者组尿液中Zimp7 mRNA表达量(223.69±63.19)亦明显高于前列腺良性疾病患者组(27.20±8.36,P=0.014)。同时发现,本研究中膀胱癌患者的PSA值均<10 ng/mL,其尿液标本中Zimp mRNA表达量为86.23±70.94,低于前列腺癌患者(图2)。

图 1 Zimp7和β2微球蛋白的扩增曲线和熔解曲线Fig. 1 The amplification plot and melt curve of Zimp7 andβ2-microglobulin
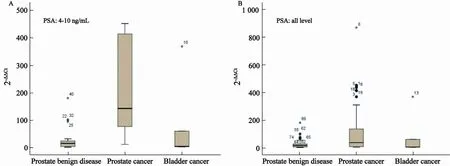
图 2 Zimp7在尿液中的表达水平Fig. 2 The expression pattern of Zimp7 in urine samples
2.3 尿液Zimp7 mRNA早期诊断前列腺癌的性能
通过ROC曲线分析发现,在只有前列腺疾病的研究群中,当PSA为4~10 ng/mL时,Zimp7的受试者工作特征曲线下面积(AUC)为0.850(P=0.002),Zimp7阈值设定为53.00时,其诊断前列腺癌的灵敏度、特异度、阳性预测值、阴性预测值分别为77.8%、84.6%、63.6%和91.7%(图3);当不根据PSA进行分层时Zimp7的AUC为0.684(P=0.004),在其阈值为17.26时,其灵敏度、特异度、阳性预测值、阴性预测值分别为66.7%、63.0%、60.5%和69.0%(图3)。
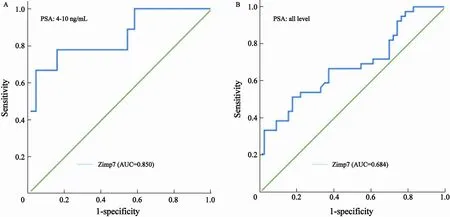
图 3 尿液中Zimp7早期诊断前列腺癌的性能Fig. 3 The capability of urine-detectable Zimp7 for early diagnosis of prostate cancer
2.4 尿液Zimp7 mRNA与临床指标的关系
相关分析结果显示,无论是在PSA为4~10 ng/mL的研究群中,还是在不根据PSA分层的整个研究群中,Zimp7与年龄、血清PSA和穿刺获得的Gleason分值之间均无显著相关性(P<0.05)。
3 讨 论
Zimp7隶属于PIAS样蛋白家族,序列分析显示Zimp7含有一高度保守的SPRING/Miz结构域、一个核定位序列和两个富含脯氨酸区[6,9-10]。基础研究的证据显示,Zimp7能与AR相互作用并增强AR的转录活性[6]。另外,对前列腺组织和数种人细胞系分析后发现,Zimp7蛋白与SUMO1和AR伴随存在以及Zimp7还在睾丸、前列腺和卵巢中呈高表达状态[6],这些提示Zimp7蛋白是AR的辅助因子并在性激素信号通路中具有调控功能。至今,Zimp家族蛋白在肿瘤中的潜在功能陆续被报道,例如在B细胞急性淋巴细胞白血病中Zimp10与ABL1之间存在(9;10) (q34;q22.3)转位[11],以及N末端缺失的Zimp10蛋白能够诱导小鼠鳞状细胞癌的发生[12]。除此之外,已经证实的是AR辅助因子可能激活AR并直接促进前列腺癌的进展[5],提示Zimp7作为Zimp家族成员和AR辅助因子可能在前列腺癌发生、发展中起作用,并可作为早期诊断前列腺癌的生物标志物。本研究结果显示,Zimp7早期诊断前列腺癌的AUC值高于以往文献报道中血清PSA的AUC值[13],预示着其可能是前列腺癌更佳的早期诊断标志物。
前列腺癌是全球男性中最常见的恶性肿瘤。在临床中,晚期转移性前列腺癌主要接受以雄激素阻断为主的治疗,其中约90%的这类病例起初对激素治疗敏感,但经18~24个月的雄激素阻断治疗后均将转变为激素抵抗型前列腺癌(castration resistant prostate cancer,CRPC);然而现有的针对CRPC的治疗手段(包括化疗、放疗、核素治疗)却不能明显提高这类患者的生存率,即CRPC患者的中位生存时间仍停留在12个月左右[14-15]。对于早期局限型前列腺癌患者而言,接受根治性手术联合内分泌治疗后其5年生存率接近100%[16]。可以看到,降低病死率的关键在于早期发现局限型前列腺癌并给予合适的治疗。本研究结果显示,在前列腺癌患者的尿液标本中Zimp7 mRNA转录水平明显上调,进一步提示Zimp7可能是前列腺癌潜在的早期诊断标志物以及是前列腺癌早期形成阶段的关键分子。
在评价Zimp7与临床病理资料之间关系时,本研究发现Zimp7与穿刺获得的Gleason评分之间无显著相关性。与前列腺癌根治术后标本中的Gleason评分相比,前列腺癌的异质性导致前列腺穿刺标本中Gleason评分的下降这一事实可能是导致穿刺获得的Gleason评分与生物标志物之间无显著相关性的重要原因之一。随访前列腺癌根治术标本中的Gleason评分资料才能最终确定Zimp7与Gleason评分之间的关系。另外,我们发现Zimp7表达水平与血清PSA之间亦无显著相关性,以及Zimp7与前列腺癌早期诊断、临床病理资料之间的联系在整个研究群体与PSA为4~10 ng/mL的研究群体之间没有显著的差异。这一结果表明Zimp7表达水平独立于血清PSA水平;同时,独立于血清PSA水平的生物标志物(如Zimp7)有助于克服在PSA灰区准确地早期诊断前列腺癌的瓶颈。
既往探索前列腺癌早期诊断策略的国内外研究显示,前列腺穿刺不仅是一种侵袭性的操作也容易遗漏穿刺点以外的肿瘤组织,以及所获得的肿瘤组织并不能完全反映其他位点肿瘤的特性和肿瘤的多克隆性,同时不合时宜的前列腺穿刺不仅使患者承担发生并发症的风险和增加患者的心理负担,也增加了医疗成本[17-19]。尿液不仅容易获得而且包含有前列腺多个肿瘤位点的脱落细胞和分泌物,所以尿液中生物标志物的检验不仅具有非侵袭性的特点,而且不会忽视肿瘤的异质性[7-8]。本研究不仅在尿液标本中成功检测到Zimp7 mRNA而且发现其在前列腺癌患者中的表达水平显著升高。据此,检测尿液中Zimp7表达水平有可能补充或者取代血清PSA在前列腺癌大规模筛查中的作用,同样也有可能减少不必要的活检人数和减少因活检所引起的不适、感染风险、焦虑以及与活检相关的费用。
总之,本研究结果提示,检测尿液中Zimp7 mRNA是一种无创的、可行的前列腺癌早期诊断方法。基于既往研究显示Zimp7是AR的辅助因子之一,并推测Zimp7失调可能通过异常激活AR而启动前列腺癌的发生、发展,因此本研究也为深入解析Zimp7在前列腺癌中的功能奠定了理论依据。
[1] BALK S P. Androgen receptor as a target in androgenindependent prostate cancer[J]. Urology, 2002, 60(3 Suppl 1): 132-139.
[2] CULIG Z, KLOCKER H, BARTSCH G, et al. Androgen receptors in prostate cancer[J]. J Urol, 2003, 170(4 Pt 1): 1363-1369.
[3] GELMANN E P. Molecular biology of the androgen receptor[J]. J Clin Oncol, 2002, 20(13): 3001-3015.
[4] HEINLEIN C A, CHANG C. Androgen receptor (AR) coregulators: an overview[J]. Endocr Rev, 2002, 23(2): 175-200.
[5] CHMELAR R, BUCHANAN G, NEED E F, et al. Androgen receptor coregulators and their involvement in the development and progression of prostate cancer[J]. Int J Cancer, 2007, 120(4): 719-733.
[6] HUANG C Y, BELIAKOFF J, LI X, et al. hZimp7, a novel PIAS-like protein, enhances androgen receptor-mediated transcription and interacts with SWI/SNF-like BAF complexes[J]. Mol Endocrinol, 2005, 19(12): 2915-2929.
[7] THOMAS C E, SEXTON W, BENSON K, et al. Urine collection and processing for protein biomarker discovery and quantification[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(4): 953-959.
[8] BETSOU F, BARNES R, BURKE T, et al. Human biospecimen research: experimental protocol and quality control tools[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(4): 1017-1025.
[9] SHARMA M, LI X, WANG Y, et al. hZimp10 is an androgen receptor co-activator and forms a complex with SUMO-1 at replication foci[J]. EMBO J, 2003, 22(22): 6101-6114.
[10] JACKSON P K. A new RING for SUMO: wrestlingtranscriptional responses into nuclear bodies with PIAS family E3 SUMO ligases[J]. Genes Dev, 2001, 15(23): 3053-3058.
[11] SOLER G, RADFORD-WEISS I, BEN-ABDELALI R, et al. Fusion of ZMIZ1 to ABL1 in a B-cell acute lymphoblastic leukaemia with a t(9;10)(q34;q22.3) translocation[J]. Leukemia, 2008, 22(6): 1278-1280.
[12] DUPUY A J, ROGERS L M, KIM J, et al. A modified sleeping beauty transposon system that can be used to model a wide variety of human cancers in mice[J]. Cancer Res, 2009, 69(20): 8150-8156.
[13] VAN GILS M P, HESSELS D, VAN HOOIJ O, et al. The timeresolved fluorescence-based pca3 test on urinary sediments after digital rectal examination; a Dutch multicenter validation of the diagnostic performance[J]. Clin Cancer Res, 2007, 13(3): 939-943.
[14] PETRYLAK D P, TANGEN C M, HUSSAIN M H, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer[J]. N Engl J Med, 2004, 351(15): 1513-1520.
[15] TANNOCK I F, DE WIT R, BERRY W R, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J]. N Engl J Med, 2004, 351(15): 1502-1512.
[16] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin, 2008, 58(2): 71-96.
[17] 曹达龙, 姚旭东. 分子标记物在前列腺癌早期诊断中的进展[J]. 癌症, 2010, 29(2): 245-249.
[18] JAMASPISHVILI T, KRAL M, KHOMERIKI I, et al. Urine markers in monitoring for prostate cancer[J]. Prostate Cancer Prostatic Dis, 2010, 13(1): 12-19.
[19] PLOUSSARD G, DE LA TAILLE A. Urine biomarkers in prostate cancer[J]. Nat Rev Urol, 2010, 7(2): 101-109.
《中国癌症杂志》举办继续教育函授班通知
经本刊编委会讨论决定,本刊从2012年下半年起举办2013年度继续医学教育函授班。具体方法如下:
一、2012年第7期起开设2013年度函授继续医学教育专栏,本年度的主要内容包括:乳腺癌、肺癌、肠癌的病理诊断、放射治疗及内外科治疗等。每期刊登1讲,共12讲,2013年第6期刊登考试试题,第7期刊登正确答案,要求学员认真阅读讲座后答题,并将答案寄至编辑部(复印无效),考卷经专人统一审阅,合格者授予Ⅱ类继续教育学分10分,学分证书由复旦大学附属肿瘤医院颁发。
二、参加对象:所有正在从事医学专业技术工作的卫生技术人员。预参加者请写好本人姓名、年龄、性别、职称、职务、学历、选派单位名称(地址及邮政编码)、所在科室、联系电话等寄往本编辑部(E-mail:zgaz@chinajournal.net.cn;zgazzz@163.com),同时通过邮局汇款(单位名称:《中国癌症杂志》编辑部;地址:上海市徐汇区东安路270号)的方式支付函授教育费,并请在汇款备注中注明“2013年度函授继续教育”。编辑部收到学员报名和函授教育费后编号登记注册,随即寄出注册费发票,并按时寄上每期刊物。即日起开始报名。
三、学员每人收费200元,赠送12期杂志。编辑部依据学员报名登记注册编号、交费记录和考试成绩于2013年8月30日以前寄发学分证书。
四、为保证函授教育质量,编委会邀请有关专家进行出题、阅卷工作,编辑部设专人负责。咨询电话:021-64188274;传真:021-64043766;邮编:200032;联系人:王露。欢迎广大医务人员踊跃参加。
The significance of urine-detectable Zimp7 for early diagnosis of prostate cancer
CAO Da-long1, SUN Zi-jie2,3, WAN Fang-ning1, YAO Xu-dong1, ZHANG Shi-lin1, DAI Bo1, ZHANG Hai-liang1, SHEN Yi-jun1, ZHU Yao1, ZHU Yi-ping1, SHI Guo-hai1, MA Chun-guang1, XIAO Wen-jun1, QIN Xiao-jian1, LIN Guowen1, YE Ding-wei1(1. Department of Urology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Urology, Stanford University School of Medicine, Stanford, CA 94305-5328, USA; 3. Department of Genetics, Stanford University School of Medicine, Stanford, CA 94305-5328, USA)
YE Ding-wei E-mail: dwyeli@yahoo.com.cn
Background and purpose:The dys-regulation of androgen receptor (AR) co-factor may activate AR and directly contribute to prostate cancer development and progression. The overexpression of Zimp7 (human zinc finger-containing, Miz1, PIAS-like protein on chromosome 7), which had been verified as a newly discovered AR cofactor, was then detected in Chinese prostate cancer tissue in our polit experiment, suggesting that it may be a specific biomarker for prostate cancer. The purpose of this study was to investigate the value of urine Zimp7 for early diagnosis of prostate cancer. Methods:Ninety seven urine samples from 42 patients with prostate cancer were collected, 50 patients with benign lesion of prostate, 5 patients with bladder cancer were collected. The expression pattern ofZimp7 mRNA in urine was determined using real-time quantitative polymerase chain reaction method. Results:In the subgroup patients, the prostate specific antigen (PSA) level was 4-10 ng/mL, the area under the curve (AUC) of Zimp7 was 0.850 (P=0.002); and when the threshold of Zimp7 set as 53.00, the sensitivity, specificity, positive and negative predictive value of detecting prostate cancer were 77.8%, 84.6%, 63.6% and 91.7%, respectively. In the cohort of all patients, the AUC of Zimp7 was 0.684 (P=0.004); and when the cutoff set as 17.26, the sensitivity, specificity, positive and negative predictive value were 66.7%, 63.0%, 60.5% and 69.0%, respectively. Additionally, non-significant correlation of Zimp7 with age, serum PSA, and biopsy Gleason score were found in both population. Conclusion:Detecting urine Zimp7 mRNA is one of non-invasive, feasible and potential methods for early diagnosis of prostate cancer.
Prostate Cancer; Early diagnosis; Zimp7; Urine
R737.25
:A
:1007-3639(2013)02-0087-06
2012-11-29
2013-01-10)
国家自然科学基金(No: 81272837);复旦大学985工程三期肿瘤研究项目(No: 985Ⅲ-YFX0102)。
叶定伟 E-mail:dwyeli@yahoo.com.cn
DOI: 10.3969/j.issn.1007-3969.2013.02.002
