川芎嗪对大鼠肠粘连组织MMP-9、TIMP-1和细胞因子表达的影响
2013-06-05戴春山徐王磊王雄华浙江省宁波市中医院外一科宁波315010
戴春山 徐王磊 王雄华 沈 刚 沈 潜 陈 彬 浙江省宁波市中医院外一科 宁波315010
川芎嗪对大鼠肠粘连组织MMP-9、TIMP-1和细胞因子表达的影响
戴春山 徐王磊 王雄华 沈 刚 沈 潜 陈 彬 浙江省宁波市中医院外一科 宁波315010
目的:观察川芎嗪对肠粘连模型大鼠粘连肠组织基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶抑制因子-1(TIMP-1)表达及血清白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)及转化生长因子(TGF-β)水平的影响,探讨川芎嗪预防肠粘连作用机制。方法:72只SD雄性大鼠随机分为正常对照组、假手术组、手术组及川芎嗪组,每组18只。正常对照组不行手术,假手术组仅行腹腔开关术,川芎嗪组术后每天腹腔注射川芎嗪溶液10mL(净含川芎嗪约0.1g),其余三组注射等量生理盐水。各组于术后第2、7、14天取血,肉眼观察肠粘连的程度分级;酶联免疫吸附法测定血清细胞因子IL-1、TNF-α、TGF-β。免疫组织化学染色加图像分析法观测MMP-9及TIMP-1表达。结果:手术组及川芎嗪组肠粘连程度显著增加(P<0.05),与手术组比较,川芎嗪组肠粘连程度明显减轻(P<0.05)。与手术组比较,川芎嗪组IL-1、TNF-α及TGF-β水平均明显降低(P<0.05或P<0.01)。术后2天,与手术组比较,川芎嗪组肠组织MMP-9表达显著降低(P<0.05),TIMP-1未见明显改变(P>0.05)。术后7天及14天,川芎嗪组肠组织TIMP-1表达较手术组有显著增高(P<0.05),MMP-9无明显改变(P>0.05)。结论:川芎嗪可能通过影响血细胞因子IL-1β、TNF-α和TGF-β1水平及肠组织MMP-9和TIMP-1表达,一定程度上抑制大鼠肠粘连。
大鼠 肠粘连 川芎嗪 MMP-9 TIMP-1 IL-1β TNF-α TGF-β1
川芎嗪是传统中药川芎的主要成分之一,具有行气活血,祛风止痛功效。动物实验或临床试验发现川芎嗪具有预防术后肠粘连的作用。腹腔粘连是腹部手术后常见的并发症和引起肠梗阻最常见的原因。近年研究发现,细胞外基质(extracellular matrix,ECM)的合成和降解与腹腔粘连形成有着密切关系,而降解ECM最重要的酶属MMPs[1-2]。研究显示,MMP-9与术后肠粘连有着密切关系,且可作为粘连形成的一种标志物[3-5]。本研究观察川芎嗪对肠粘连模型大鼠肠组织基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、基质金属蛋白酶抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)表达及血清白细胞介素-1(interleukin-1,IL-1)肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和转化生长因子-β(transforminggrowthfactor-β,TGF-β)水平的影响,探讨川芎嗪预防肠粘连的作用机制。
1 实验材料
1.1动 物 SD雄性大鼠,体质量200~250g,由浙江中医药大学动物实验中心提供。实验动物使用许可证号:X1002105。实验前饲养于室内适应环境1周,室温16~22℃,湿度50%~70%。
1.2药 物 注射用盐酸川芎嗪(性状:粉剂,规格:0.12g/支,由哈尔滨三联药业有限公司生产,国药准字H20030553)。
1.3主要试剂及 仪器 DENLEY DRAGON Wellscan MK3酶标仪(芬兰Thermo生产);IL-1、TNF-α及TGF-β试剂盒(上海西唐生物有限公司提供);MMP-9、TIMP-1单抗(杭州达文生物有限公司提供);离心机11-07(上海安亭科学仪器厂生产)。
2 实验方法
2.1模型制备 动物禁食12h禁水4h,以10%水合氯醛溶液0.3mL/100g腹腔注射麻醉后仰卧位固定,剪毛、消毒、铺无菌巾;取下腹部正中切口约2cm,找出回盲部,在距回盲部约5cm处取10cm长一段回肠,用锉刀反复轻轻擦拭回肠浆膜层(约0.5cm× 10cm)至表面有针尖状出血点,再滴1滴无水乙醇于创面上,无齿镊夹持盲肠系膜动脉2min,使局部缺血,回纳肠管后丝线关闭腹腔。
2.2分组及给药 72只大鼠随机分为正常对照组、假手术组、手术组和川芎嗪组,每组18只。川芎嗪组术后第一天起,腹腔注射1∶100川芎嗪溶液10mL(净含川芎嗪约0.1g),每天1次;其余三组给予等量的生理盐水10mL,腹腔注射。
2.3观察指标及方法
2.3.1肠粘连程度评估 四组分别于术后第2、7、14天,随机取出6只,10%水合氯醛溶液0.3mL/100g腹腔注射麻醉,腹部取U形切口开腹。观察肠粘连程度,并按Phillips分级标准评定等级[6]:0级:完全无粘连,回肠浆膜面修复良好;Ⅰ级:回肠与周围组织少量粘连,疏松易分,无渗血;Ⅱ级:回肠与周围组织轻到中度粘连,肠管可呈“U”形,分离时局部有渗血;Ⅲ级:肠管与周围组织广泛粘连,较难分离,无肠梗阻;Ⅳ级:肠管与周围组织紧密粘连成团,分离困难,引起肠梗阻。
2.3.2血清IL-1、TNF-α及TGF-β测定 暴露腹主动脉,5mL针筒穿刺采血置促凝管,室温静置,以4000r/min离心15min,分离血清,留取血清存于超低温冰箱保存待测,采用酶联免疫吸附法测定血清IL-1、TNF-α及TGF-β水平。
2.3.3粘连肠组织MMP-9及TIMP-1检测 摘取粘连肠壁组织0.5cm,若无粘连形成,在距回盲部5cm处取肠管0.5cm。所有标本经10%中性福尔马林溶液固定,石蜡包埋切片,HE染色,光镜观察创面修复情况。免疫组织化学染色加图像分析法观测MMP-9及TIMP-1表达量。
2.4统计学方法 计量资料以均数±标准差()表示,多组样本均数间比较采用单因素方差分析,等级资料用Ridit分析,应用SPSS 17.0软件包进行统汁分析。
3 实验结果
3.1各组大鼠肠粘连程度比较 正常对照组大鼠出现Ⅰ级肠粘连1只,假手术组3只;川芎嗪组大鼠Ⅰ级肠粘连9只,Ⅱ级肠粘连8只,Ⅲ级肠粘连1只;手术组大鼠出现Ⅰ级肠粘连6只,Ⅱ~Ⅳ级肠粘连各4只。与正常对照组、假手术组比较,手术组及川芎嗪组肠粘连程度更显著(P<0.05);与手术组比较,川芎嗪组肠粘连程度明显减轻(P<0.05)。见表1。

表1 各组大鼠肠粘连比较 只
3.2肠组织光镜下观察结果 正常对照组、假手术组大鼠回肠浆膜层间皮细胞连续,无明显炎症反应。手术组及川芎嗪组大鼠术后2天,浆膜层部分创面被一层细胞所覆盖,且该细胞层由一层边缘清晰的纤维蛋白支架支持,此层细胞增生,呈条索状或小片状,有的呈立方形或高柱状;创面表面还可见纤维蛋白渗出形成一条红染的边缘清晰的黏附带,伴大量炎性细胞浸润,见图2(封二)。术后1周手术组可见浆膜受损面未修复,间质细胞不连续,粘连组织内各类细胞明显增多,巨噬细胞增多,成纤维细胞增生活跃,大量胶原纤维致密排列,毛细血管增生明显。川芎嗪组浆膜剥离面多已修复,间皮细胞较连续排列,胶原纤维排列疏松,并可见少量成纤维细胞,毛细血管增生不明显。术后2周与术后1周相比,手术组炎症反应减轻,肉芽组织渐成熟,炎性细胞、其间巨噬细胞数量较少,毛细血管和成纤维细胞数量减少,胶原纤维细胞数量增加,排列更加致密,毛细血管增生数量减少。川芎嗪组的病理改变与术前1周时相似,创面修复均较造模组为佳,毛细血管、成纤维细胞和胶原纤维数量较造模组减少。
3.3各组血清IL-1β、TGF-β1及TNF-α水平比较
手术组IL-1β、TGF-β1及TNF-α水平明显高于正常对照组和假手术组(P均<0.01);与手术组比较,川芎嗪组IL-1β、TGF-β1及TNF-α水平均显著降低(P<0.01),见表2。
表2 各组IL-1β、TGF-β1及TNF-α水平比较() pg/mL
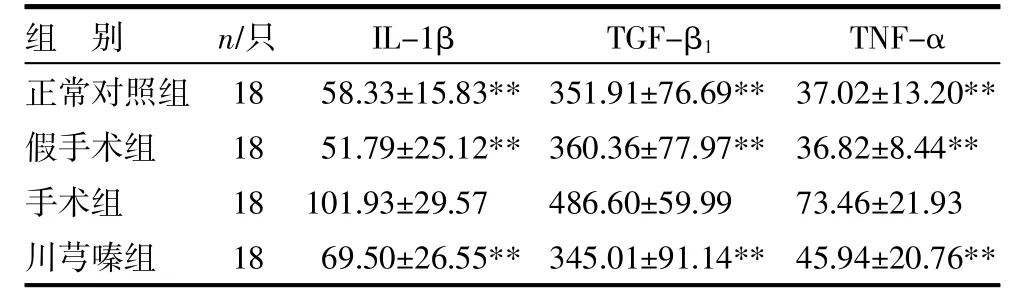
表2 各组IL-1β、TGF-β1及TNF-α水平比较() pg/mL
注:与手术组比较,**P<0.01
?
手术组IL-1β于术后第7天升至峰值,以后逐渐下降;川芎嗪组IL-1β值在术后持续升高,术后14天升至峰值。两组第2、7、14日3个时间点比较,差异均有统计学意义(P<0.05或P<0.01)。手术组TGF-β1在术后第2天升至最高,以后逐渐下降;川芎嗪组TGF-β1在术后第7天升至最高,以后逐渐下降。两组2、7、14日3个时间点比较,差异均有统计学意义(P<0.05)。手术组TNF-α在术后第7天升至最高,以后逐渐下降;川芎嗪组TNF-α在术后第2天升至最高,以后逐渐下降,至术后14天又恢复至术后2天的水平。两组2、7、14日3个时间点比较,差异均有统计学意义(P<0.05或P<0.01),见表3。
表3 手术组与川芎嗪组IL-1β、TGF-β1及TNF-α水平比较() pg/mL

表3 手术组与川芎嗪组IL-1β、TGF-β1及TNF-α水平比较() pg/mL
注:与手术组比较,*P<0.05,**P<0.01
组别手术组n/只川芎嗪组66术后2天术后7天术后14天术后2天术后7天术后14天IL-1β 96.30±21.30 97.58±18.03 86.91±53.13 49.85±11.03** 58.43±20.06* 73.56±30.55** TGF-β1506.92±69.65 495.06±58.47 457.81±48.90 333.51±110.29* 359.20±68.37* 342.30±78.73* TNF-α 71.68±26.12 81.98±24.40 66.74±14.57 43.11±19.17* 41.31±13.78** 43.41±24.47**
3.4各组大鼠肠粘连组织TIMP-1表达 手术组及川芎嗪组大鼠肠粘连组织TIMP-1表达均在术后7天升至峰值,以后下降。术后2天,各组之间差异无统计学意义(P>0.05);术后7天,各组与手术组比较,差异均有统计学意义(P<0.05);术后14天,正常对照组、假手术组与手术组术比较,差异无统计学意义(P>0.05),而川芎嗪组与手术组比较,差异有统计学意义(P<0.05),见表4,图3(封二)。
3.5各组大鼠肠粘连组织MMP-9表达 手术组及川芎嗪组大鼠肠粘连组织MMP-9表达均在术后2天升至峰值,而后下降。术后2天,各组与手术组比较,差异有统计学意义(P<0.05);术后7天,正常对照组、假手术组与手术组比较,差异有统计学意义(P<0.05),而川芎嗪组与手术组比较,差异无统计学意义(P>0.05)。术后14天,各组与手术组比较,差异均无统计学意义(P>0.05),见表5,图4(封二)。
表4 各组大鼠肠粘连组织TIMP-1表达() μg/L
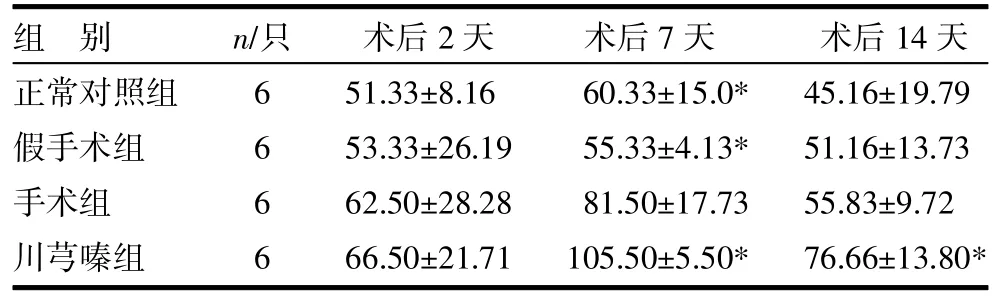
表4 各组大鼠肠粘连组织TIMP-1表达() μg/L
注:与手术组比较,*P<0.05
组别正常对照组假手术组手术组川芎嗪组n/只6666术后2天51.33±8.16 53.33±26.19 62.50±28.28 66.50±21.71术后7天60.33±15.0* 55.33±4.13* 81.50±17.73 105.50±5.50*术后14天45.16±19.79 51.16±13.73 55.83±9.72 76.66±13.80*
表5 各组大鼠肠粘连组织MMP-9表达() μg/L

表5 各组大鼠肠粘连组织MMP-9表达() μg/L
注:与手术组比较,*P<0.05
组别正常对照组假手术组手术组川芎嗪组n/只6666术后2天22.83±17.57* 24.83±17.57* 119.00±40.50 70.66±13.01*术后7天43.16±13.39* 30.16±28.78* 78.66±26.66 58.00±11.52术后14天37.83±9.38 50.00±17.34 49.66±29.95 50.66±23.54
4 讨论
肠粘连是腹部壁层与脏层以及脏层腹膜之间的异常粘连,是相伴集体组织愈合的必然过程。炎性细胞的聚集、间皮细胞的活化、纤维素的渗出和细胞外基质的转化与重塑均在粘连形成过程中起着重要作用[7]。IL-1主要有单核细胞产生的多肽,也可有内皮细胞、巨噬细胞和T淋巴细胞等分泌,是机体主治对损伤和炎症作出急性反应的关键介质,是形成粘连的必需过程。TGF-β在损伤、炎症及纤维化之间起桥梁作用[8],它通过自分泌和旁分泌基质激活成纤维细胞产生胶原,阻断纤维蛋白溶解酶原激活(t-PA),增加血管形成和趋化成纤维细胞、单核细胞及巨噬细胞,启动一个连锁反应,破坏纤维蛋白溶解与合成之间的平衡,导致细胞外基质(ECM)的沉积而有助于粘连形成。TNF-α属于介导炎症的细胞因子,在炎症早期有一定的介导作用,同时也是炎症反应中激活细胞因子级联反应的主要递质,是产生纤维素性粘连的基础。研究发现,术后早期血清中较高水平的IL-1、TNF-α及TGF-β与术后腹腔粘连形成有显著相关性,并认为术后早期IL-1、TNF-α及TGF-β升高可作为人类术后腹膜粘连的可靠指标[9-10]。本研究发现,手术组肠粘连大鼠血清IL-1、TNF-α及TGF-β值分别于术后第7、7、2天达到峰值,与假手术组及正常对照组相比差异明显(P<0.01),这与上述观点相似。川芎嗪组与手术组相比较,IL-1、TNF-α及TGF-β值均有明显下降(P<0.05或P<0.01)。这提示川芎嗪注射液可能通过降低肠粘连大鼠血清IL-1、 TNF-α及TGF-β等细胞因子水平,降低细胞因子在肠粘连过程起到的作用,从而减轻肠粘连程度。
细胞外基质是广泛存在于细胞之间的一个动态网状结构[11],其构成了细胞生活的微环境,参与细胞的增殖、分化、肿瘤演进和创伤修复等过程,并且其本身也处于不断产生与降解的动态平衡中[12]。研究发现,能降解ECM的酶类主要包括丝氨酸蛋白酶类、半胱氨酸蛋白酶类、天冬氨酸蛋白酶类及基质金属蛋白酶类(MMPs)[13]。而在上述四类酶中,降解ECM最重要的当属MMPs 2。MMPs是一组与锌结合的、分解胞外基质的蛋白酶,参与胚胎正常发育及组织重塑,并在许多病理过程中发挥重要作用,如创伤修复、炎症反应等。TIMPs是组织局部MMPs活性最重要的调节因素。在正常情况下,TIMPs可以通过其氨基酸末端决定簇与MMPs按1∶1比例结合,从而阻断后者的降解活性。因此,MMPs-TIMPs平衡是ECM内环境和完整性的决定因素。
MMP-9是基质金属蛋白酶类(MMPs)家族成员之一,它是一种糖蛋白,可由中性粒细胞、单核细胞、血管内皮细胞、平滑肌细胞、星形胶质细胞、小胶质细胞等多种细胞分泌。生理条件下,MMP-9功能受到严格的控制,当其以酶原的形式从胞内分泌到胞外后,经一系列酶解过程而激活[14]。在体内MMP-9蛋白水解活性受非特异性和特异性抑制剂的抑制,前者包括TGF-B、A1抗蛋白酶、A2巨球蛋白;特异性抑制物是金属蛋白酶组织抑制因子-1(TIMP-1)。TIMP-1是一种M为58 000的糖蛋白,可与MMP-9结合形成1:1化合物,从而发挥抑制作用,改变细胞外基质(ECM)的生长和合成。因此,细胞外基质的生成和降解和基底膜成分的完整性是由MMP-9和TIMP-1在正常状态下保持动态平衡来调节的。当MMP-9和TIMP-1的平衡失调时,就会产生一系列的病理变化,发生疾病。
在本研究手术组中,术后2天时,粘连组织中MMP-9与TIMP-1含量均高于正常组织,提示MMP-9和TIMP-1对腹膜粘连的形成确有一定影响作用,这与文献报道一致[5,15]。术后2天,MMP-9含量增加,提示在粘连发生早期,TIMP-1含量随MMP-9的增加而增加,抑制MMP-9活性,使胶原降解受到抑制,然而,TIMP-1增加不明显,在此期间主要表现为MMP-9活性效应,同时形成粘连的基础。术后7天和14天,MMP-9含量逐渐降低,说明MMP-9主要在粘连形成的早期发挥作用,在后期即粘连形成以后其作用趋于静止。术后7天TIMP-1含量较术后2天明显增加,抑制MMP-9表达使之趋于稳定,控制炎性细胞的迁移,ECM降解减少,减少粘连形成。术后14天TIMP-1在粘连组织中的含量较术后7天降低,提示随着MMP-9的逐渐降低不再需要过多的TIMP-1抑制MMP-9活性,故TIMP-1也降低,形成局部稳定的粘连。而在本研究川芎嗪组中,术后2天,与手术组比较,肠组织中MMP-9的表达有显著降低,而TIMP-1未见明显改变。术后7天及14天,肠组织中TMP-1的表达较手术组有显著增高,而MMP-9较手术组无明显改变。
综合上述,笔者认为,在肠粘连早中期,川芎嗪主要通过抑制MMP-9和促进TIMP-1的表达,以及抑制TGF-β细胞因子水平升高,从而达到抑制肠粘连的作用。在肠粘连晚期,手术组大鼠肠组织中的细胞因子、MMP-9及TIMP-1均出现明显下降,TIMP-1对MMP-9的完全抑制占主导。因此,MMP-9对ECM的溶解能力显著下降,大鼠肠组织逐渐进入一个自我修复和重建的稳定粘连过程。所以,在这个时期川芎嗪抑制肠粘连的作用较弱。
[1]Bittinger F,Schepp C,Brochhausen C,et al.Remodeling of Peritoneal-like Structures by Mesothelial Cells:Its Role in Peritoneal Healing[J].J Surg Res,1999,82(1):28-33.
[2]Ohtake Y,Tojo H,Seiki M.Multifunctional roles of TIMP in my ofiberformation and morphostatic maintenance of skeletal muscle[J].J Cell Sci,2006,119(18):3822-3832.
[3]Kuzuya M,Lguchi A.Role of matrix metalloproteinases in vascular remodeling[J].J Atheroscler Thromb,2003,10:275-282.
[4]柯豫,陆继红,杨宾烈,等.基质金属蛋白酶-9、2及其抑制物在胎盘粘连发生中的作用[J].中华妇产科杂志,2006,41(5):311-314.
[5]韩娜,娄艳辉,郭新华.基质金属蛋白酶-9及组织抑制剂-1在大鼠肠粘连形成过程中的作用[J].实用医学杂志,2008,24(5):720-723.
[6]侯春林,汤朝晖.脱乙酰壳多糖和透明质酸钠预防大鼠肠粘连的实验研究[J].第二军医大学学报,2001,23(7):731-733.
[7]Van der Wal JB,Jeekel J.Biology of the peritoneum in normal homeostasis and after surgical trauma[J].Colorectal Dis,2007,9(Suppl2):9-13.
[8]翁永强,涂彦渊,肖立,等.转化生长因子-β多克隆抗体预防腹腔粘连的实验研究[J].中国普通外科杂志,2001,11(12):741-745.
[9]Saba AA,Godziachvili V,Mavani AK,et al.Serum levels of interleukin 1 and tumor necrosis factory alpha correlate with peritoneal adhesion grades in hunmans after major abdominal surgery[J].Am Surg.1998,64(8):734-736.
[10]Kaidi AA,Gurchunelidze T,Nazzal M,et al.Tumor necrosis factor-alpha:a marker for peritoneal formation[J].J Surg Res,1995,58(5):516-568.
[11]Bert hier C,Marti HP.Metzincins,including mat rix metalloproteinases and meprin,in kidney transplantation[J]. Swiss Med Wkly,2006,136(49250):92-94.
[12]赵云阁,欧尔比特·安尼瓦尔,祝诚.细胞外基质与基质金属蛋白酶[J].生物化学与生物物理进展,1999,26(3):223-228.
[13]Duarte AS,Pereira AO,Cabrita AM,et al.The characterisation of t he collagenolytic activity of cardosin a demonst ratesit s potential application for ext racellular mat rix degradative processes[J].Curr Drug Discover Technolog,2005,2(1):37-44.
[14]高颖,蔡定芳.基质金属蛋白酶-9与炎症反应的研究进展[J].中国病理生理杂志,2003,19(8):1133-1136.
[15]尚晓滨,吴咸中,李东华,等.活血化瘀中药对清解通下中药增效作用的实验研究V—对粘连组织中MMP-1和TIMP-1影响的实验研究[J].中国中西医结合外科杂志,2006,12(4):385-388.
Effects of Ligustrazine on Expressions of Matrix Metalloproteinase-9,Tissue Inhibitor of Metalloproteinase-1 and Cytokines in Rats with Intestinal Adhesion Tissues
DAI Chunshan,XU Wanglei,WANG Xionghua,et al.The Ningbo Traditional Chinese Medicine Hospital.Ningbo(315010),China
Objective:To determine the expressions of matrix metalloproteinase-9(MMP-9)and tissue inhibitor of metalloproteinase-1(TIMP-1)in the tissues of intestinal adhesion and cytokine interleukin 1(IL-1),tumor necrosis factor alpha(TNF-α)and transformation growth factor(TGF-β)in blood sera of rats,in order to explain the mechanism of ligustrazine on intestinal adhesion.Methods:Seventy-two SD male rats were randomly assigned to 4 groups:normal group,sham operation group,operation group,and drug group,18 rats in each group.Traumatic model of intestinal adhesion model was established in the operation and drug group.In the sham operation group,the anesthesia and laparotomy were the same as the operation group,but no intestinal tissue was injured and no mesenteric artery was clamped.In the drug group,rats were intraperitonealiy injected with 10 mL of ligustrazine solution(about 0.1 g ligustrazine),while in the rest groups equivalent physiological saline was injected.In the four groups,6 rats were respectively sacrificed on day 2,7,and 14 after modeling,and tissues of serous membrane in adhesive area were taken.Under macroscopic observation,intestinal adhesion were classified.Elisa method was used for determination of cell factor IL-1,TNF-α,and TGF-β.The expressions of MMP-9 and TIMP-1 in the intestinal adhesive tissues and the normal intestinal tissues were determined by immunohistochemistry assay and image analysis.Results:(1)Compared with the sham operation and normal groups,the intestinal adhesion degree in the operation and drug group significantly increased(P<0.05);and compared with the operation group,the drug group had lower degree of interstinal adhesion(P<0.05).(2)Compared with the operation group,the levels of IL-1,TNF-αandTGF-β in the drug group significantly decreased,with statistically significant difference(P<0.05 or P<0.01).(3)Compared with the operation group,the MMP-9 expression reduced on day 2 after modeling,but the TIMP-1 expression did not increase to a significantly different level until day 7(all P<0.01).On day 7 and 14,the drug group had the expressions of TIMP-1 increased(P<0.05),but did not have a significant increase in MMP-9.Conclusions:Ligustrazine can inhibit intestinal adhesion in rats by reducing IL-1,TNF-α,and TGF-β and regulating MMP-9 and TIMP-1 in the intestinal tissues.
rats intestinal adhesion ligustrazine matrix metalloproteinase-9(MMP-9)tissue inhibitor of metalloproteinase-1(TIMP-1) IL-1 TNF-α TGF-β
2013-03-25
浙江省宁波市医学科技计划项目(No.2010A12)
徐王磊,Tel:13958204357;E-mail:wnfk2002@163.com
