纳米金免疫层析法定量检测尿RBP
2013-06-01沈鹤柏朱龙章
徐 宽,沈鹤柏,朱龙章
(上海师范大学生命与环境科学学院,上海 200234)
纳米金免疫层析法定量检测尿RBP
徐 宽,沈鹤柏,朱龙章*
(上海师范大学生命与环境科学学院,上海 200234)
应用纳米金免疫层析技术(双抗夹心法)和柠檬酸三钠还原法建立一种对尿RBP的快速定量检测方法,并在此基础上研制出快速检测试纸条.该试纸条用纳米金免疫层析定量分析仪可在15 min内实现RBP定量检测,检测限为150μg/L(相当于150 ng/mL),检测范围为150~5000μg/L.与尿微量白蛋白(ALB)、转铁蛋白(TRF)、β2-微球蛋白(β2-MG)、尿纤维连接蛋白(FN)、溶菌酶(LZM)等肾脏疾病标志物无交叉反应.该方法特异性强、检测灵敏度高、范围广、简便快捷,在近端肾小管的损伤、糖尿病肾病等肾脏疾病的早期诊断及过程监控中具有较为广泛的临床应用.
尿RBP;纳米金;免疫层析;定量检测
0 前 言
视黄醇结合蛋白(Retinol Binding Protein,RBP)是体内一类将VitA从肝脏中转运至靶组织以及实现VitA细胞内转运代谢的特异性运载蛋白,在协助VitA发挥生理功能中起着不可替代的作用[1].研究发现RBP广泛存在于正常人的体液中,属于α1-球蛋白[2].RBP主要以视黄醇和前白蛋白结合的复合物形式存在,当复合物中视黄醇与靶细胞结合后,复合物中的视黄醇结合蛋白便与前白蛋白分离而从肾小球滤出,并由近端肾小管上皮细胞吸收、降解[3].近年来的深入研究表明,RBP含量的改变能够敏感地反映近端肾小管的损伤,实现糖尿病、肾病的早期诊断[4].
彭彦孟等[5]在采用ELISA法对241例肾脏疾病患者的尿RBP进行检测以探讨尿RBP在早期肾小管损伤的诊断价值.实验发现,肾损伤患者的尿RBP较正常对照组明显增高;同时,尿RBP在酸性环境中稳定性好且不易被破坏,是反映肾小管受损的敏感指标.王瑞石等[6]在对4种经肾穿刺活检诊断的肾病患者进行尿RBP的变化与肾小管间质形态学改变之间的关系,以及肾功能对其影响的研究中指出,尿RBP与肾小管间质的形态学改变有良好的相关性,其水平高低直接反应肾小管间质的病变程度.因此,尿RBP是反映近端肾小管功能的特异性标志物,可能对鉴别诊断各种肾脏疾病小管间质病理受损及受损程度具有重要临床意义.
纳米金免疫层析技术(GICA)[7-8]是20世纪90年代以来发展起来的一种将纳米生物技术、色谱层析技术和免疫层析技术相结合的固相膜免疫层析方法,并在此基础上发展成的一种新型体外诊断技术[9].虽然近年来该方法发展迅速,在生物医学领域特别是医学检验中得到了广泛应用,但采用该方法实现对RBP的定量检测仍未见报道.
目前临床上对RBP的定量检测已经成为肾功能检测的一种有效且成熟的方法,而ELISA法和免疫比浊法是各大医院目前普遍采用的方法.但这两种方法耗时长、操作步骤比较繁琐、对操作人员的专业技术要求较高、所需仪器也较为昂贵等,这给基层医院对RBP定量检测的普及造成了不小困难.而本研究采用纳米金免疫层析技术,正好在弥补传统方法的缺陷与不足的同时,还能实现对尿RBP的定量检测,对近端肾小管的损伤、糖尿病肾病等肾脏类疾病的大规模筛查、早期诊断及过程监控都具有重要影响.
1 材 料
1.1 主要仪器
H01-1B数显恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);Thermo MμLtiskan Spectrμm多功能酶标仪(Thermo Scientific);扫描电子显微镜SEM(JEM- 2010,JEOL,Japan);AllegraTM64R台式高速冷冻离心机(美国贝克曼库尔特有限公司);涡旋仪(上海医科大学设备厂);激光Nano Zetasizer电位及粒径测定仪(Malvern公司);HM3010单维往复式划膜仪,ZQ-2000微电脑自动斩切机(上海金标生物科技有限公司);DH-252BS除湿机(杭州川井电器有限公司);BN-Q2000型纳米金免疫层析定量分析仪(上海柏纳生物技术有限公司);真空干燥箱(上海精密仪器仪表有限公司);纯水仪(上海力康公司).
1.2 主要试剂
鼠抗RBP单克隆抗体(S-64-11)、(S-113-7)(上海中科英沐生物科技有限公司);RBP标准品(北京西美杰生物有限公司);二抗(上海捷宁生物科技有限公司);小牛血清白蛋白(Sigma公司);氯金酸(上海精细化工研究所);无水碳酸钾(国药集团化学试剂有限公司);柠檬酸三钠(上海青析化工有限公司);氯化钠(上海文旻生化科技有限公司);蔗糖(AMRESCO公司);双蒸水(自来水由纯水仪制得);硝酸纤维素膜(NC膜)(美国Millipore公司);玻璃纤维膜8964(Ahlstorm公司);PVC塑料底板、吸水纸(上海金标生物科技有限公司).
2 试纸条的制备
2.1 纳米金的制备
采用柠檬酸三钠还原法[10-11]制备20 nm纳米金.向经酸洗净并干燥过的锥形瓶中加入99 mL双蒸水,再加入1%氯金酸溶液1 mL.将锥形瓶置于数显恒温磁力搅拌器上加热至沸腾,沸腾后在剧烈的搅拌下一次性迅速准确地加入新鲜配制的1%柠檬酸三钠溶液2 mL,当溶液完全变为透明的酒红色时,继续煮沸15 min,即制得所需的纳米金,常温下继续搅拌冷却至室温,4℃储存待用.
2.2 纳米金标记抗体条件选择及标记
2.2.1 最适pH值的确定
分别取1 mL纳米金溶液用0.1 mol/L碳酸钾溶液调节pH值至6.0、7.0、8.0、9.0、10.0.各取不同pH的纳米金溶液200μL至5支EP管中,再加入4μg鼠抗RBP单克隆抗体(S-113-7),混合均匀,室温反应10 min后,向其中加入40μL 10%氯化钠溶液,静置2 h,观察各管颜色变化.
2.2.2 最适蛋白量的确定
向8支EP管中分别加入200μL纳米金溶液,用0.1 mol/L碳酸钾溶液调至最适pH值.再分别加入0、0.5、1.0、2.0、3.0、4.0、5.0、6.0μg鼠抗RBP单克隆抗体(S-113-7),反应20 min后,各管加入10%氯化钠溶液40μL,静置2 h,观察各管颜色变化.
2.2.3 纳米金的标记
取纳米金溶液1mL,用0.1mol/L碳酸钾溶液调至最适pH值,加入适量的鼠抗RBP单克隆抗体(S -113-7),混合均匀,反应20 min后,加入10%BSA溶液20μL,混合均匀,反应20 min.在13000 r/min、4℃条件下离心15 min,弃去上清液.沉淀物用硼酸盐缓冲溶液(含5%BSA)重悬至原体积.再次以同样的条件离心后弃去上清液,浓缩至原体积的1/ 20,即得纳米金-RBP复合物,4℃保存.
2.3 硝酸纤维素膜的制备
将NC膜贴在具有粘性的PVC底板中间,用单维往复划膜仪在NC膜的不同位置喷点鼠抗RBP单克隆抗体(S-64-11)及羊抗鼠二抗,自上至下依次为质控线(C线)、检测线(T线),37℃烘干2 h备用.
2.4 结合垫的制备
选用玻璃纤维素膜作为结合垫材料,将上述制备的纳米金-RBP复合物用硼酸缓冲溶液(含0.1 gPVP,0.1 gPEG,2.5 g蔗糖等)稀释至原体积的4/ 5,并喷于结合垫上,37℃烘干2 h备用.
2.5 样品垫的制备
选用玻璃纤维素膜作为样品垫材料,将其放入样品垫处理液(含BSA,吐温等的0.01 mol/L pH=7.4 PBS)中浸泡后,37℃真空干燥2 h备用.
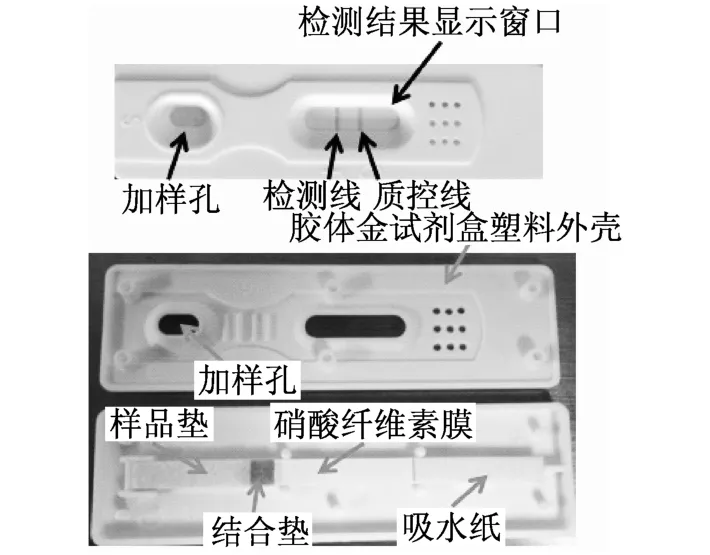
图1 试纸条的组装效果图
2.6 试纸条的组装
将结合垫、样品垫、吸水纸依次按由下到上的顺序粘贴在PVC底板上.用ZQ微电脑自动斩切机切割成4 mm宽的试纸条.将切好的试纸条装在检测卡(如图1)里面与干燥剂封装在铝箔袋内37℃保存待用.
2.7 试纸条的结果判定(如图2)
当样品滴加至加样孔反应15 min后,若C线、T线均为红色且T线呈深红,则判定为强阳性;若C线、T线均为红色且T线呈浅红,则判定为弱阳性;若只有C先呈红色,则判定为阴性;若C线无色,则判定为试纸条无效.
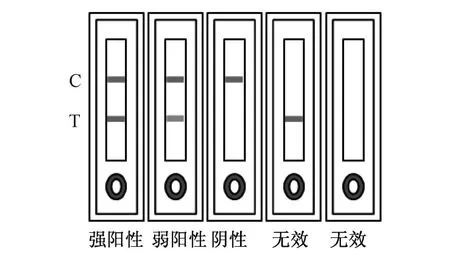
图2 纳米金免疫层析法检测判定图
3 结果与分析
3.1 纳米金的表征
3.1.1 纳米金的紫外-可见吸收光谱
用全波长酶标仪在400~600 nm波段内对制备的纳米金进行扫描.从图3中可以看出,20 nm的纳米金在520 nm处有一最大吸收值,这与文献报道的相一致[12],表明此粒径的纳米金适合标记抗体.

图3 纳米金紫外—可见吸收曲线
3.1.2 纳米金的粒径及Zeta电位分析
新制备的纳米金平均Zeta电位是-41.9mV(图4),表明此电位的纳米金可较好地同RBP结合.纳米金颗粒的平均直径大约为20.57 nm,其中分布完全是24.06 nm,分布宽度为9.260 nm,多分散性PDI=0.148(图5),表明制备的纳米金符合免疫试验的要求.
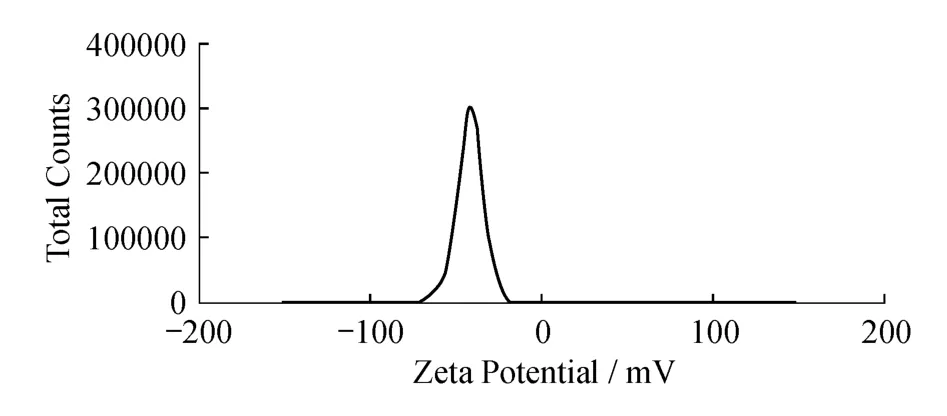
图4 纳米金的Zeta电位扫描曲线
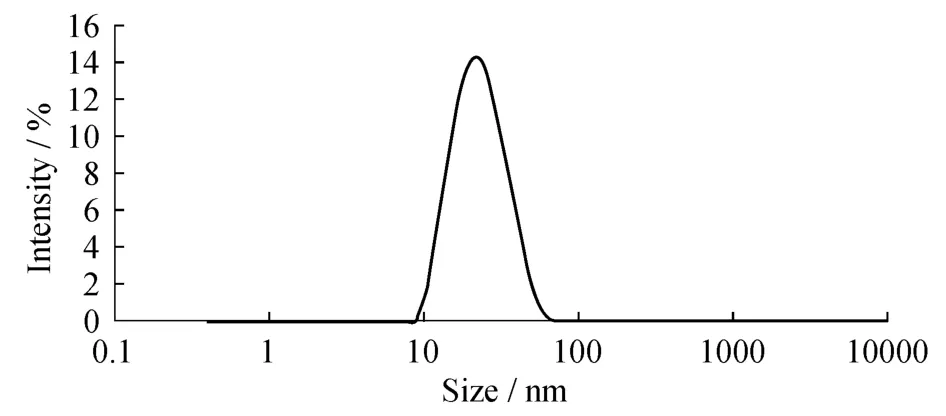
图5 纳米金的粒径分布曲线

图6 纳米金的电镜TEM图
3.1.3 纳米金颗粒的透射电镜观察
新制备的纳米金用透射显微镜(TEM)进行扫描(图6),从图6中可以看出纳米金颗粒粒径在20 nm左右,形貌接近于球形,而且粒径分布比较均一.此纳米金颗粒粒径分析结果与Zetasizer电位分析仪测定结果相一致,可以满足纳米金标记抗体实验的要求.
3.2 纳米金标记条件的确定
3.2.1 最适pH值的确定
RBP单抗在pH为6~10中颜色发生着不同的变化,其中随着pH逐渐增大,颜色的变化程度逐渐减弱.当pH<8.0时,管中溶液颜色呈不同程度的灰蓝色;当pH≥8.0时,管中溶液颜色基本无变化.因此,可以确定纳米金标记的最佳pH值为9.0.
3.2.2 最适RBP抗体量的确定
当200μL纳米金溶液中RBP抗体量小于4μg时,溶液不同程度地发生聚沉,颜色变成灰色、紫色;而RBP抗体量大于3μg时,溶液颜色为酒红色不变,所以200μL体系中最适抗体量为4μg,即20 mg/L(相当于20μg/mL),实际工作中增加20%,故实际用量为24 mg/L(图7).图7中RBP抗体量分别为:0、0.5、1.0、2.0、3.0、4.0、5.0、6.0 g/200 L.

图7 不同抗体量的RBP和纳米金结合显色图
3.3 试纸条的灵敏度分析
检测一系列不同浓度的RBP标准品溶液,溶液浓度依次为:0、10、30、60、100、150、200、300、500、1000μg/L.在15 min内观察各试纸条的显色情况,当浓度为1000μg/L时,T线为深红色,C线稍浅.随着浓度逐渐降低,T线颜色逐渐变浅,C线逐渐变深.当浓度为150μg/L时,T线颜色几乎消失,C线颜色最深,由此判断,试纸条的灵敏度可达150μg/L.
3.4 试纸条的重复性试验
取 300, 1500,5000μg/L 3种浓度的RBP标准品溶液,按照相同的检测方法对每个浓度平行检测6次,并用纳米金免疫层析定量分析仪扫描读取T/C值.每个浓度6次检测的T/C值的标准差与平均值的比值即为变异系数(即为CV值),计算得到3种浓度RBP标准品溶液的CV值分别为9.83%、9.45%、8.89%,该CV值相近,说明所得的试纸条具有良好的重复性.
3.5 试纸条的特异性实验
将尿微量白蛋白(ALB)、转铁蛋白(TRF)、β2-微球蛋白(β2-MG)、尿纤维连接蛋白(FN)、溶菌酶(LZM)用PBS稀释到60、100、200、300、500μg/L等不同浓度的标准品溶液进行检测,发现只有C线变红,T线没有变化(表1),说明该试纸条的特异性良好.

表1 试纸条特异性实验
3.6 试纸条的检测范围的确定
用0.01 mol/L pH=7.4 PBS缓冲液将RBP标准品配制成终浓度分别为150、300、500、1000、2000、3000、4000、5000、6000、7000μg/L的RBP溶液,用试纸条检测T/C值,每个浓度测定3次,取其平均值.测定结果表明,从6000μg/L开始,T/C值出现下滑(图8).因此,确定RBP试纸条的检测下限为150μg/L,上限为5000μg/L.

图8 RBP标准品溶液浓度为150~5000μg/L时的试纸条检测结果图
3.7 RBP定量测定及标准工作曲线的绘制
在最优化的实验条件下,以浓度为横坐标,T/C值为纵坐标作图,建立纳米金定量检测RBP标准工作曲线.样品浓度为150~5000μg/L时,每个浓度检测3次,对纳米金免疫层析定量分析仪扫描得到的T/C值取平均值(表2).RBP浓度与T/C值之间呈良好的对数关系(图9),对数回归方程为Y=0.7072 ln(x)-3. 4867,相关系数R2=0. 9981,对数关系良好.
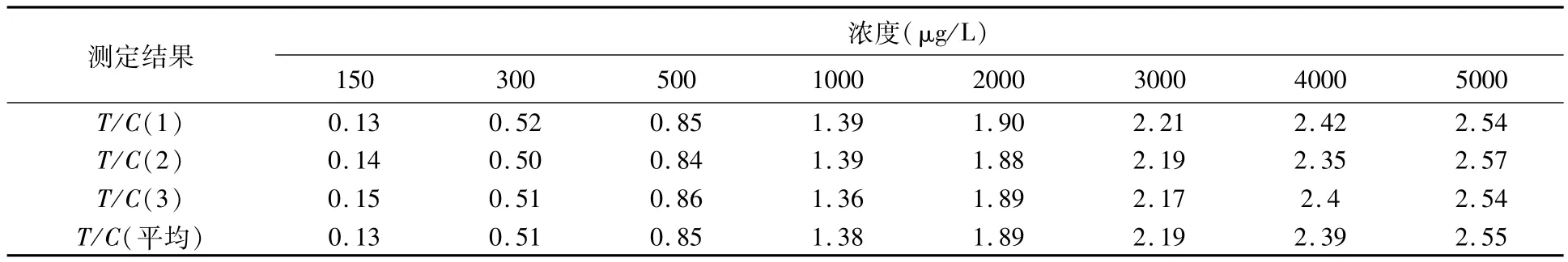
表2 RBP定量检测结果(37℃)
3.8 试纸条的稳定性
通过实验可以得出,RBP纳米金免疫层析定量检测试纸条在4℃和室温下保存4个月,37℃下保存20 d,试纸条对RBP的检测结果没有发生显著变化.RBP浓度与免疫金标层析仪读数T/C值之间仍然呈良好的对数关系(表3、图10),对数回归方程为Y=0.685 ln(x)-3. 4337,相关系数R2=0. 9966,对数关系良好.
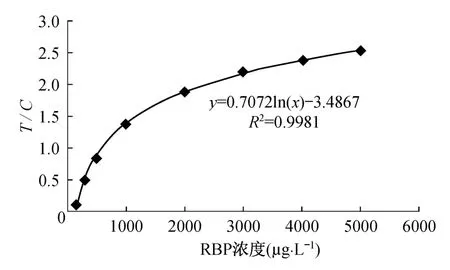
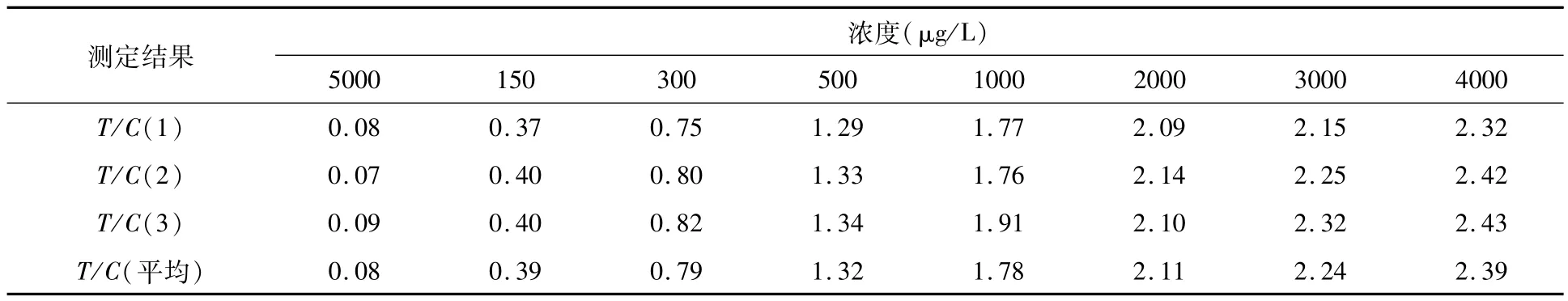
表3 37℃保存20 d后RBP定量检测结果

图10 20d后纳米金免疫层析试纸条检测RBP标准品系统拟合工作曲线
该研究结果表明,所得的试纸条在4℃、室温和37℃下稳定性好.依据阿伦尼乌斯公式:K=A e(-Ea/RT),其中K为速率常数、R为摩尔气体常量、T为热力学温度、Ea为表观活化能(约等于19.5 Kcal/mol)、A为指前因子.可以推算,37℃条件下放置20 d相当于正常条件下有效期为2年.
4 结 论
(1)利用纳米金免疫层析技术实现了对RBP的快速定量检测.采用双抗夹心法,以1对RBP单抗分别用作免疫金抗体检测线处抗体,以羊抗鼠作质控线.通过利用仪器读取纳米金的颜色强弱的信号以实现定量检测.此法克服了传统方法的诸多不足,为临床对RBP的肾小管损伤大规模筛查、诊断以及术后监测提供了一种全新的有效定量检测方法.
(2)利用Frens法制备的20 nm的纳米金形貌均一、分散性好,符合免疫层析反应的各项要求.通过对样品垫处理液、硼酸缓冲溶液、抗体浓度等不断优化,较好地规避了可能出现的假阳性、假阴性,并在此基础之上建立了具有较宽的检测范围和较低的检测限的快速定量检测体系.
(3)建立的快速定量检测RBP体系与尿微量白蛋白(ALB)、转铁蛋白(TRF)、β2-微球蛋白(β2-MG)、尿纤维连接蛋白(FN)、溶菌酶(LZM)没有交叉反应,重复性以及稳定性良好.在4℃和室温下可以保存4个月,具有广泛的医学、研究实用价值.
(4)通过研制的试纸条对RBP标准品的定量检测结果分析,表明该试纸条的最低检测限可达150μg/L.同时在150~5000μg/L范围内具有良好的对数关系,相关系数R为0.99.此法在快速(15 min显示结果)检测的基础上实现了有效的定量,将深刻改变目前临床对RBP的检测方式.
[1] 郭晓红,储明星,周忠孝.视黄醇结合蛋白及其基因分子生物学[J].遗传, 2004,26(2):257-262.
[2] BERGGARD I.Studies on the plasma protein in normal human urine[J].Clinical Chimica Acta, 1961,6(1):413-415.
[3] BLANERW S.Retinol-binding protein:the serum transport protein for vitamin A[J].Endocr Rev, 1989,10(3):308 -316.
[4] 杨俊钧.肾脏疾病检测视黄醇结合蛋白的临床意义[J].职业与健康, 2010,26(21):2526-2528.
[5] 彭彦孟,彭家和.视黄醇结合蛋白的研究进展[J].国际检验医学杂志, 2007,8(8):736-737.
[6] 王瑞石,刘志红,尹茹,等.肾小管损伤标记物检测的临床意义及其影响因素[J].肾脏病与透析肾移植杂志, 2005,14(2):110-116.
[7] KASAHARA Y,ASHIHARA Y.Simple devices and their possible application in clinical laboratory down sizing[J].Clinical Chimica Acta, 1997,67(1):87-102.
[8] PEAK SH,LEE CW,YOOK SH,et al.Performance control strategies of one-step immunochromatographic assay system for salmonella typhimurium[J].Analytical Letters, 1999,32(2):335-360.
[9] 李永勤,杨瑞馥.以膜为固相载体的免疫纳米金快速实验[J].微生物学免疫学进展, 2003,3(1):74-78.
[10] 杨玉新,叶阳,周有祥,等.四种化学还原法制备胶体金的比较研究[J].湖北农业科学, 2011,50(3):476-482.
[11] 李卫玲,叶阳,周有祥,等.柠檬酸三钠法制备胶体金的工艺条件优化[J].湖北农业科学, 2010,49(10):2529 -2532.
[12] 赫丽娜,刘帅,孙瑾.纳米金溶胶的制备与应用研究[J].科技信息, 2009,13(2):30-31.
Gold nanoparticle immunochromatographic assay for quantitative detection of urinary RBP
XU Kuan,SHEN Hebai,ZHU Longzhang*
(College of Life and Environment Sciences,Shanghai Normal University,Shanghai 200234,China)
A rapid quantitative detection of urinary RBP was established by using nano-gold immunochromatography(sandwich method)and trisodium citrate reductionmethod and a rapid immunochromatographic test strip was developed.Theimmunochromatographic test strip can quantitatively detect RBPwithin 15minutes.The detection limitwas150ng/mL and detection rangewas from 150 to 5000 ng/mL.There were no cross-reactions with others kidney diseasemarkers,such as urinary albumin(ALB),transferrin protein(TRF),β2-microglobulin(β2-MG),urinary fiber connecting protein(FN),and lysozyme(LZM).The results indicate that it is a quick and simplemethod with strong specificity,high sensitivity,and wide detection range.The rapid detection method will have extensive clinical applications in the early diagnosis of proximal tubular damage,kidney disease,diabetic nephropathy,and processmonitoring.
Urinary RBP;nano-gold;immunochromatographic assay;quantitative detection
O 648
A
1000-5137(2013)02-0154-07
(责任编辑:郁 慧)
2012-12-21
上海市教委基金(11nm0505300)
徐 宽(1986-),男,上海师范大学生命与环境科学学院硕士研究生;朱龙章(1956-),男,上海师范大学生命与环境科学学院教授.
*通信作者
猜你喜欢
杂志排行
上海师范大学学报·自然科学版的其它文章
- 基于流动空间理论的城市空间极化研究——以上海市为例
- Im proved quantification accuracy for dup lex real-time PCR detection of genetically modified soybean and maize in heat processed foods
- Bitranslations of com p letely sim p le sem igroups and some applications
- 民族传统体育学硕士学位论文计量学分析
- 不同部位灵芝及子实体提取物中总三萜酸含量测定
- 水稻Os05g0442400基因启动子分析以及由Os05g0442400基因启动子引导GUS报告基因在转基因水稻中的表达
