轮叶黑藻(Hydrilla verticillata)对沉积物-水界面微观剖面理化参数的影响*
2013-05-28田翠翠王纯波肖邦定
田翠翠,王纯波,李 倩,肖邦定
(1:中国科学院水生生物研究所,武汉 430072)
(2:中国科学院大学,北京 100049)
湖泊沉积物是重要的内源污染源,是氮、磷等营养元素的载体,可以为各种微生物提供生境,积极参与营养元素的循环以及湖泊的进化演替过程[1].湖泊沉积物对其所处生态系统有重要影响,是水体中营养物质最大的源和库[2],一定程度上影响着水质的好坏,因而研究沉积物的环境特征具有重要的实际意义.湖泊修复的过程中,在外源污染得以减少或控制的情况下,内源负荷将延长湖泊生态系统的恢复进程,因而更值得关注[3].湖泊内源负荷通过沉积物-水界面进入水体并发挥作用,已有研究表明沉积物间隙水中污染物分布特征与湖泊内源负荷有直接关系[4].沉积物-水界面营养盐的循环受物理、化学、生物等因素的调节.因此研究沉积物-水界面的环境特征,有助于对湖泊内源污染的控制.一般而言,表层沉积物为各种物质循环和能量转换的活跃区域.常规的采样分析容易破坏这种微界面,不利于研究.因此需要一种精度更高的原位分析方法——微电极技术.微电极技术是一种原位研究微环境的新技术,具有测量数据精度高、空间精度高、不破坏被测点的微环境等优点,为人们对微区环境结构进行探索提供了一种强有力的手段.
湖泊富营养化的治理,内源营养物质的去除是不可忽略的.采用物理方法如底泥疏浚等,虽然可行,但是需要花费很大的人力、物力、财力,而且淤泥的处理也是一个问题.利用大型水生植物竞争性地吸收内源营养,具有优先占领有利于高等水生植物优势的生态位[5],且易于实施等特点.在众多治理富营养化水体的措施中,利用水生植物特别是沉水植物可以得到良好的净化效果,有利于重建和恢复良好的水生生态系统[6].
水生植物是水生态系统的重要组成部分和主要的初级生产者之一,对生态系统物质循环和能量传递起调控作用[7].水生植物可以通过物理、化学和生物过程[8]吸收水体营养物质,改善沉积物的理化性质,对重建和修复湖泊生态体系的平衡具有积极的作用.其中,轮叶黑藻(Hydrilla verticillata,以下简称黑藻)是水鳖科(Hydrocharitaceae)的一种多年生沉水植物,具有很强的营养繁殖能力,普遍生长在我国各处水域中.由于具有生存范围广、适应性强[9]、繁殖力强(主要通过断枝扦插等方法繁殖)等特点,常在富营养化水体沉水植被恢复工程中作为先锋物种[10].本文利用轮叶黑藻进行室内模拟研究,分析轮叶黑藻对香溪河、太湖和东湖3 种不同富营养化程度底泥的理化性质和垂直分布的影响及它们之间的相互关系,并进一步探讨轮叶黑藻对水生态系统的净化效果及其重要意义.
1 材料与方法
1.1 实验材料
沉积物:本研究主要选取了3 种不同污染程度的水体底泥(香溪河、太湖和东湖),其理化参数见表1.用柱状采泥器或抓斗式采泥器采集0 ~10 cm 表层新鲜沉积物,置于便携式冰箱快速带回实验室进行分析,新鲜泥样直接过80 目筛(避免穿刺剖面时泥样中大颗粒物损坏电极),过筛后混匀,备用.
黑藻:采自云南滇池,带回实验室用自来水冲洗数次后,在实验室内培养.实验时选取健壮的新生芽体(3 cm 左右),放在蒸馏水中备用.

表1 实验开始时沉积物的理化特征Tab.1 Physical and chemical properties of sediments at the beginning of the experiment
1.2 实验设计
将沉积物泥水混合物充分混合均匀后,等量分装到36 个100 ml 的烧杯(每种沉积物12 个)中,待其自然沉降后,沉积物厚度和水深度分别为2 和3 cm.然后用黑色塑料袋包裹整个烧杯的杯体,以保证光线只能从上端射入.将黑藻芽尖扦插于沉积物中,每组设8 个平行.空白组不加黑藻,其他同实验组.待准备完成后于光照培养箱(GP-01 型)中培养,条件设置为:周期为60 d 左右,温度为25℃,光暗比为12 h∶12 h,光照时光级为4(光照度为60 ~70 μmol/(m2·s)),暗处理时光级为0(光照度为0).每天用蒸馏水补足蒸发减少的水分.定期取样分析.
1.3 分析测定
黑藻的生长状况通过测量鲜重、芽数、根长和根数来衡量.叶绿素采用汪志国等[11]报道的双波长分光光度法,具体用80%丙酮提取后按下列公式计算:

沉积物TN 采用半微量开氏法测定,TP 采用灰化法[12]测定,有机质采用高温灼烧法测定.水质常规指标(TN、TP、NO3--N、NH4+-N 等)测定参照《水和废水监测分析方法》(第四版)[13].沉积物孔隙率通常采用烘干测含水率的方法测定,孔隙率(Φ)计算公式为(V 表示体积):

沉积物的耗氧速率(sediment oxygen demand,SOD)采用微呼吸氧电极(Unisense)测定,实验参照并改进许倩颖等[14]测量SOD 的方法.具体做法为取一定质量的沉积物于4 ml 微呼吸瓶中,加入充氧至饱和的超纯水,小心地塞上带有毛细孔的塞子,然后将微电极插入毛细孔内,实验时装置内不能有气泡.开动磁力搅拌器,待稳定后开始记录,每3 s 记录一次溶解氧值,记录1 h 后溶解氧值,计算可得单位质量的沉积物在1 h 内的耗氧速率.
黑藻的光合呼吸作用采用微呼吸氧电极测定,参照Colmer 等[15]的方法.实验用培养基含有(mmol/L):Ca2+(0.62)、Cl-(1.24)、Mg2+(0.28)、(0.28)、Na+(0.50)、HCO3-(0.50),然后往培养基中充10 min的N2,以防止测量过程中出现O2过饱和现象[15],将该培养基分别加入到3 个4 ml 微呼吸瓶中.实验组(2个)分别加入一定质量的新鲜黑藻叶片,一个遮光,另一个不遮光,空白组不加叶片,其他同实验组.将微呼吸瓶放于温度为30℃、光照度为13 μmol/(m2·s)的光照培养箱中培养.用微呼吸氧电极连续监测瓶内DO,根据DO 的变化可计算出单位质量的黑藻在单位时间内O2的变化速率,即光合速率.
沉积物-水界面的微观剖面利用穿刺型微电极进行测量.实验中主要涉及 O2、pH、氧化还原电位(ORP)、H2S、N2O 在沉积物-水界面几毫米至几厘米内的变化.具体做法是:首先将微电极(DO、pH、ORP、H2S、N2O 等)连接在四通道主机上进行极化和校正.在穿刺样品时将微电极安装在一个马达控制器上,通过调节相应的参数(O2、H2S、N2O 响应时间为3 s,pH、ORP 为 11 s;步距均为500 μm)来研究沉积物-水界面剖面微尺度上的变化.待实验开始后,每10 d 用微电极进行穿刺,分析沉积物-水界面的垂直剖面变化趋势.
1.4 数据处理
数据处理利用SPSS 13.0 数据处理软件处理.不同组对沉积物和水体的影响利用方差分析分析组间差异,方差具有齐次性时采用LSD 检验,方差不具有齐次性时采用Tamhane's T2 检验,差异显著性水平均为P <0.05.图表采用Origin 8.0 作图分析.
2 结果与讨论
2.1 黑藻生长状况及对水质和底泥的影响
2.1.1 黑藻生长状况 由培养30 d 和60 d 后黑藻的生长状况可以看出,不同沉积物对黑藻的生长存在差异(表2),说明沉积物的理化性质对沉水植物的兴衰具有重要影响.黑藻分枝数也明显增多,且东湖组明显高于香溪河和太湖组,说明黑藻有较强的耐污(营养状况)能力.至实验中期(30 d 左右),香溪河、太湖、东湖沉积物中黑藻生物量的增长倍数依次为2.95、2.16、5.20,生物量均显著增加(P <0.05).但由于生长空间和光照等条件的限制,实验后期生物量增长速率反而不如实验初期,因而在实际应用中,适时收割是保证植物持续旺盛生长的必要措施[16].黑藻根生长迅速、根长和根数显著增加,并不断从沉积物中吸取营养物质等.从叶绿素含量来看,黑藻茎尖叶绿素含量因沉积物不同而有所不同,且随着培养时间的增加而增加(图1).实验初期叶绿素含量较低,主要是由于实验初期黑藻长势不好.
2.1.2 黑藻对水质和底泥的影响 黑藻可通过叶片等吸收水体里的营养物质,对水质有一定的影响,具体表现为使水体N、P 含量降低(图2).对照组TN、TP 也有所降低,说明除植物的吸收作用外,可能还存在沉降作用[16].

表2 黑藻生长状况*Tab.2 The growth situation of H.verticillata

图1 黑藻茎尖1 cm 左右叶绿素含量Fig.1 Contents of chlorophyll in tip 1 cm of H.verticillata
黑藻对底泥的影响主要表现在对沉积物理化性质的影响.沉水植物的生长需要从沉积物中吸取N、P 等营养元素.黑藻对沉积物中N、P 有一定的影响(图3),具体表现在:除太湖沉积物外,黑藻可以一定程度上降低沉积物中的N 含量;不同沉积物中P 含量也有所降低,但是由于实验条件的限制,去除能力有限,差异并不显著.
2.2 黑藻对沉积物-水界面垂直剖面的影响
沉积物-水界面是水体和沉积物两相组成的边界环境,其密度、微粒和溶液组成、化学种类的活动性、pH、ORP 和生物活动性等方面均存在明显的梯度变化[17].
2.2.1 沉积物-水界面DO 的垂直分布 黑藻生长使水体DO 增加,沉积物-水界面有氧层厚度增加(图4).水体中DO 的升高反映了黑藻光合作用的程度,实验测得单位质量鲜重的黑藻的光合作用速率为0.732 mg/(g·h),且在一定范围内,照度越强,光合速率越快[18].黑藻对沉积物-水界面DO 垂直剖面的影响过程主要表现以下两个方面:

图2 上覆水体中TN 和TP 的变化Fig.2 Changes of TN and TP contents in overlying water

图3 沉积物中TN 和TP 的变化Fig.3 Changes of TN and TP contents in sediments
①维管束泌氧.实验初期,通过扦插的方式将黑藻茎尖植入沉积物,因而对沉积物的影响主要是通过维管束泌氧来实现的.黑藻通过光合作用产生氧气,一方面满足自身呼吸作用的需要,维持植株的正常生长;一方面通过维管束可以到达沉积物,并影响沉积物-水界面氧的微观变化.
②根系泌氧.由于根和茎等通气组织的存在,使其能够运输所需的氧到根部.这些氧除了满足根部的有氧呼吸之外,其中的一部分在运输过程中会通过根轴径向释放到根际土壤中,称之为根系泌氧[19].
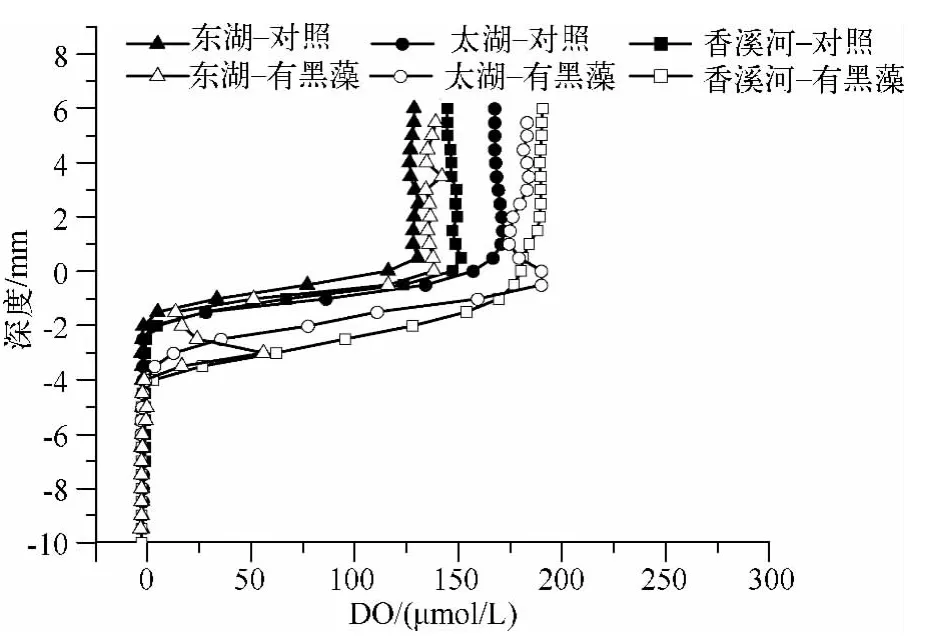
图4 培养40 d 后不同处理组沉积物中DO 的垂直变化Fig.4 Vertical characteristics of DO in sediments after cultivation of 40 d
维管束泌氧和根系泌氧对沉积物-水界面有十分重要的意义,一方面使还原态介质中形成氧化态的微环境,使有氧层厚度增加,可能改变微生物的种类和结构,并为好氧微生物提供适宜的小生境;另一方面使还原性物质得到氧化,改变沉积物的氧化还原电位,促进湿地植物在根表形成铁锰氧化物膜[20]等,从而影响养分、厌氧降解产生的还原性毒素[21]等的存在形态及其生物有效性.有氧层厚度除与维管束泌氧和根系泌氧有关外,还与沉积物耗氧速率和沉积物孔隙率等密切相关.
一般而言,沉积物-水界面中氧气消耗可以归结为3 个过程:有机物的需氧分解、动物的呼吸以及厌氧腐败的还原性产物的氧化,包括NH4+、Mn2+、Fe2+、H2S、FeS 和 FeS2[22].这些过程主要受微生物活动的影响,而微生物活动又与光照、营养元素等息息相关.沉积物耗氧速率在综合评价水体水质和环境特征时是一个非常有用的参数,对分析水体氧收支平衡和评价水环境质量具有重要意义[14].实验监测了3 种沉积物的耗氧速率依次为香溪河<太湖<东湖(表1),这与有机质含量的规律相一致.Raun 等[23]的研究也表明,沉积物中有机质含量越高,氧耗越大.沉积物的氧气消耗很大程度上受氧气从沉积物表面水中穿过沉积物的传递过程影响.这些传递过程包括分子扩散、生物扰动作用(与动物活动引起的溶解物和颗粒的传输相似的扩散)、生物喷灌(由管栖动物泵吸活动引起的溶解物传输过程)以及由水流和波浪引起的对流[22].实验开始后,溶解氧在距离沉积物表面2 mm 左右处耗尽,平滑的剖面表明沉积物中氧气的垂直传递机制主要是分子扩散[22],并且可能还有小型动物引起的生物扰动.实验中东湖沉积物孔隙率最低,使得分子扩散速率也相对较低,而耗氧速率最高(表1),因而沉积物-水界面有氧层厚度也最小.
2.2.2 沉积物-水界面pH 和氧化还原电位的垂直分布 pH 的作用主要表现在影响沉积物中微生物的活动和离子的存在状态,如影响反硝化细菌和产硫菌等,对物质的迁移或富集有一定的影响.因此,pH 值是一个重要指标.培养60 d 不同沉积物pH 值变化各不相同,但就整体而言,沉积物pH 在整个剖面变化并不大,香溪河和东湖沉积物pH 在7.18 ~7.98 之间变动,太湖在6.32 ~7.19 间变动,均呈中性偏弱酸性或弱碱性.进入沉积物后,pH 值随沉积物深度增加而降低(图5),这反映了不同沉积物pH 垂向分布特征的多样性.
除pH 外,沉积物的氧化还原电位也是沉积物的重要理化指标.ORP 的高低能反映其氧化还原能力的强度,它对化合物和矿物的形成或分解具有重要作用[24],沉积物剖面的氧化还原状态分布不同,反映了不同深度的沉积物存在有机质的多少以及微生物活动强弱的差异[24].有黑藻的实验组氧化还原电位略高于没有黑藻的对照组(图5),这主要是受DO 的影响,黑藻根系泌氧和维管束泌氧的存在使植物根际还原性物质被氧化,导致氧化还原电位升高.另外,DO 的变化可能改变离子的存在状态,引起pH 的变化.而DO 和pH 的变化又可能影响沉积物中微生物的活性和种类,引起N2O 和H2S 的变化.
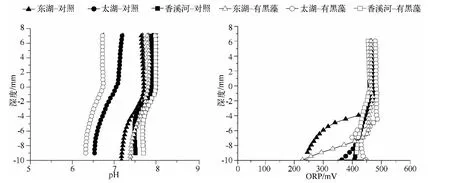
图5 培养60 d 后不同处理组沉积物中pH 和ORP 的垂直变化Fig.5 Vertical characteristics of pH and ORP in the sediments after cultivation of 60 d
2.2.3 沉积物-水界面N2O 和H2S 的变化 沉积物中氮含量反映了湖泊的营养状况和污染程度.氮在湖泊沉积物-水界面的迁移转换是一个复杂的过程,硝化和反硝化作用是沉积物-水界面氮迁移和交换的主要形式.沉积物-水界面的硝化和反硝化反应是垂向分层进行的,反硝化作用仅发生在好氧-厌氧界面以下的一个狭小的区域[25].界面附近的微生物脱氮过程即反硝化作用可以将硝酸盐或亚硝酸盐还原成N2O、N2等气体并被排出水体.培养30 d 后,实验组和对照组N2O 差异并不明显(图6),这主要与沉积物中反硝化细菌的种类和数量有关.另外,有黑藻的实验组无论水体还是沉积物中N2O 的含量都较对照组低,这是由于黑藻根系泌氧和维管束泌氧改变了根际微区的微环境,不利于反硝化菌的代谢活动,使沉积物-水界面的N2O降低.
沉积物中硫化氢的形成主要是由硫酸盐的还原作用造成的,该还原作用对水生态系统中的氧来说是最为重要的可选择的电子受体[26].硫化物主要受pH 的影响,在主要受控于pH 的条件下能够形成一个H2S 的化学平衡,即:

然而实验发现,对于不同沉积物,H2S 含量很少且变化并不明显,太湖略高于另外两种沉积物(图6),这主要一方面是由于酸性条件反而有利于上述平衡左移而产生H2S;另一方面,沉积物微区微环境的改变,还原性物质被氧化,也不利于H2S 的产生.
3 结论

图6 培养30 d 后不同处理组沉积物中N2O 和H2S 的垂直变化Fig.6 Vertical characteristics of N2O and H2S in the sediments after cultivation of 30 d
1)3 种水体沉积物中黑藻生长状况均良好,对于不同沉积物可以改变其生物量、生理及生化指标,具体表现为:东湖沉积物中黑藻的生物量、分枝数、根长、根数等均高于香溪河和太湖沉积物,黑藻有一定的耐污适应能力.
2)黑藻通过根系泌氧和维管束泌氧使沉积物-水界面有氧层厚度增加,改变根际微区的微环境.有氧层厚度的增加可能改变了沉积物中微生物的种类和数量,并使根系微区微环境中还原性物质被氧化,氧化还原电位升高.
3)DO 的变化造成根际微区微环境的变化,影响沉积物中微生物的活动和离子的存在状态,并进一步对pH、N2O、H2S 及水体和沉积物中的物质循环等产生影响.最终改变水体及沉积物的营养状况,如使水体和沉积物中N、P 等含量降低.
[1]高慧琴,刘 凌,方泽建.夏季湖泊表层沉积物的理化性质与微生物多样性.河海大学学报:自然科学版,2011,39:361-366.
[2]Holtan H,Nielsen LK,Stuanes AO.Phosphorus in soil,water and sediment:An overview.Hydrobiologia,1988,170:19-34.
[3]胡 俊,刘永定,刘剑彤.滇池沉积物间隙水中氮-磷形态及相关性的研究.环境科学学报,2005,25:1391-1396.
[4]范成新,杨龙元,张 路.太湖底泥及其间隙水中氮磷垂直分布及相互关系分析.湖泊科学,2000,12:359-366.
[5]王海珍,陈德辉,王全喜等.水生植被对富营养化湖泊生态恢复的作用.自然杂志,2001,24:33-36.
[6]郭万喜,侯文华,缪 静等.不同水生植物对系统中磷分配的影响.北京化工大学学报,2007,34:1-4.
[7]成小英,王国祥,濮培民.冬季富营养化湖泊中水生植物的恢复及净化作用.湖泊科学,2002,14:139-144.
[8]徐德兰,刘正文,雷泽湘.大型水生植物对湖泊生态修复的作用机制研究进展.长江大学学报:自然科学版,2005,2:14-19.
[9]Yu H,Ye C,Song C et al.Comparative analysis of growth and physio-biochemical responses of Hydrilla verticillata to different sediments in freshwater microcosms.Ecological Engineering,2010,36:1285-1289.
[10]蒋金辉,周长芳,安树青等.工具种轮叶黑藻的组织培养与快速繁殖.湖泊科学,2008,20:215-220.
[11]汪志国,王 静,李国刚.双波长分光光度法同时测定叶绿素a、b.中国环境监测,1999,15:21-22.
[12]司皖甦,王 芹.两种消解方法测定湖泊沉积物中总磷的比较.仪器仪表与分析监测,2008,(1):39-40.
[13]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4 版.北京:中国环境科学出版社,2002.
[14]许倩颖,宋丁全,王建军.太湖沉积物耗氧速率空间异质性研究.金陵科技学院学报,2011,27(4):49-53.
[15]Colmer TD,Pedersen O.Underwater photosynthesis and respiration in leaves of submerged wetland plants:gas films improve CO2and O2exchange.New Phytologist,2008,177(4):918-926.
[16]吴 娟,吴振斌,成水平.黑藻对水体和沉积物理化性质的改善和营养元素的去除作用.水生生物学报,2009,33:589-595.
[17]万国江.环境质量的地球化学原理.北京:中国环境科学出版社,1988.
[18]苏文华,张光飞,张云孙等.5 种沉水植物的光合特征.水生生物学报,2004,28:391-395.
[19]Armstrong J,Armstrong W,Beckett PM.Phragrnites australis:venturi-and humidity-induced pressure flows enhance rhizome aeration and rhizosphere oxidation.New Phytologist,1992,120:197-207.
[20]邓 泓,叶志鸿,黄铭洪.湿地植物根系泌氧的特征.华东师范大学学报,2007,(6):69-76.
[21]Li Y,Wang X.Root-induced changes in radial oxygen loss,rhizosphere oxygen profile,and nitrification of two rice cultivars in Chinese red soil regions.Plant and Soil,2013,365:115-126.
[22]Berg P,Røy H,Janssen F et al.Oxygen uptake by aquatic sediments measured with a novel non-invasive eddy-correlation technique.Marine Ecology Progress Series,2003,261:75-83.
[23]Raun AL,Borum J,Sand-Jensen K.Influence of sediment organic enrichment and water alkalinity on growth of aquatic isoetid and elodeid plants.Freshwater Biology,2010,55:1891-1904.
[24]赵兴青,杨柳燕,于振洋等.太湖沉积物理化性质及营养盐的时空变化.湖泊科学,2007,19(6):698-704.
[25]Nielsen LP,Christensen PB,Revsbech NP et al.Denitrification and photosynthesis in stream sediment studied with microsensor and whole-core techniques.Limnol Oceanogr,1990,35:1135-1144.
[26]Pedersen O,Binzer T,Borum J.Sulphide intrusion in Eelgrass (Zostera marina L.).Plant,Cell and Environment,2004,27:595-602.
