西藏尼洋河水生生物群落时空动态及与环境因子的关系:1.浮游植物*
2013-05-28刘海平叶少文杨雪峰张良松钟国辉李钟杰
刘海平,叶少文,杨雪峰,张良松,钟国辉,李钟杰**
(1:西藏大学农牧学院,林芝 860000)
(2:中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072)
(3:中国科学院大学,北京 100049)
(4:锡林浩特市第六中学,锡林浩特 026000)
(5:福建省水产技术推广总站,福州 350003)
由于青藏高原的隆升,对高原河流湖泊水系的演化起到了积极的推动作用[1],因而其独特的生态位以及科研价值愈发凸显.一方面高原河流湖泊对全球变暖有着积极的响应[2],拥有特殊的生态系统服务功能[3],另外,由于高原湖泊沉积物中储存的信息折射了矿物学[4]、同位素地球化学[5]、生物学[6]等方面内容,得到了科研工作者的推崇.不容忽视的是,青藏高原气温在逐年上升[7-8],预计到2100年青藏高原气温将上升2.0 ~3.6℃[9],加之人类干扰程度的不断加剧[10],对高原河流生态系统产生了巨大的冲击,水资源脆弱性发生了改变[11],地表径流减少,湖泊萎缩,湿地退化.同时,由于高原河流蕴藏着巨大的水能资源,水电站的开发和建设不可避免地踊跃出现,河流的生态系统完整性迎来了挑战[12].生态系统完整性不仅要求生态系统结构的完整以及结构合理,也要求生态系统功能健全以及功能正常发挥,比较而言,高原河流水资源较为脆弱,水资源承载能力与区域经济、社会发展和生态环境保护方面容易发生错位[13],促进高原河流流域的可持续发展则显得尤为重要[14-15].
西藏是我国河流较多的省区之一,流域面积大于10000 km2的河流有20 余条,该区水量充沛,仅次于四川,居全国各省区的第二位[16].随着社会和经济的发展、旅游业的兴起、水电站开发、现代农牧业的推广等,逐渐演变为尼洋河周边地区发展趋势,加之尼洋河鱼类区系结构较为简单[17],易受到环境条件的波动.本系列论文选择尼洋河水生生物作为研究对象,分析各类水生生物群落结构的时空动态,判断尼洋河水质理化因子与各类水生生物群落之间的相互关系,通过筛选关键水质理化因子,推断和演绎它们与水生生物群落结构的作用机制,从而为尼洋河水域生态的可持续发展提供理论基础.
浮游植物是一个生态学单位,它包括所有生活在水中营浮游方式生活的微小植物,通常就指浮游藻类,而不包括细菌和其他植物[18].浮游植物可作为渔产潜力估算重要的依据[19],在水域生态系统的上行效应和下行效应中发挥着重要的作用,很有必要对浮游植物进行功能类群划分[20],以便更好地理解浮游植物群落,控制水域生态系统的能量流和物质流,从而保障水域生态系统的可持续发展.研究表明,气候变暖促进了浮游植物春季的繁殖,浮游植物最大生物量以及个体大小呈现减小的趋势[21],浮游植物群落结构的演替从耐温性上表现出冷水性物种减少而暖水性物种增多的趋势,而在营养结构上表现出嗜氮性物种增多的演替趋势[22].由于海拔和环境的影响,高原河流浮游植物群落比较稳定,种类分布较为均匀,表现为贫营养型河流的特征,水域环境表现良好[23].在全球气候变暖和人类活动对自然影响的框架之下,尼洋河水域生态安全屏障愈发突出,通过有效检测浮游植物群落,积极推动尼洋河水域生态系统健康发展则显得尤为重要.
1 实验设计和数据处理
1.1 研究区域概况
尼洋河流域位于西藏林芝地区西部(29°26' ~ 29°55'N,92°22' ~94°27'E).全长 286 km,流域面积为17535 km2,河流大体由西偏北往东偏南流,其中,上游大致为东西流向,到中下游尼西附近转为南东流向.尼洋河全干流的落差为2080 m,平均坡降为7.27‰[16].
1.2 采样点设置
根据河流形态特征设置4 个采样点,每个采样点采集3 次平行样进行分析.4 个采样点分别位于尼洋河中上游(样点Ⅰ;29°53'N,93°16'E;海拔 3391 m)、尼洋河中游(样点Ⅱ;30°00'N,93°54'E;海拔 3225 m)、尼洋河中下游(样点Ⅲ;29°31'N,94°27'E;海拔2946 m)以及尼洋河与雅鲁藏布江交汇处(样点Ⅳ;29°26'N,94°28'E;海拔 2919 m),详见图 1,采样范围为 29°26' ~30°00'N,93°16' ~94°28'E,海拔高度从 3391 m 降至2919 m,落差接近500 m.
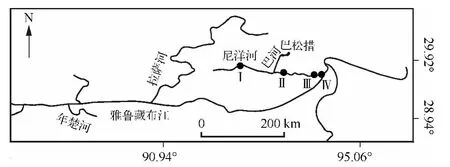
图1 尼洋河采样点分布Fig.1 Distribution of sampling sites in Niyang River
1.3 采样时间
从2008年11月开始采集水样,用于理化分析,除2月份水样因部分路面结冰无法采样外,其他月份水样均已按照月份进行采集和分析;各类水生生物样本按照每个样点每个季节采集1 次,即:春季(3月份)、夏季(6月份)、秋季(9月份)、冬季(12月份),共 16 个样本.
1.4 环境因子的采集和分析
为了探析各类水生生物与环境因子之间的关系,初步选择11 项环境因子作为研究对象,包括:1 个分组变量,即:河流底质类型(砂石、泥土);10 个连续变量:采样点海拔、表层水温(WT)、表层pH、硬度(Hardness)、矿化度(TDS)、表层溶解氧(DO)、总氮(TN)、铵态氮(NH4+-N)、总磷(TP)和总碱度(Alkalinity).
表层水温和pH 用德国CX-401 便携式多参数水质测定仪现场测定.硬度、矿化度、溶解氧、总氮、铵态氮、总磷和总碱度参照文献[24]开展野外采集和保存工作,带回实验室分析测定.以当量浓度(meq/L)计Ca2+和Mg2+浓度,二者之和乘以系数2.804,即为水体的硬度,单位为°DH(德国度).Mg2+和Ca2+均参照GB/T 11905-1989(火焰原子吸收法)测定;水样在103 ~105℃下烘干,所得为残渣量,在没有污染的水体中,残渣量等同为矿化度[24];表层溶解氧参照GB/T 7489-1987(碘量法)测定;总氮参照GB/T 11894-1989(碱性过硫酸钾消解紫外分光光度法)测定;铵态氮参照GB/T 7479-1987(钠氏试剂光度法)测定;总磷参照GB/T 11893-1989(钼锑抗分光光度法)测定;总碱度参照酸碱指示剂滴定法测定[24].
1.5 数据统计和分析
用主成分分析方法(PCA)分析尼洋河浮游植物时空特征,用Duncan 法检验各采样点以及季节之间各类水生生物相关参数的差异性,用分类回归树模型(Classification and Regression Tree Model,CART)和典范对应分析方法(Canonical Correlation Analysis,CCA)分析尼洋河各类水生生物与环境因子之间的关系.分析前,须对按照月份采集的水体理化指标根据季节归类整理,即:春季(1、3月份)、夏季(4-6月份)、秋季(7-9月份)和冬季(10-12月份).在CCA 分析前对各类水生生物数据和环境因子数据进行lg(x+1)对数转化的标准化处理,用R 语言软件(2.14.1)对数据进行分析.
1.6 浮游植物的采集和分析
用300 目的浮游生物网过滤20 L 水,得到的浮游植物定量样品加入鲁哥试剂保存,带回实验室,静置48 h后浓缩.计数时,将浓缩样充分摇匀后吸取0.1 ml 置于计数框内,在10×40 倍显微镜下观察,每片有46行,每片计数框计数N 行,每个样品计数2 次,取其平均值.2 次计数结果与其平均值之差小于10%说明结果有效,否则须计数第3 片,鉴定到种或属[25-26].
按照如下公式对浮游植物进行定量分析:

为了进一步反映尼洋河浮游植物群落的时空特征,对Shannon-Wiener 多样性指数(H')、Pielou 均匀度指数(J')、物种丰富度和总丰度等进行分析.
Shannon-Wiener 多样性指数[27]为:

Pielou 均匀度指数[28]为:

式中,S 为浮游植物种类数,pi为浮游植物i 种占所有浮游植物的比例(%),H'max为理论最大多样性指数.
物种丰富度指某一采样点或者季节出现的物种个数.
总丰度指某一采样点或者季节单位体积出现的浮游植物个体数量(cells/L).
出现频率指某一浮游植物出现的次数占所有调查样点数的百分比.
相对丰度指某一浮游植物个体数占所有物种个体数的百分比.
2 结果与分析
2.1 尼洋河浮游植物种类以及优势种
尼洋河共有浮游植物7 门29 科48 属,包括硅藻门、蓝藻门、绿藻门、隐藻门、黄藻门、甲藻门、裸藻门,其中硅藻门8 科20 属,蓝藻门6 科8 属,绿藻门10 科13 属,甲藻门2 科2 属,裸藻门1 科3 属,隐藻门和黄藻门各1 科1 属(表1).
将浮游植物出现频率在90%以上的定义为优势种,结果表明,尼洋河浮游植物优势类群以硅藻为主,包括脆杆藻科的脆杆藻和等片藻,舟形藻科的舟形藻,桥弯藻科的桥弯藻,异极藻科的异极藻,曲壳藻科的曲壳藻,菱板藻科的菱形藻,以上7 属硅藻的相对丰度之和达79.25%,其中以桥弯藻的相对丰度最大,达19.70%,其次是曲壳藻和舟形藻,分别达18.54%和10.62%(表1).
2.2 尼洋河浮游植物时空变化特征
尼洋河浮游植物主要包括硅藻、绿藻和蓝藻,对其总丰度自然对数化,缩小其数量级差距,分析尼洋河3大藻类的时空演替特征(图2).在尼洋河沿程以及季节方面,硅藻的丰度占有绝对优势,为尼洋河的优势藻类.就尼洋河沿程方面而言,绿藻总丰度在尼洋河下游出现一个峰值,以此为界,尼洋河其他河段绿藻总丰度处于减少趋势,硅藻总丰度与绿藻的变化趋势一致,蓝藻总丰度变化趋势与绿藻有所不同,尼洋河中游蓝藻总丰度最低,低于绿藻的总丰度,在下游略有上升,但也未及绿藻的总丰度.
在季节方面,硅藻和绿藻总丰度在夏季均出现最大值,冬季则不同,硅藻总丰度达到了最低值,而绿藻则有所回升,但仍比夏季低,蓝藻总丰度在秋季出现最低值,以此为界,尼洋河其他河段的蓝藻总丰度呈增加趋势,最大值出现在冬季.
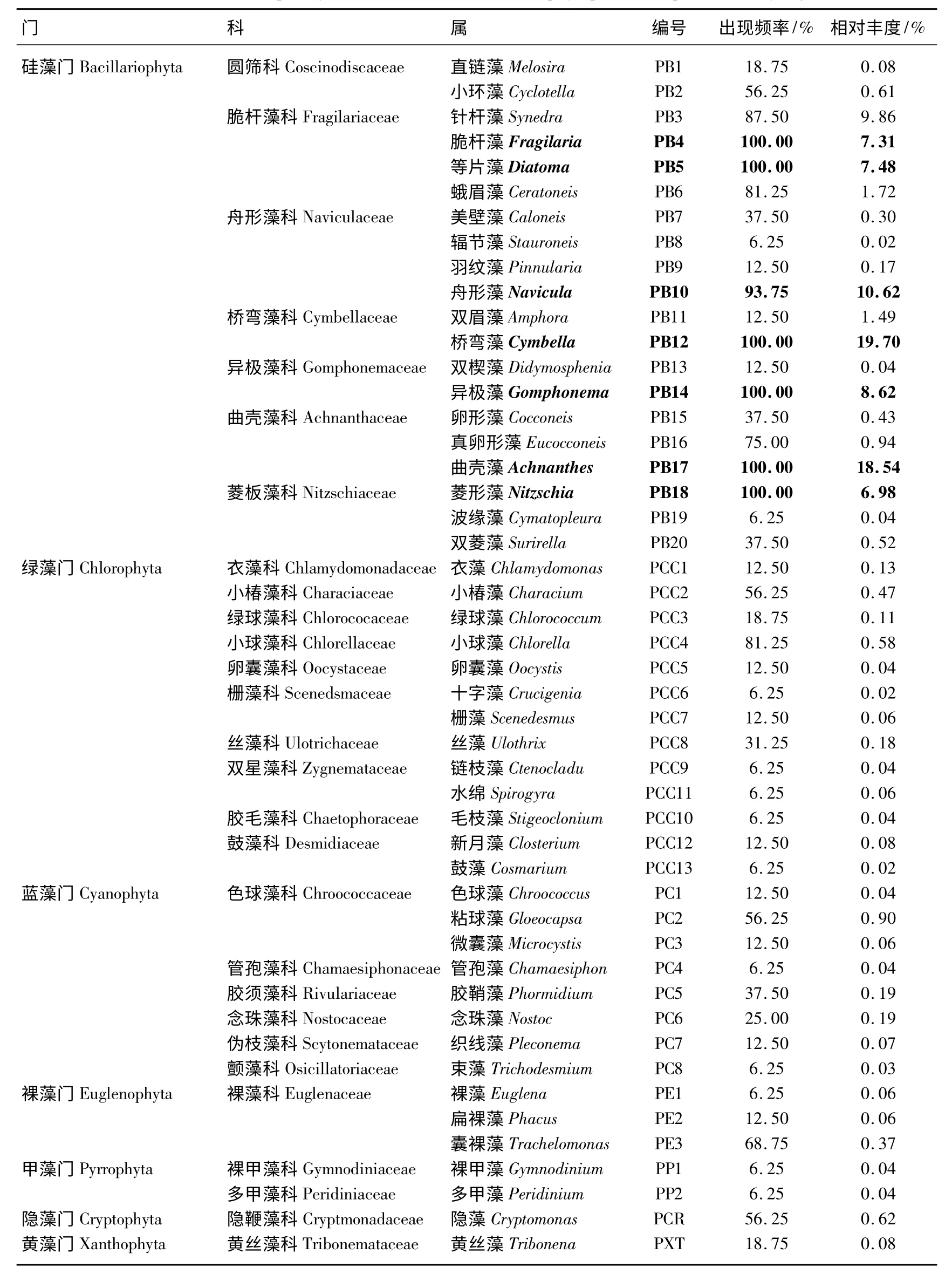
表1 尼洋河浮游植物种类出现频率和相对丰度*Tab.1 Occurrence frequency and relative abundance of phytoplankton species in Niyang River

图2 尼洋河浮游植物硅藻、绿藻、蓝藻时空演替特征Fig.2 Spatio-temporal succession characteristics for phytoplankton about Bacillariophyta,Cyanophyta and Chlorophyta in Niyang River
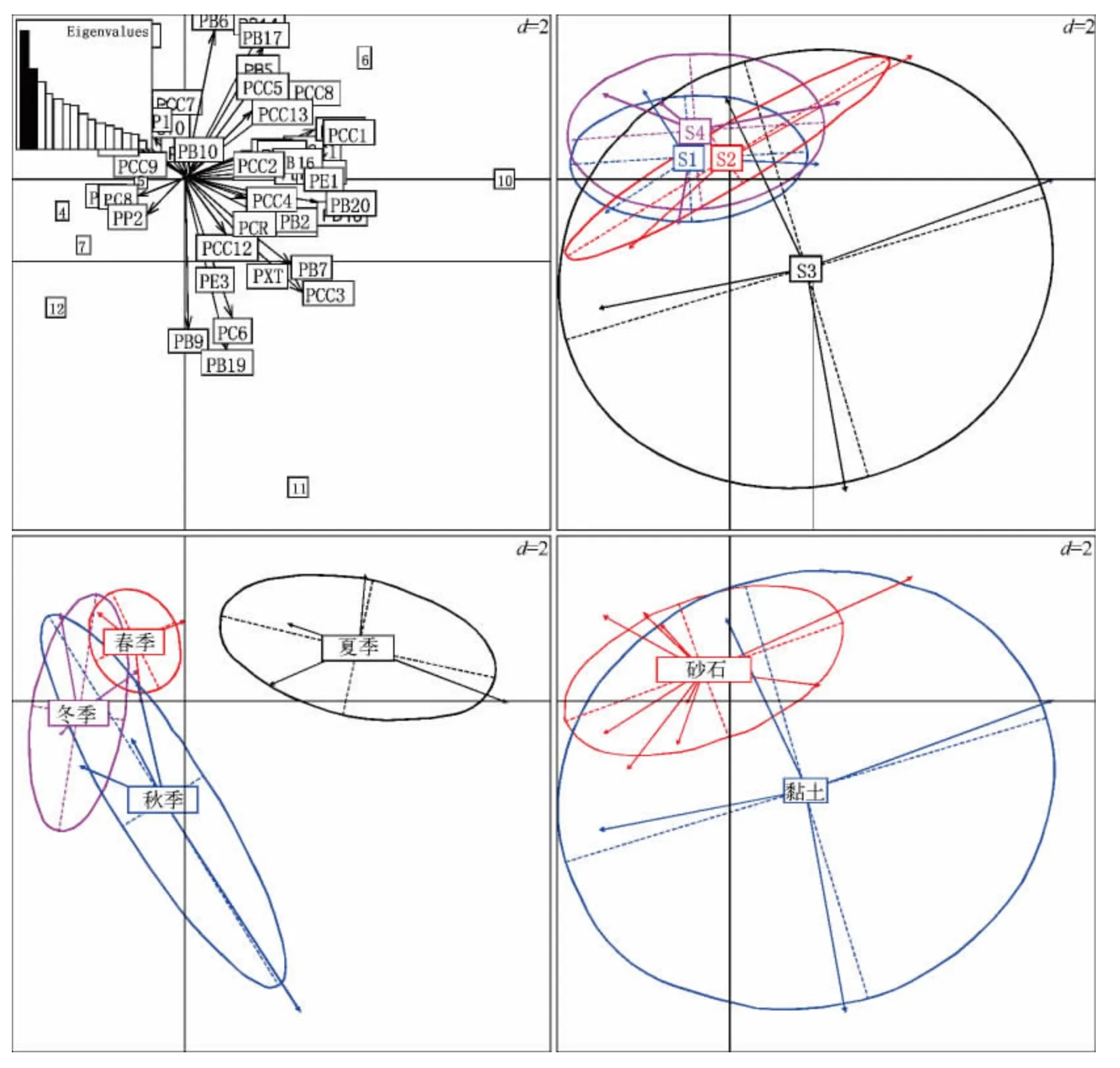
图3 基于PCA 分析尼洋河浮游植物时空特征(图中数字为样点标记,其中1 ~4分别代表采样点Ⅰ的春、夏、秋、冬季,5 ~8 代表采样点Ⅱ的四季,9 ~12 代表采样点Ⅲ的四季,13 ~16 代表采样点Ⅳ的四季;S1 代表采样点Ⅰ,S2 代表采样点Ⅱ,S3 代表采样点Ⅲ,S4 代表采样点Ⅳ.第一主成分解释率为18.5%(图中左上图第一条黑色柱所示),第二主成分解释率为12.5%(图中左上图第二条黑色柱所示)Fig.3 Spatio-temporal characteristics for phytoplankton in Niyang River based on PCA
用PCA 方法分析了尼洋河沿程、季节以及河道底质方面浮游植物群落结构特征(图3)发现,尼洋河下游浮游植物群落较其他河段囊括的范围大,尼洋河中游浮游植物群落囊括的范围最小.尼洋河夏季的浮游植物群落结构与其他季节的分离,说明夏季的浮游植物群落较为独特,秋季的浮游植物群落囊括范围较春季和冬季大,春季囊括的游植物群落范围最小.尼洋河底质为黏土的河段浮游植物群落囊括的范围远远大于底质为砂石的河段,可见底质为黏土的河道对浮游植物群落结构有着很重要的影响.
尼洋河沿程浮游植物群落4 个生物多样性指标不存在显著差异(P >0.05),物种丰富度、总丰度以及Shannon-Wiener 多样性指数呈现一致的趋势,即:尼洋河下游(采样点Ⅲ)最高,中上游以及交汇处呈现下降趋势,物种丰富度平均值在20 左右,总丰度在2×105cells/L 左右,Shannon-Wiener 多样性指数在2.2 左右.Pielou 均匀度指数则在尼洋河中游出现峰值,其他河段呈下降趋势,Pielou 均匀度指数平均值在0.75 左右,交汇处的Shannon-Wiener 多样性指数以及Pielou 均匀度指数较其他河段均低(图4).

图4 尼洋河浮游植物时空变化特征(用Duncan 法检验各采样点以及季节之间浮游植物生物多样性差异性,不同字母表示差异达显著水平(P <0.05))Fig.4 Spatio-temporal dynamic characteristics for phytoplankton in Niyang River
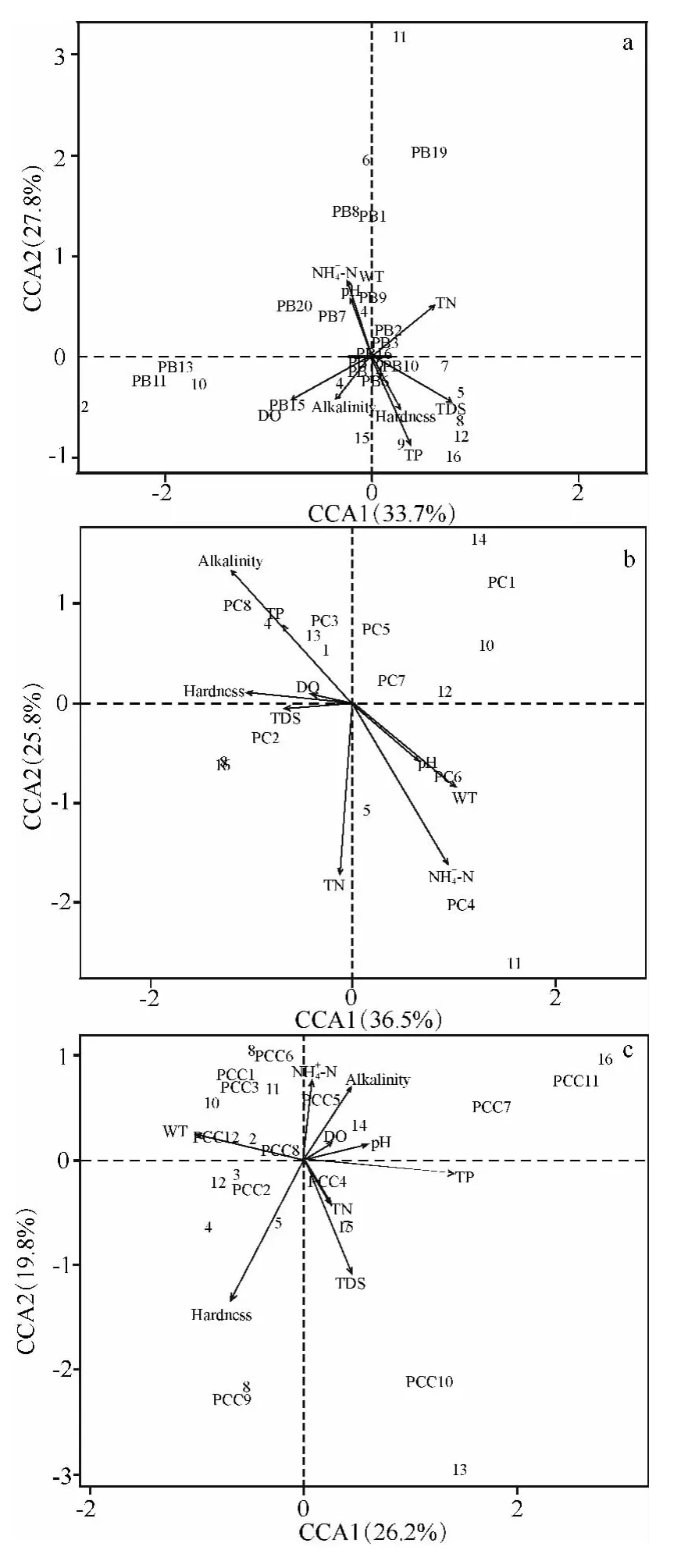
图5 基于CCA 方法分析尼洋河硅藻(a)、蓝藻(b)、绿藻(c)与环境因子、样点之间的关系Fig.5 Relationships among phytoplankton(a:Bacillariophyta;b:Cyanophyta;c:Chlorophyta),environment factors and sampling sites in Niyang River based on CCA
4 个多样性指标在季节之间则有较大的变化幅度.夏季的浮游植物物种丰富度与其他季节存在显著差异(P <0.05),这个季节的总丰度与秋、冬季存在显著差异(P <0.05),物种丰富度与总丰度在该季节均为最大值,分别约为25 和3×105cells/L,物种丰富度最小值出现在春季,刚刚超过15,总丰度最小值出现在冬季,在105cells/L 以下.冬季的浮游植物Shannon-Wiener 多样性指数在显著差异(P <0.05),冬季 Pielou 均匀度指数与其他 3 个季节的存在显著差异(P <0.05),Shannon-Wiener 多样性指数与Pielou 均匀度指数在该季节均为最大值,Shannon-Wiener 多样性指数接近 2.4,Pielou 均匀度指数刚愈0.85,Shannon-Wiener 多样性指数最低值出现在春季,在2.0 以下,Pielou 均匀度指数最低值出现在夏季,在0.70 以上.
2.3 尼洋河浮游植物与环境因子的关系及关键预测因子
为了更加清晰地表达尼洋河浮游植物与环境因子之间的关系,将浮游植物主要的3 个类群与9项环境指标进行了CCA 分析,浮游植物群落包括硅藻、蓝藻和绿藻,9 项环境指标包括表层水温、表层pH,硬度、矿化度、表层溶解氧、总氮、铵态氮、总磷、总碱度.结果显示,硅藻门部分藻类与环境因子存在较大的关联,如:舟形藻科的美壁藻以及羽纹藻、双菱藻科的双菱藻,这些藻类的密度与理化因子铵态氮、表层pH 值、表层水温有着很大的关联;曲壳藻科的卵形藻的密度与表层溶解氧以及总碱度有着很大的关联.蓝藻门的部分藻类与环境因子存在着较大的关联,如:色球藻科的微囊藻以及颤藻科的束藻的密度与总碱度、总磷相关联,管孢藻科的管孢藻的密度与铵态氮有着较大的关联,念珠藻科的念珠藻的密度与表层pH 值以及表层水温有着较大的关联.绿藻门仅有卵囊藻科的卵囊藻的密度与铵态氮存在较大的关联,鼓藻科的新月藻的密度与表层水温存在较大的关联(图5).
选择浮游植物总丰度、Shannon-Wiener 多样性指数、Pielou 均匀度指数3 项指标,采用CART 模型预测浮游植物群落与环境因子的相互作用关系,结果显示,尼洋河浮游植物总丰度受到pH 值、季节以及河道底质等因素的影响(图6).具体来讲,当pH 值≥8.0 且为夏、冬季时,浮游植物总丰度为102541.66 cells/L;当pH 值≥8.0 且为秋季和春季时,浮游植物总丰度为145666.65 cells/L;当pH 值<8.0 且河道底质为黏土时,浮游植物总丰度为37950 cells/L;当pH 值<8.0、河道底质为砂石且为秋季时,浮游植物总丰度为57499.98 cells/L;当pH 值<8.0、河道底质为砂石且季节为夏季和冬季时,浮游植物总丰度为43700.03 cells/L;当pH 值<8.0、河道底质为砂石且季节为春季时,浮游植物总丰度为161766.67 cells/L.综上所述,尼洋河浮游植物总丰度受到pH 值和底质的影响较大.
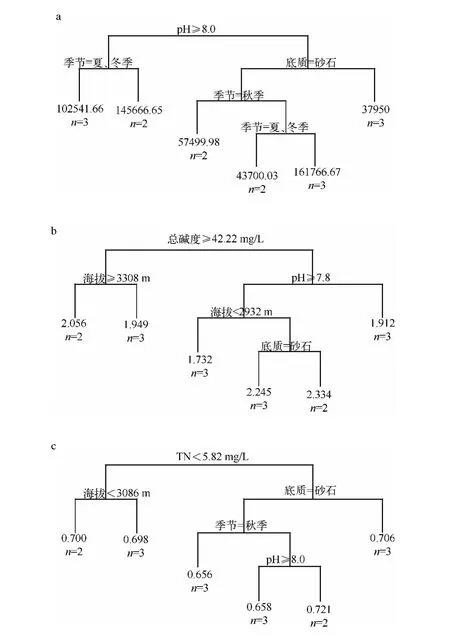
图6 基于分类回归树分析尼洋河浮游植物总丰度(a)、Shannon-Wiener 多样性指数(b)、Pielou 均匀度指数(c)与环境因子之间的关系(分支左侧代表条件成立,右侧代表相反条件成立)Fig.6 Relationship between total abundance(a),Shannon-Wiener diversity index(b),Pielou evenness index(c)of phytoplankton and environment factors in Niyang River based on CART
尼洋河浮游植物Shannon-Wiener 多样性指数(H')受到总碱度、pH 值、海拔以及底质的影响,具体来讲,当总碱度≥42.22 mg/L 且海拔≥3308 m 时,H'为2.056;当总碱度≥42.22 mg/L 且海拔 <3308 m 时,H'为1.949;当总碱度 <42.22 mg/L 且 pH <7.8 时,H'为 1.912;当总碱度 <42.22 mg/L、pH≥7.8,同时海拔 <2932 m 时,H'为 1.732;当总碱度 <42.22 mg/L、pH≥7.8、海拔≥2932 m,同时河道底质为砂石时,H'为2.245.当总碱度<42.22 mg/L、pH≥7.8、海拔≥2932 m,同时河道底质为黏土时,H'为2.334.综上所述,尼洋河浮游植物H'受到河道底质的影响较大,底质为黏土的水域浮游植物H'较底质为砂石的大.
尼洋河浮游植物J'受到总氮、海拔、河道底质、季节以及pH 值的影响,具体来说,当总氮<5.82 mg/L 且海拔 <3086 m 时,J'为 0.700;当总氮 <5.82 mg/L 且海拔≥3086 m 时,J'为 0.698;当总氮≥5.82 mg/L 且河道底质为黏土时,J'为0.706;当总氮≥5.82 mg/L、河道底质为砂石且季节为秋季时,J'为0.656;当总氮≥5.82 mg/L、河道底质为砂石、季节为春、夏、冬季,同时pH≥8.0 时,J'为0.658;当总氮≥5.82 mg/L、河道底质为砂石、季节为春、夏、冬季,同时pH <8.0 时,J'为0.721.综上所述,尼洋河浮游植物J'受到pH 值影响较大,pH 值低于8.0 的水域浮游植物J'比pH 值高于8.0 的大.
3 讨论
演替是一个特定水体内的物理(如光、温度)、化学(营养物、水质、毒素)和生物(竞争、捕食)因素的改变所引致的种类变化[18].浮游植物群落存在季节演替[29],外界环境条件的改变较之群落初始物种组成对浮游植物群落的演替顺序更具决定性作用[30],温度、氮磷比和水体稳定性是影响浮游植物群落演替的主要因子[31].
海拔决定了一个地区的温度和光照等环境因素的变化,属于宏观尺度的环境因子,通常情况下,由于海拔的升高,水域温度降低,冰冻期延长[32-33],物种的丰富度也随之降低[34],浮游植物的总丰度呈现下降趋势[35],李芳[36]指出,尼洋河浮游植物总丰度与海拔呈负相关.海拔升高,水温降低,一般认为,水温降到浮游植物的最适温度以下时,浮游植物的生长逐渐减缓直至停止生长、甚至消失,其光合作用的强度也随之逐渐降低[37].
一方面,水温是影响浮游植物种类组成及生物量的关键因子[38].随着水温的升高,大量浮游植物得以快速生长和繁殖[39],也有资料表明水温与浮游植物丰度呈负相关[40],原因在于研究区域(长江近海岸)的固定优势种(具槽帕拉藻Paralia sulcata)易聚集于透明度<10 m、温度<15℃的水体之中,合适的较低水温使得优势种在水体上部得以生长和繁殖.由于浮游植物物种丰富度、总丰度以及多样性指数所阐述的生物学意义有所不同,对水温的响应有所区别,吴卫菊等[23]指出,水温变化与浮游植物生物量呈极显著正相关关系,与浮游植物物种丰富度呈极显著负相关关系,与浮游植物生物多样性呈显著负相关关系.
另一方面,随着气候变暖,浮游植物群落的演替表现出物种对温度的生态适应性,这种演替对水域生态系统结构和功能有着深远的意义[41].水温高于14℃时,微囊藻生物量迅速增加;束丝藻生物量随温度增加而增加,高于22℃时迅速减少[38].平均温度低于20℃时,蓝藻没有大规模生长,硅藻门、绿藻门生物量急剧降低,温度超过25℃时,蓝藻迅速增长并很快成为绝对优势种[42].
中间高度膨胀(mid-altitude bulge)理论指出,往往在中间海拔区域内,物种的多样性较高,在低海拔或者高海拔区域内,物种的多样性较低[43].本研究中,尼洋河浮游植物多样性(Shannon-Wiener 多样性指数和Pielou 均匀度指数)符合中间高度膨胀理论,表现为尼洋河沿程浮游植物多样性变化特点基本一致,即:尼洋河中下游(中游)浮游植物Shannon-Wiener 多样性指数(Pielou 均匀度指数)最大,其他河段Shannon-Wiener多样性指数呈下降趋势.也有资料表明,海拔与浮游植物Shannon-Wiener 多样性指数和Pielou 均匀度指数呈正相关[44],初步推断出现这一矛盾在于海拔的梯度是否达到浮游植物多样性峰值转折点.
不容忽视的是,营养盐在影响浮游植物生物量的同时,对浮游植物的群落结构也产生影响,不同浮游植物类群对营养盐的敏感性不同[45].值得强调的是,N、P 含量及其组成与浮游植物关系较为密切,是影响浮游植物演替的重要因子.不同氮磷比对浮游植物群落的多样性指数、物种组成及演替过程均有显著影响[46].另外,在同一季节,硅藻和甲藻利用不同层次的氮盐,能有效减少两者间的竞争压力[47].不同的硅藻种类对环境因子敏感性有所差异[48],如运动型(motile ecological guild)的硅藻对温度较为敏感,而喜静水型(low profile guild)以及喜流水型(high profile guild)的硅藻则对总氮、总磷等理化因子较为敏感[49].
实际上,浮游植物群落结构往往是多维环境因子综合作用的结果,如本研究中,硅藻门舟形藻科的美壁藻以及羽纹藻、双菱藻科的双菱藻,这些藻类密度与理化因子铵态氮、表层pH 值、表层水温有着很大的关联,曲壳藻科的卵形藻密度与表层溶解氧以及总碱度有着很大的关联;蓝藻门色球藻科的微囊藻以及颤藻科的束藻密度与总碱度、总磷相关联,管孢藻科的管孢藻密度与铵态氮有着较大的关联,念珠藻科的念珠藻密度与表层pH 值以及表层水温有着较大的关联;绿藻仅有卵囊藻科的卵囊藻密度与铵态氮存在较大的关联,鼓藻科的新月藻密度与表层水温存在较大的关联.
研究结果表明,尼洋河浮游植物类群以硅藻占有绝对优势,绿藻和蓝藻伴随存在,这主要由于尼洋河一年四季均以冷水为主,较为适合喜冷水的硅藻生长与繁殖[50].在尼洋河沿程方面,这3 类藻类演替受到河流的形态特征的影响,尼洋河下游较其它河段平缓,形成了独特的“尼洋河河谷”风景区,其河道底质以泥沙和黏土为主,具有较大的比表面积,更容易为浮游植物的生长和繁殖提供各类营养盐[51],同时由于河谷河段水流较其他河段平缓,减少了因水流给浮游植物带来的生存威胁[49],与海拔因素相比,尼洋河浮游植物物种丰富度或者总丰度对底质的响应更多一些,即以泥沙和黏土为底质的河道浮游植物物物种丰富度以及总丰度较砂石为底质的河道更大.在季节方面,这3 类藻类演替主要受到外源性补给水的影响,包括冰雪融水和降水,这些气候因素是水体营养盐,如硅磷比,发生改变的主要驱动因子[52],导致在夏季硅藻和绿藻总丰度上升为最大值.同时,由于受到环境同质性的影响,蓝藻呈下降趋势,在冬季,由于外源性补给水的减少,尼洋河水体受外界干扰作用减弱,浮游植物多样性,包括Shannon-Wiener 多样性指数和Pielou 均匀度指数,均达到了最大值.
[1]秦大河,陈宜瑜,李学勇等.中国气候与环境演变(上卷):中国气候与环境的演变与预测.北京:科学出版社,2005:389-390.
[2]Ju JT,Zhu LP,Feng JL et al.Hydrodynamic process of Tibetan Plateau lake revealed by grain size:Case study of Pumayum Co.Chinese Sci Bull,2012,57(19):2433-2441.
[3]贺桂芹.西藏高寒湿地生态系统服务功能价值评估及湿地保护对策研究[学位论文].杨凌:西北农林科技大学,2007.
[4]Wu WH,Xu SJ,Lu HY et al.Mineralogy,major and trace element geochemistry of riverbed sediments in the headwaters of the Yangtze,Tongtian River and Jinsha River.J Asian Earth Sci,2011,40(2):611-621.
[5]Wu WH,Zheng HB,Xu SJ et al.Geochemistry and provenance of bed sediments of the large rivers in the Tibetan Plateau and Himalayan region.Int J Earth Sci,2012,101(5):1357-1370.
[6]Bai JH,Cui BS,Chen B et al.Spatial distribution and ecological risk assessment of heavy metals in surface sediments from a typical plateau lake wetland,China.Ecol Model,2009,222(2):301-306.
[7]谢 虹.青藏高原蒸散发及其对气候变化的响应(1970-2010)[学位论文].兰州:兰州大学,2012.
[8]张云红,许长军,亓 青等.青藏高原气候变化及其生态效应分析.青海大学学报:自然科学版,2011,29(4):18-22.
[9]沈永平,王根绪,吴青柏等.长江-黄河源区未来气候情景下的生态环境变化.冰川冻土,2002,24(3):308-314.
[10]黄 琦.基于GIS 的三江源地区生态环境变化与人类活动影响研究[学位论文].北京:中央民族大学,2012.
[11]秦大河,陈宜瑜,李学勇等.中国气候与环境演变(下卷):气候与环境变化的影响与适应、减缓对策.北京:科学出版社,2005:98-109.
[12]翟红娟.纵向岭谷区水电工程胁迫对河流生态完整性影响的研究[学位论文].北京:北京师范大学,2009.
[13]段顺琼,王 静,冯少辉等.云南高原湖泊地区水资源脆弱性评价研究.中国农村水利水电,2011,9:55-59.
[14]胡元林,郑 文.高原湖泊流域可持续发展研究.生态经济,2011,236(3):168-171,183.
[15]洛桑·灵智多杰.青藏高原水资源的保护与利用.资源科学,2005,27(2):23-27.
[16]关志华,陈传友.西藏河流与湖泊.北京:科学出版社,1984.
[17]沈红保,郭 丽.西藏尼洋河鱼类组成调查与分析.河北渔业,2008,173(5):51-54,60.
[18]刘建康.高级水生生物学.北京:科学出版社,1999:176-198.
[19]胡 莲,潘晓洁,邹 曦等.三道河水库浮游植物群落结构特征及其渔产潜力分析.水生态学志,2012,33(4):90-95.
[20]刘足根,张 柱,张 萌等.赣江流域浮游植物群落结构与功能类群划分.长江流域资源与环境,2012,21(3):375-384.
[21]Sommer U,Aberle N,Lengfellner K et al.The Baltic Sea spring phytoplankton bloom in a changing climate:an experimental approach.Mar Biol,2012,159(11):2479-2490.
[22]刘东艳.胶州湾浮游植物与沉积物中硅藻群落结构演替的研究[学位论文].青岛:中国海洋大学,2004.
[23]吴卫菊,杨 凯,汪志聪等.云贵高原渔洞水库浮游植物群落结构及季节演替.水生态学杂志,2012,33(2):69-75.
[24]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4 版.北京:中国环境科学出版社,2002:45-46,109,121-124.
[25]朱蕙忠,陈嘉佑.中国西藏硅藻.北京:科学出版社,2000.
[26]胡鸿钧,李尧英,魏心印等.中国淡水藻类.上海:上海科学技术出版社,1980.
[27]Shannon EE,Weaver W.The mathematical theory of communication.London:University Illinois Press,1949:125.
[28]Pielou EC.Ecological diversity.New York:John Wiley,1975:165.
[29]Romanov RE,Kirillov VV.Analysis of the seasonal dynamics of river phytoplankton based on succession rate indices for key event identification.Hydrobiologia,2012,695(1):293-304.
[30]黄 伟,朱旭宇,曾江宁等.氮磷比对浙江近岸浮游植物群落结构影响的实验研究.海洋学报,2012,34(5):128-138.
[31]岳 强,黄 成,史元康等.广东南水水库富营养化与浮游植物群落动态.环境科学与技术,2012,34(8):112-116.
[32]Rundle SD,Jenkins A,Ormerod SJ.Macroinvertebrate communities in streams in Himalaya,Nepal.Freshwater Biol,1993,30(1):169-180.
[33]Ao M,Alfred JRB,Gupta A.Studies on some lotic systems in the north-eastern hill regions of India.Limnologica,1984,15(1):135-141.
[34]Suren AM.Macroinvertebrate communities of streams in western Nepal:effects of altitude and land use.Freshwater Biol,1994,32(2):323-336.
[35]张军燕.玛曲至湖口段黄河干流浮游生物群落结构特征研究[学位论文].西安:西北大学,2009.
[36]李 芳.西藏尼洋河流域水生生物研究及水电工程对其影响的预测评价[学位论文].西安:西北大学,2009.
[37]Talling JF.The relative growth rate of three plankton diatoms in relation to underwater radiation and temperature.Ann Bot,1995,19(2):329-341.
[38]代龚圆,李 杰,李 林等.滇池北部湖区浮游植物时空格局及相关环境因子.水生生物学报,2012,36(5):946-956.
[39]张才学,龚玉艳,孙省利.湛江港湾潜在赤潮生物的时空分布及其影响因素.生态学杂志,2012,31(7):1763-1770.
[40]郭术津,孙 军,戴民汉等.2009年冬季东海浮游植物群集.生态学报,2012,32(10):3266-3278.
[41]Winder M,Sommer U.Phytoplankton response to a changing climate.Hydrobiologia,2012,698(1):5-16.
[42]蔡琳琳,朱广伟,朱梦圆等.太湖梅梁湾湖岸带浮游植物群落演替及其与水华形成的关系.生态科学,2012,31(4):345-351.
[43]Zhao CM,Chen WL,Tian ZQ et al.Altitudinal pattern of plant species diversity in Shennongjia Mountains,central China.J Integr Plant Biol,2005,47(12):1431-1449.
[44]刘 艳.额尔齐斯河及邻近内陆河流域浮游植物生态学研究[学位论文].上海:上海海洋大学,2011.
[45]赖俊翔,俞志明,宋秀贤等.利用特征色素研究长江口海域浮游植物对营养盐加富的响应.海洋科学,2012,36(5):42-52.
[46]Huang W,Zhu XY,Zeng JN et al.Responses in growth and succession of the phytoplankton community to different N/P ratios near Dongtou Island in the East China Sea.J Exp Mar Biol Ecol,2012,434:102-109.
[47]袁 骐,王云龙,沈新强.N 和P 对东海中北部浮游植物的影响研究.海洋环境科学,2005,24(4):5-8.
[48]宋书群.黄、东海浮游植物功能群研究[学位论文].青岛:中国科学院海洋研究所,2010.
[49]Stenger KC,Lengyel E,Crossetti LO et al.Diatom ecological guilds as indicators of temporally changing stressors and disturbances in the small Torna-stream,Hungary.Ecol Indic,2013,24:138-147.
[50]沈韫芬,章宗涉,龚循矩等.微型生物监测新技术.北京:中国建筑工业出版社,1990.
[51]张 智,张显忠,杨骏骅.植物净化床对双龙湖水体有机污染物的去除效果分析.生态环境,2006,15(4):708-713.
[52]Morabito G,Oggioni A,Austoni M.Resource ratio and human impact:how diatom assemblages in Lake Maggiore responded to oligotrophication and climatic variability.Hydrobiologia,2012,698(1):47-60.
