MST3在颞叶癫痫模型小鼠海马的表达变化
2013-05-24何翠瑶谷容王刚王法祥
何翠瑶,谷容,王刚,王法祥
(1.重庆医科大学附属儿童医院临床药学室,重庆 400014;2.南昌大学附属第三医院神经内科,南昌 330008)
颞叶癫痫(temporal lobe epilepsy,TLE)是一种以反复抽搐发作为特点的常见神经系统疾病。因为海人酸 (kainic acid,KA)致癫痫模型在病程、病理、电生理等方面与人类颞叶癫痫非常相似而被广泛用于研究人类颞叶癫痫[1]。STE20(mammalian sterile 20,STE20)是酿酒酵母的一种丝氨酸/苏氨酸激酶,位于MAPK级联通路的上游,而MST3是哺乳动物STE20丝氨酸/苏氨酸蛋白激酶家族成员。新近研究显示,Ste20蛋白激酵素MST3在促进细胞凋亡中起到了重要作用[2,3]。而癫痫的发病机制以神经元损伤为主,凋亡是癫痫所致神经元死亡的重要机制。由此,提示MST3可能在癫痫发病过程中起到重要的作用,而目前对MST3在癫痫中的研究尚未见报道。为此,本研究采用海人酸所致癫痫模型,从基因、蛋白和组织形态学角度观察MST3在海马内的分布特点和动态表达特点,为进一步探讨MST3与神经元细胞凋亡的关系以及在调控癫痫发生发展中的作用提供依据。
1 材料与方法
1.1 材料
海人酸(kainic acid,KA;SIGMA公司),兔抗小鼠 MST3 抗体(mammalian sterile 20-like kinase 3,MST3;Abcam公司),生物素化山羊抗兔二抗(博士德公司),RNA 提取试剂盒,Quant一步法 RT-PCR试剂盒(天根公司),脑立体定向注射仪(Narishige公司),Olympus光学显微镜,Zeiss荧光显微镜(Oberkochen,Germany),LEICA QWin 图像处理与分析系统(德国)。
1.2 动物分组、模型制备、取材处理措施
取SPF级雄性 C57BL/6小鼠,体重20 ~22 g,8~10周龄,由重庆医科大学实验动物中心提供[SCXK(渝)2007-0001];饲养在重庆医科大学实验动物中心[SYXK(渝)2007-0001],每日光照 12 h,黑暗12 h,水食任意摄取,并按实验动物使用的3R原则给予人道的关怀。
实验小鼠随机分为对照组和模型组,模型组小鼠又根据时相点不同分为 KA注射后3、8、24 h组,每组6只。模型组和对照组小鼠均经4%水合氯醛腹腔麻醉后固定于脑立体定位仪上,去头顶部毛与消毒皮肤后正中切口,暴露前囟。根据 Franklin,KBJ小鼠脑立体定向图谱确定右侧脑室注射点坐标:于前囟后0.4 mm,中线右侧1.0 mm处,用电钻小心钻透颅骨,微量注射器自脑表面垂直进针2.3 mm,向右侧侧脑室缓慢注入2 μL(200 ng),注射时间10 min,留针5 min,缓慢退针。所有操作均在无菌条件下进行,皮肤切开处用青霉素抗菌,缝合伤口。生理盐水(NS)组注射等量NS。
模型组与对照组分别于处理后3、8、24 h直接或灌注后取脑,用于做RT-PCR、Western blot以及做免疫组织化学分析。
1.3 RT-PCR检测MST3 mRNA的表达
采用RT-PCR方法检测,按照说明书Trizol法提取总RNA。采用TaKaRa逆转录试剂盒合成cDNA。取总 RNA 2 μg,于 PCR 仪 42℃ 30 min(cDNA 合成),99℃ 5 min(逆转录酶失活),5℃ 5 min,-20℃保存备用。PCR扩增引物:由上海生工技术有限公司合 成。Mouse MST3,上 游 引 物:5'-AGCCGAGGACGAGATAGAG-3',下 游 5'-TCGTAGGCTGACTGCTTGA-3',退火温度为 58℃,扩增片段为 414 bp;mouse GAPDH退火温度为 56℃,上游引物 5'-TGTCGTGGAGTCTACTGGTG-3',下 游 引 物 5'-CTTCTGGGTGGCAGTGAT-3',扩增片段为 277 bp。应用BIO-PROFIF凝胶图象分析系统对目的电泳条带进行分析,以相应的内参电泳条带作为参照,结果以两者之积分吸光度的比值表示。
1.4 Western blot检测MST3蛋白的表达
将各组处理后的蛋白样品经10%SDS聚丙烯酰胺凝胶电泳80 min,再以100 mA电流持续转膜40 min,将凝胶上的蛋白转移到PVDF膜上。5%脱脂奶粉封闭1 h后加入一抗 (1.1000),4℃孵育过夜。过夜后复温至室温,TBST缓冲液反复洗膜5 min ×3次,加入二抗 (1.1000),37℃孵育1 h,再以TBST缓冲液反复洗膜5 min×6次。加入等比例化学发光试剂A与B后,直接在成像仪进行显影与采图。
1.5 免疫组织化学染色
将切片脱蜡至水,0.01 mol/L枸橼酸盐液微波热修复抗原,3℃ H2O2封闭内源性过氧化酶 10 min,BSA 37℃ 温箱封闭 20 min,滴加 MST一抗(1.100)4℃冰箱过夜,滴加羊抗兔二抗37℃温箱1 h,SABC 37℃ 20 min,DAB 显色镜下控制 3 min,脱水,透明,封片,显微镜下观察。用PBS代替一抗作为阴性对照。
1.6 数据统计
2 结果
2.1 动物行为学观察
正常对照组小鼠无抽搐等异常表现。KA注射后小鼠呈现以下表现:(1)急性期:KA注射后几分钟,小鼠出现点头、咀嚼及上肢抖动等症状,继而表现为翻滚、转圈,肢体尾部强直等癫痫持续状态,持续3~5 h。(2)静止期:症状基本消失,可有易激惹和较强的攻击行为。
2.2 注射KA后MST3 mRNA表达变化
与正常对照组相比,侧脑室注射KA后,海马组织的MST3 mRNA在3、8、24 h的表达均有升高,且呈现时间递增关系,24 h达到最高峰,差异有显著性(见表 1;图 1,2)。
表1 正常对照和癫痫实验模型MST3的mRNA和蛋白表达(,n=6)Tab.1 Expression of MST3 mRNA and protein in the PBS control and experimental groups of mice(,n=6)

表1 正常对照和癫痫实验模型MST3的mRNA和蛋白表达(,n=6)Tab.1 Expression of MST3 mRNA and protein in the PBS control and experimental groups of mice(,n=6)
注:*P <0.05 vs.PBS对照组;**P <0.05 vs.PBS对照组,实验组3、8 h。Note:*P <0.05 vs.PBS control group;**P <0.05 vs.PBS control group,and experimental group 3,8 h.
组别Groups蛋白表达Protein expression PBS对照组 PBS control group 0.169716±0.0119 73.2744±6基因表达mRNA expression.68926模型组3 h Experimental group 3 h 0.469716±0.0216* 132.5437±16.36904*模型组8 h Experimental group 8h 0.684593±0.0205 165.2685±17.96852模型组 24 h Experimental group 24 h 0.894884±0.0470** 175.6275±17.40065**
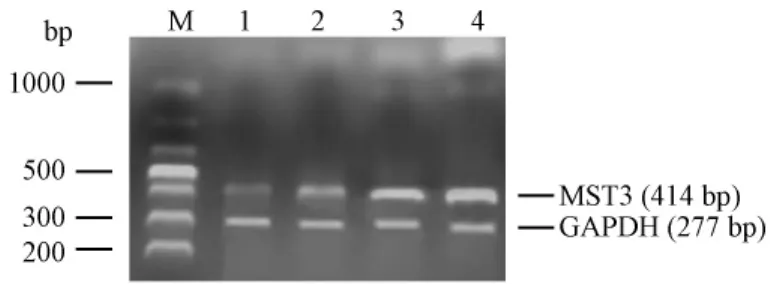
注:M:蛋白质分子量标准;1:PBS对照组;2:模型组 3 h;3:模型组 8 h;4:模型组 24 h。图1 正常对照和癫痫实验模型MST3的mRNA表达Note:M:Marker;1:PBS control group;2:Experimental group 3 h;3:Experimental group 8 h;4:Experimental group 24 h.Fig.1 Expression of MST3 mRNA in the mice of PBS control and experimental groups
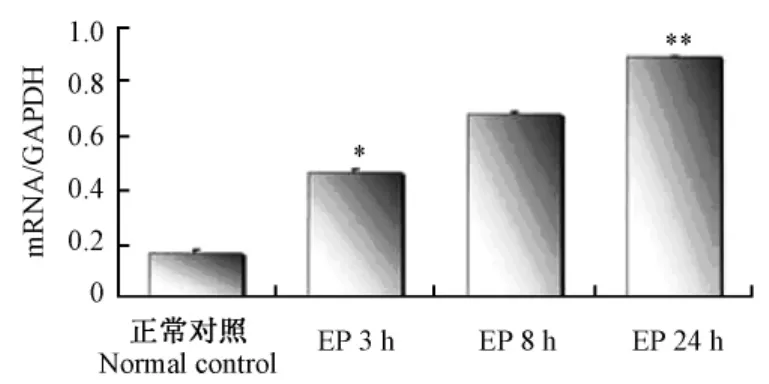
图2 正常对照和癫痫实验模型MST3的mRNA表达Fig.2 Expression of MST3 mRNA in the mice of PBS control and experimental groups
2.3 注射KA后MST3蛋白表达变化
与正常对照组相比,侧脑室注射KA后,海马组织的MST3蛋白表达在3、8、24 h的表达均有升高,且呈现时间递增关系,24 h达到最高峰,具有显著性意义(见表 1;图 3,4)。
2.4 MST3在海马的组织表达特点
MST3在正常对照组小鼠海马各区的表达不明显,但MST3在癫痫模型中主要表达分布于海马神经元胞质内,各区反应强度不等,以齿状回和 CA3区最明显,其次为门区,CA1区也有少量表达。这些MST阳性细胞胞体中等大小,形态不规则,自胞体向四周发出多个短而粗大的突起,胞质着色均匀,突起也着色,胞核未着色(见图5,封底)。
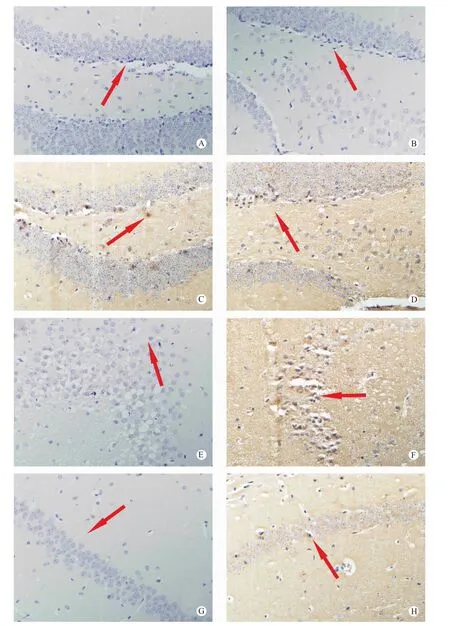
注:A. PBS正常对照齿状回;B. PBS正常对照门区;C. 模型齿状回;D. 模型门区;E. PBS正常对照CA3区;F. 模型CA3区;G. PBS 正常对照CA1区;H. 模型CA1区。图5 正常对照和癫痫实验模型MST3的免疫组织化学染色Note: A. Dentate gyrus, PBS control group; B. Hilus, PBS control group; C. Dentate gyrus, experimental group; D. Hilus, experimental group; E. CA3 area, PBS control group; F. CA3 area, experimental group; G. CA1 area, PBS control group; H.CA1 area, experimental group.Fig.5 Expression of MST3 protein in the mice of PBS control and experimental groups. Immunohistochemical staining
3 讨论
本实验研究了KA致颞叶癫痫模型中MST3在海马海马神经元中的表达特点、海马CA1、CA3等不同区域的表达特点,以及在癫痫模型中不同时间段的动态表达规律。我们的研究结果发现,MST3在正常对照组小鼠海马各区的表达不明显,但MST3在癫痫模型中主要表达分布于海马神经元胞质内。说明MST3与神经元之间有一定的关系。MST3在癫痫模型中海马各区表达量也有不同,以齿状回和CA3区最为明显,提示MST3与该区域的神经元之间互动作用可能更加明显。同时我们也观察到,MST3在3 h,8 h,24 h基因、蛋白水平表达呈现明显的增加趋势。说明随着癫痫发作过程中,在脑损伤程度增加情况下,MST的表达也随之增加。但是在这个过程中,到底是起到什么作用仍然需要进一步论证和研究。
癫痫是由大脑神经元反复过度放电引起的发作性、突然性、短暂性的大脑功能障碍,在癫痫发作过程中,正是这种损害发作诱导了神经细胞凋亡的发生,造成了神经细胞的死亡[4,5]。1994 年,Pollard等[6]首次报道了大鼠一侧杏仁核注射海人酸(kainic acid,KA)致痫后4~48 h神经元凋亡的变化。他们发现,癫痫发作后24 h,海马 CA3和 CA4区出现大量凋亡神经元,其中CA3区锥体层在24 h和48 h各有30%和60%的细胞呈现TUNEL阳性染色,而CA1区仅有少量阳性染色。另有研究提示,在癫痫过程中,与凋亡相关的各种基因在此过程也有明显的变化,如立早基因(immediate early genes,IEGS)、p53 基因及 bcl-2 基因家族等[5,7]。另有一些报道证实了MST家族在细胞生长和凋亡中起重要的作用。
Mammalian sterile 20-like kinase 3(MST3)是哺乳动物STE20丝氨酸/苏氨酸蛋白激酶家族成员之一,分子量50×103。STE20家族包括 PAK和 GCK两个亚族,MST1和 MST2属于 GCK II,MST3和MST4属于 GCK III[8]。先前已有研究结果证实了MST1和 MST2在细胞生长方面起到重要的作用[8,9]。在后继的研究中发现,MST1 在神经细胞凋亡中起了重要的作用[10]。包括新近一项研究阐明了c-Abl-MST1信号通路可能参与了神经退行性疾病的病理过程,说明有关 c-Abl-MST1信号通路介导的氧化压力在神经细胞凋亡中起到较为重要的作用[11]。MST3与MST1在促进细胞凋亡有着类似之处,可能主要通过被caspase酶切激活后促进细胞凋亡[12,13],相关研究也主要证明了 MST3在氧化压力及缺氧条件诱导的人滋养体细胞凋亡过程中的作用[14,15]。而我们的研究结果发现,随着脑损伤程度的增加,MST3的表达量也呈现线性增加。这个结果提示,MST3在癫痫发病过程中,在介导海马神经元凋亡过程中,可能发挥积极的作用。
MST3与癫痫发作神经细胞凋亡关系密切相关,甚至在神经元的分化、成熟、维持可能有一定作用关系,因此MTS的表达在癫痫形成及癫痫所致的脑组织损伤有重要意义,而MST通过怎样的信号传导途径介导癫痫的发作,尤其是MST3在神经细胞凋亡中的具体作用以及分子机制仍有待进一步的研究和深入。
[1]Loscher W.Animal models of intractable epilepsy[J].Prog Neurobiol,1997,53(2):239 -258.
[2]Lee WS,Hsu CY,Wang PL,et al.Identification and characterization of the nuclear import and export signals of the mammalian Ste20-like protein kinase 3[J].FEBS Lett,2004,572(1 - 3):41-45.
[3]Chen CB,Nq JK,Choo PH,et al.Mammalian sterile 20-like kinase 3(MST3)mediates oxidative-stress-induced cell death by modulating JNK activation[J].Biosci Rep,2009,29(6):405-415.
[4]Chang BS,Lowenstein DH.Epilepsy[J].N Engl J Med,2003,349:1257-1266.
[5]David CH,Roger PS.Epilepsy and apoptosis pathways[J].2005,25(12):1557-1572.
[6]Pollard H,Cantagrel S,Charriaut-Mariangue C,et al.Apoptosis associated DNA fragmentation in epileptic brain damage[J].Neuroreport,1994,5(9):1053 -1055.
[7]陆晖,欧阳升,覃启京.癫痫发生与细胞凋亡及其调控基因相关性的研究进展[J].广西中医学院学报,2010,13(4):74-75.
[8]Ling P,Lu TJ,Yuan CJ,et al.Biosignaling of mammalian Ste20-related kinases[J].Cell Signalling,2008,20(7):1237-1247.
[9]Oh S,Lee D,Kim T,et al.Crucial role for Mst1 and Mst2 kinases in early embryonic development of the mouse[J].Mol Cell Biol,2009,29(23):6309-6320.
[10]Yuan Z,Lehtinen MK,Merlo P,et al.Regulation of neuronal cell death by MST1-FOXO1 signaling[J].J Biol Chem,2009,284(17):11285-11292.
[11]Xiao L,Chen D,Hu P,et al.The c-Abl-MST1 signaling pathway mediates oxidative stress-induced neuronal cell death[J].J Neurosci,2011,31(26):9611 -9619.
[12]Huang CY,Wu YM,Hsu CY,et al.Caspase activation of mammalian sterile 20-like kinase 3(Mst3):nuclear translocation and induction of apoptosis[J].J Biol Chem,2002,277(37):34367-74.
[13]Lin CY,Wu HY,Wang PL,et al.Mammalian Ste20-like protein kinase 3 induces a caspase-independent apoptotic pathway[J].Int J Biochem Cell Biol,2010,42(1):98 - 105.
[14]Wu HY,Lin CY,Lin TY,et al.Mammalian Ste20-like protein kinase 3 mediates trophoblast apoptosis in spontaneous delivery[J].Apoptosis,2008,13(2):283 -294.
[15]Wu HY,Lin CY,Chen TC,et al.Mammalian Ste20-like protein kinase 3 plays a role in hypoxia-induced apoptosis of trophoblast cell line 3A-sub-EInt[J].J Biochem Cell Biol,2011,43(3):742-750.
