女性生殖道内β防御素类型与作用
2013-05-23白立恒宋伟奇游存厚杨治理曹贵方
白立恒 宋伟奇 游存厚 杨治理 曹贵方
1.内蒙古民族大学蒙医药学院,内蒙古通辽 028000;2.内蒙古自治区妇幼保健医院妇产科,内蒙古呼和浩特 010020;3.内蒙古农业大学生命学院,内蒙古呼和浩特 010018
自然界中,生长在充满各种环境中的植物、动物等物种都具有一套抵御外界细菌、病毒等微生物的侵害机制。在它们的体内、体表,都有参与机体最初防御作用的短肽类活性物质,这些物质具有很强的防御能力,被称为抗菌肽(antimicrobial peptides)。在 1965年,Hrish从兔的中性粒细胞(PMN)中首次提取出1种具有杀菌活性的阳离子蛋白,称之为“吞噬素”。而后Zeya HI等[1-2]在豚鼠和老鼠的PMN的胞质颗粒中同样发现了一种阳离子蛋白,富含半胱氨酸和精氨酸,称为“溶酶体阳离子蛋白”。在20世纪80年代中期,美国加里福尼亚大学学者在研究吞噬细胞的非依赖氧杀菌机制过程中,从人和兔中性粒细胞的胞浆颗粒中发现一种其一级结构十分相似的一系列小分子阳离子肽,由于这些小分子肽具有广谱的抗微生物活性[3],所以首次命名这类肽为御素(defensins)。1989年,法国Hoffmann JA等[4]在昆虫体内分离出一种防御素,与兔肺部内吞噬细胞中防御素分子同源。到目前为止,已在多种生物中发现了200多种防御素分子[5],可以说防御素家族是一个最大的内源性抗菌肽家族。
1 β-防御素的发现、分布、分子特征
1.1 β-防御素的发现、分布
β-防御素是Diamond G等[6]在牛的气管黏膜上皮细胞中发现,之后在牛的中性粒细胞中发现了13种与其序列高度相似防御素,由于与α-防御素结构不同,故被命名为β-防御素。β-防御素存在于人类的血浆、牛的气管上皮、中性粒细胞和骨髓、禽类的白细胞和人及多种动物的舌、牙龈、胃肠道、呼吸道、泌尿生殖道、皮肤、肾的上皮细胞中[7-9]。已发现的人类β-防御素有4种,即HBD-1~HBD-4。HBD-1在肾脏、阴道[10]、胰腺腺泡、唾液腺导管[11]等上皮细胞及腮腺、下颌腺、齿龈、口腔黏膜、舌中有表达[12-13]。据报道,在人正常的扁桃体内也可检测到HBD-1的存在。而HBD-2是从患牛皮癣患者的皮肤中分离出来的,并且在人类的血浆、唾液、皮肤、以及泌尿生殖道等存在。在上皮组织感染过程中可以被诱导表达。HBD-3主要在人的呼吸道上皮细胞和角化细胞内有表达[14],也分布于口腔黏膜、食道、气管、骨骼肌、心脏、胎盘、和皮肤[15]中。HBD-4在子宫、睾丸、肺、甲状腺、肾脏感染过程中可被诱导并微量表达。
1.2 β-防御素分子特征
β-防御素分子内有6个保守的半胱氨酸,并由38~42个氨基酸组成。β-防御素的保守序列为-------C---GC------C-----QIG-C------CCR-。6个半胱氨酸残基配对形成3个二硫键,连接方式为:Cys1-Cys5、Cys2-Cys4、Cys3-Cys6[14]。β-防御素内二硫键为了防止蛋白酶的水解可以使小分子防御素紧密联结,所以在富含有蛋白酶的吞噬溶酶体的微环境中仍可以保持其稳定特性,这也是防御素有别于其他抗菌肽的主要特征之一[16]。β-防御素序列中部有一个保守的脯氨酸和一个甘氨酸,这是α-防御素所不具有的。β-防御素分子量相对较小,而且具有明显的半胱氨酸排列的特征,对维持此类分子的三级结构具有重要意义[17-18]。
1.3 β-防御素基因结构分析
β-防御素前原肽分子由64~68个氨基酸残基组成,信号序列和前导序列22~32个氨基酸残基。β-防御素基因含有1个内含子和2个外显子,第1个外显子编码5′端非翻译区及前体肽功能团,第2个外显子编码3′端非翻译区和成熟肽(图1)。在人β-防御素中,HBD-1中有一个内含子和两个相对较小的外显子,第一个外显子编码信号肽和前原片段,第二个则编码成熟肽。HBD-2中也为一个内含子和两个外显子,第一个外显子编码信号肽,另一个编码成熟肽和原片段。HBD-3的基因位于与其同向转录的HBD-2的基因上游约13 kb处,已有两个外显子:一个约4.5 kb的内含子将HBD-4基因的两个外显子分隔,一个外显子编码大部分信号肽序列,信号肽的剩余部分加原片段和成熟肽则由另一个外显子所编码。TAP也是一种β-防御素,基因结构分析显示有两个外显子,有一个116 kb的内含子在插在两个外显子之间,其中外显子1编码其前体分子的信号序列和部分前区序列,外显子2编码部分前区序列和整个成熟肽序列。
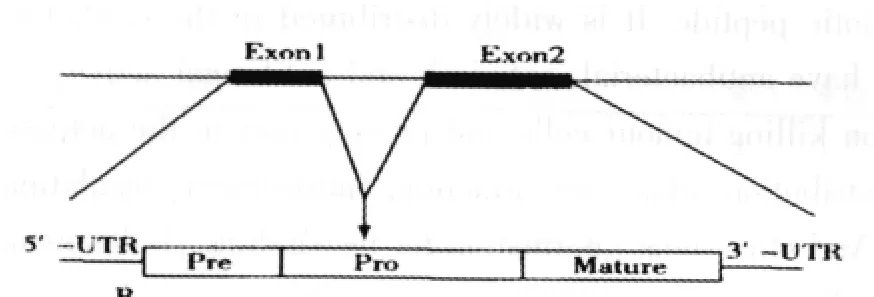
图1 β-防御素cDNA序列示意图Fig.1 The cDNA of β-defensins
β-防御素的表达形式既有组成型的,又有诱导型的。在人的4种β-防御素中,β-防御素1在上皮细胞中为组成型表达,另外三种β-防御素除组成型的基础表达外,还能够被诱导表达。例如:β-防御素2的表达可以被TNF-α、LPS、IL-1β及细菌等多种原炎剂所诱导;β-防御素3的表达可被 IL-1β、IFNγ、TNF-α 及细菌所诱导;β-防御素 4的表达可被豆蔻酰佛波醇乙酯所诱导。
2 人女性生殖道内β-防御素
近年来,众多研究结果表明,在女性生殖道内广泛分布着人防御素,与女性天然免疫的防御机制有密切关系。对保证女性生殖系统在正常状态下维持生殖健康,抵抗各种外源病菌感染起重要的作用。正常情况下,女性阴道内存在多种微生物,这些微生物维持生殖道生理状态而不致发生感染,除了宫颈黏液栓屏障、阴道酸碱度等自净作用外,子宫内膜、宫颈、阴道广泛分布的防御素也同样起到重要作用。
2.1 女性生殖道内人β-防御素存在位置
Valore EV等[19]研究证实,HBD-1在输卵管子、宫内膜、宫颈、阴道及泌尿系统的肾脏、尿道等均有表达,对大肠埃希菌等微生物均有杀灭作用,提出HBD-1是女性泌尿生殖道重要的先天免疫防御因子,对泌尿生殖道局部抗菌防御起重要作用。King AE等[20]研究结果表明,不同的β-防御素在女性生殖道不同状态下表达不同。在子宫内膜和内膜细胞株,HBD-1呈低水平表达;在分泌期的内膜,HBD-3表达水平最高;在增生期内膜,HBD-4表达水平最高,而HBD-2呈高水平表达。Grable IA等[21]研究结果同样证明,子宫内膜中HBD-1~4都有表达。Fleming DC等[22]研究结果发现,在子宫内膜中,HBD-1、HBD-2不同周期中变化不一,在分泌中期的子宫内膜中HBD-1表达水平最高;在月经期的子宫内膜中HBD-2表达水平最高。采用定量PCR和免疫组化方法,进一步研究避孕方法、避孕药对女性生殖道人防御素表达的影响,结果表明,未避孕、口服避孕药、放置左旋诺孕酮(levonorgestrel)宫内节育器的妇女,HBD-1、HBD-2在子宫内膜的都有表达,使用口服避孕药、放置左旋诺孕酮宫内节孕器,HBD-1、HBD-2的表达水平均呈下降趋势,提出甾体类激素可以影响HBD-1,HBD-2在子宫内膜的基因转录。在体外实验中,Pivarcsi DC等也同样发现,结合型口服避孕药可调控HBD-3、HBD-4的表达水平。冯艳等[23]研究了人HBD-2防御素基因在女性生殖道及妊娠相关组织中的表达状况,结果证明,正常女性卵巢、输卵管、子宫内膜、子宫颈、阴道5种组织中都有HBD-1 mRNA水平的表达。除卵巢、阴道外,其余3种组织中也都有HBD-2 mRNA的表达,脐带、胎盘、羊膜、绒毛膜、绒毛5种妊娠相关组织中,除羊膜外,HBD-1 mRNA在各组织中均有表达,而在绒毛膜、绒毛及胎盘组织中,HBD-2 mRNA有表达。Svinarich报道,用RT-PCR研究发现,人的子宫内膜、宫颈内膜和绒毛膜细胞株在转录水平表达HD5,因而认为防御素是女性生殖器官抗感染的机制之一。由此看来,人防御素HBD-1~4在女性生殖道的输卵管、子宫、子宫颈、引导各段的表达都存在。
2.2 人β防御在生殖道中存在的意义与作用
β防御具有多种功效,在生殖道感染、免疫、胎儿正常发育等具有重要作用。
2.2.1 β防御的抗菌、抗病毒等作用 Akinbi等研究结果证实,羊水、胎膜中含有HBD-2,并具有抗真菌、细菌的活性。Valore等研究结果同样证实,HBD-1在女性生殖道广泛存在,甚至在尿中也存在HBD-1,具有杀灭大肠埃希菌的作用。Buhimschi等在培养的羊膜上皮细胞中,也发现了HBD-1~4,其中HBD-3表达水平最高。进一步研究证明羊膜细胞HBD-1~4的表达水平可以被微生物所诱导上调。提出了防御素在保护胎儿的防御机制中有重要作用的论点。King等研究结果也证实在胎盘中有HBD-3表达,IL-1可诱导胎盘中有HBD-3的表达。Grable IA等[21]研究了正常孕妇、胎膜早破孕妇人防御素水平差异,结果极显著(正常孕妇668 ng/mL,胎膜早破孕妇 5665 ng/mL,P<0.01),无绒毛膜炎与有绒毛膜炎相比较,差异也同样显著(无绒毛膜炎孕妇520 ng/mL,有绒毛膜炎孕妇9163 ng/mL,P<0.01)。吕晓杰等[24]研究认为,人HBD-1在健康妇女、生殖道感染妇女的生殖道中都有较弱表达,表达量与感染无关,而HBD-2则广泛表达,表达量和生殖道感染密切相关。由此看来,β防御与抗感染有一定关系。
2.2.2 β防御的免疫作用 研究表明,HBD-2在天然免疫和获得免疫中均起着重要的作用,在正常子宫内膜组织中,可能在维系正常生殖道的黏膜防御中起着重要的作用。陈淑琴等[25]研究了子宫内膜异位症患者在位和异位内膜组织中人β防御素-2的表达,结果证实,异位内膜组内膜组织中HBD-2的基因表达水平显著高于在位内膜组和对照组。在位内膜组和对照组子宫内膜组织中HBD-2的基因表达水平,差异无统计学意义。异位内膜组中,HBD-2临床分期表达为Ⅰ期高于Ⅲ期和Ⅳ期、Ⅱ期高于Ⅲ期和Ⅳ期,差异有统计学意义。推测,异位内膜组织中HBD-2的高表达可能参与了内异症的发病。HBD-2通过CCR6受体,吸引记忆性T细胞、不成熟树突状细胞进入到炎症部位,进而活化细胞免疫、体液免疫系统,最终杀死、清除病菌。Brogden KA等发现HBD-2能够促进相关细IL-12、IFN-γ等抗病毒免疫因子,同时激助细胞和细胞毒性T细胞(CTL),此外,HHNP-1还能够提高小鼠体内的IgG水平[26]。
2.3 生殖道内β防御素的调控
生殖道内的β防御表达除受到一些细菌成分,如LPS影响外,还可能受到药物、激素等影响。
2.3.1 LPS等细菌成分、细胞因子等对β防御素的诱导作用 研究表明,脂多糖(LPS)具有促进上皮细胞β防御表达作用。King AE等[20]研究证实,炎性介质如TNF-α、ITF-γ、IL-1等可使子宫内膜上皮细胞株中HBD-2 mRNA表达水平有增加的趋势,证实LPS、LTA能诱导人防御素的表达。在以上因子的参与下,原代子宫内膜细胞中HBD-3表达水平上调,对HBD-4表达无影响。此外,PGN、灭活的白色念珠菌、酵母多糖等刺激,均可上调阴道上皮细胞中HBD-2的表达水平。粘病毒抗性基因1可分别上调HBD-1和HBD-2的表达水平6和4倍。上述研究结果表明,存在于女性生殖道的防御素等的天然防御分子,在感染过程中能被细胞因子及免疫调节因子大量诱导上调,参与抗微生物活动。
2.3.2 药物、激素等对生殖道内β防御素表达影响 Han等[17]研究报道,更年期雌激素缺乏或口服孕激素类避孕药的女性可能会影响阴道上皮细胞生产HBD-2。Fleming DC等[22]研究避孕药、甾体类激素能够影响人防御素1~2在子宫内膜的基因转录。Pivarcsi等证明体外实验中,结合型口服避孕药可上调影响防御素3~4的表达水平。Wen Shiyong等[27]研究动物(绵羊)的输卵管、子宫、阴道的绵羊防御素受到孕激素、雌激素的促进作用是通过其受体来实现的。由此说明,药物、激素等对生殖道内β防御素表达都有影响。
[1]Zeya HI,Spitznagel JK.Cationic proteins of polymorphonuclear leukocyte lysosomesⅡ.Composition,properties,and mechanism of antibacterial action[J].J Bacteriol,1966,91:755-762.
[2]Zeya HI,Spitznagel JK.Cationic proteins of polymorphonuclear leukocyte lysosomes I.Resolution of antibacterial and enzymatic activities[J].J Bacteriol,1966,91:750-754.
[3]Ganz T,Selsted ME,Szklarek D,et al.Defensins:natural peptide antibiotics of human neutrophils[J].J Clin lnvest,1985,76:1427-1435.
[4]Hoffmann JA,Hetru C.Insect defensins:inducible antibacterial peptides[J].Immunol Today,1992,13:411-415.
[5]Tran D,Tran PA,Tanq YQ,et al.Homodimeric theta-defensins from rhesus macaque leukocytes:isolation,synthesis,antimicrobial activities,and bacterial binding properties of thecyclic pep tides[J].Biochemistry,2002,277(5):3079-3084.
[6]Diamond G,Zasloff M,Eck H,et al.Tracheal Antimicrobial Peptide,a Novel Cysteine-rich Peptide from Mammalian Tracheal Nucosa:Peptide Isolation and Cloning of cDNA[J].Pro Natl Acad Sci USA,1991,88(10):3952-3956.
[7]Rivas-Santiago B,Sada E,Tsutsumi V,et al.Beta-defensin gene expression during the course of expremental buerculosis infection[J].J Infect Dis,2006,194(5):697-701.
[8]杨银凤,唐博.β-防御素caBD-1 mRNA在骆驼组织器官中的表达[J].中国兽医科技,2004,11(34):3-6.
[9]吴萨日娜,赵艳芳,杨银凤.驯鹿β-防御素-1(raBD-1)mRNA在驯鹿组织器官中的表达检测[J].中国草食动物,2006,26(6):23-25.
[10]Valore EV,Park CH,Quayle AJ,et al.Human beta-defensin-1:an antimicrobial peptide of urogenital tissues[J].J Clin Invest,1998,101:1633-1642.
[11]Zhao CQ,Wang I,Lehrer RI.Widespread expression of beta-defensin HBD-1 in human secretory glands and epithelial cells[J].FEBS Letters,1996,396:319-322.
[12]Krisanaprakornkit S,Weinberg A,Perez CN,et al.Expression of the peptideantibiotichumanbeta-defensin-1inculturedgingivalepithelial cells and gingival tissue[J].Infection and Immunity,1998,66:4222-4228.
[13]Mathews M,Jia HP,Guthmiller JM,et al.Production of beta-defensin antimicrobial peptides by oral mucosa and salivary glands[J].Infection and Immunity,1999,67:2740-2745.
[14]Harder J,Bartels J,Christophers E,et al.Isolation and characterization of human beta-defensin-3,a novel human inducible peptide antibiotic[J].The Journal of Biological Chemistry,2001,276(8):5707-5713.
[15]Jia HP,Schutte BC,Schudy A,et al.Discovery of new human betadefensin using a genomics based approach[J].Gene,2001,263:211-218.
[16]Lichenstein AK,Ganz T,Seleted ME,et al.Defensins[J].Cell Immunol,1998,114:104-116.
[17]Et han D,Stolzenberg G,Mark A,et al.Epit helial antibiotic induced in states of disease[J].Proc Natl Acad Sci,1997,94(16):8686-8690.[18]Torres AM,Kuchel PW.β-defensin fensin fold family of polypeptides[J].Toxicon,2004,44(6):581-588.
[19]Valore EV,Park CH,Quayle AJ,et al.Human beta-defensin-1:an antimicrobial peptide of urogenital tissues[J].J Clin Invest,1998,101:1633-1642.
[20]King AE,Fleming DC,Critchley HO,et al.Differential expression of the naturalantimicrobials,beta-defensins3 and 4,in human endome trium[J].J Reprod Immuno,2003,59(1):1-16.
[21]Grable IA,Heine RP.Neutrophil granule products:can they identify subclinical chorioamnionitis in patients with preterm premature rupture ofmembranes[J].Am J Obstet Gyneco,2003,189(3):808-812.
[22]Fleming DC,King AE,Williams AR,et al.Hormonal contraception can suppress natural antimicrobial gene transcription in human endometrium[J].FertilSteri,2003,79(4):856-863.
[23]冯艳,潘小玲,黄宁,等.人β-防御素基因在女性生殖道及妊娠相关组织中的表达[J].四川大学学报(医学版),2003,34(2):217-219.
[24]吕晓杰,韩淑梅,乐杰.人防御素与女性生殖系统免疫防御[J].中国妇幼健康研究,2006,17(1):45-48.
[25]陈淑琴,刘克玄,牛刚,等.子宫内膜异位症患者在位和异位内膜组织中人 β 防御素-2的表达[J].中山大学学报,2009,30(6):747-752.
[26]隋鹏诺,刘永娟.人防御素作用的相关研究[J].内江科技,2011,32(3):48-49.
[27]Wen Shiyong,CAO Guifang,Bao Tuya,et al.Modulation of ovine SBD-1 expression by 17beta-estradiol in ovine oviduct epithelial cells[J].BMC Veterinary Research,2012,8(1):143.
