芦丁锗的合成、表征及生物活性研究
2013-05-17翟广玉渠文涛闫影影王素红王敬萍
翟广玉 ,渠文涛,朱 玮,闫影影,王素红,王敬萍
1郑州大学护理学院;2郑州大学药学院,郑州450052
芦丁是具有多种生物学活性的黄酮类化合物,广泛存在于水果、蔬菜、饮料及中草药中,如番茄、枣、杏、荞麦、咖啡、啤酒及槐米等。研究表明,芦丁具有抗氧化、抗炎、抗菌、抗肿瘤、扩张血管等多种生物学活性[1]。临床上用于治疗过敏性紫癜及各种因毛细血管脆性增加而引起的出血性疾病,也用于治疗高血压和老年气管炎等[2]。芦丁分子中具有强配位氧原子与合适的空间构型,是一种良好的金属离子螯合剂[3,4]。生物活性研究显示,芦丁与金属离子形成配合物后,药效强于芦丁[5,6]。芦丁金属配合物的研究是近年来国内外研究的热点。
按照中药配位化合理论,有机成分与微量元素组成的配合物,比纯有机分子或微量元素更全面地反映中药的物质基础,代表中药活性作用的核心[7]。锗是具有重要生理活性的微量元素之一,有机锗具有调节免疫和造血机能、清除自由基、抗癌变、消炎等多重功效。文献对芦丁锗配合物的报道较少,且抗肿瘤活性研究未见报道。作者利用芦丁与氧化锗在碱性条件下反应合成了芦丁锗配合物,并提出了该化合物可能的结构,其结构经 UV、IR、1H NMR以及差热分析等确证。并分别采用DPPH法和MTT法,评价了芦丁锗配合物的清除自由基活性及抗肿瘤活性。

图1 芦丁的化学结构Fig.1 Chemical structure of rutin
1 实验部分
1.1 试剂与仪器
试剂:芦丁(纯度>95%,河南平舆馨星生化有限公司);氧化锗(分析纯);二苯基苦基肼(DPPH·)(上海晶纯试剂有限公司);RPMI 1640培养基(Hy-Clone,北京赛默飞世尔生物化学制品有限公司);青霉素、链霉素(HyClone,SH40003-12);胎牛血清(无噬菌体,低内毒素,杭州四季青生物工程材料有限公司);胰蛋白酶(吉诺生物医药技术有限公司);二甲基亚砜(DMSO,Sigma公司);四甲基偶氮唑蓝(MTT,Sigma公司)。其他试剂均为分析纯。
细胞株:Hela(人子宫颈癌细胞)、SPC-A-1(人肺腺癌细胞)、EC9706(人食管癌细胞)与PC-3(人前列腺癌细胞)购自中国科学院上海生命科学研究院细胞库。
仪器:FTS-3000型红外光谱仪(KBr压片);Perkin-400CHN型元素分析仪;UV-2550型紫外-可见分光光度计(日本岛津公司);STA 409 PC/PG差热分析仪[德国耐驰(Netzsch)];RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂)。CJ-2F超净工作台(苏州冯氏实验动物设备有限公司);二氧化碳培养箱(美国SIM公司);倒置显微镜(德国莱卡公司);Spectra Mr型全波长酶标仪(美国DYNEX公司)。
1.2 芦丁锗的制备
参照文献[8]的方法并进行了改进。取1 mmol(610 mg)芦丁,加入25 mL甲醇,搅拌使完全溶解。加入预先配好的GeO2(1 mmol 108.5 mg)的甲醇溶液25 mL,加热、搅拌使完全溶解,用甲醇钠调节pH=8.5~9.0。于带有搅拌器和冷凝管的三口烧瓶中,回流6 h。用薄层板监控反应进程,待反应结束后蒸馏出2/3溶剂。利用聚酰胺层析柱,用甲醇/水溶液梯度洗脱,收集设定区间洗脱液,旋转蒸发仪蒸干有机溶剂得棕黄色固体,用甲醇重提,得深棕黄色固体,真空干燥。
1.3 芦丁锗对Hela细胞、SPC-A-1细胞和EC9706细胞增殖的影响
芦丁锗用DSMO溶解,用灭菌水配制成10 mmol/L的原药贮存液,4℃保存,临用时以RPMI 1640培养基稀释,0.22μm微孔滤膜过滤。
分别取处于对数生长期的上述细胞,调整细胞浓度为约6×103个/每孔,接种于96孔板中,每孔200μL,体积分数5%CO2、37℃、饱和湿度孵育箱中培养。待细胞贴壁后,吸弃培养液后,实验组加入RPMI 1640培养基稀释的芦丁锗至终浓度分别10、100μmol/L,溶剂对照组加入完全培养基,每孔终体积为200μL,每组设6个复孔。培养72 h后取出培养板,倒置显微镜下形态学观察并照相。再加入5 g/LMTT 20μL/孔继续培养4 h,吸弃上清液后加入DMSO 150μL/孔,震荡10 min,使结晶充分溶解后,酶联免疫检测仪570 nm波长处各孔光密度值(OD值),记录结果。细胞生长抑制率(GI)按以下公式计算:
GI=1-(药物组OD值/对照组OD值)×100%
1.4 清除DPPH自由基实验
溶液的配制:1×10-4mol/L的DPPH·溶液的配制:精密称取10 mg DPPH·,置于250 mL容量瓶中,加入少量无水乙醇,待溶解后再用无水乙醇定容至刻度,混匀,避光,置于冰箱保存。
供试液的配制:精密取各样品适量,以乙醇为溶剂,分别配制 100、80、60、40、20 mg/L 的待测溶液。
参照文献[9]方法,有所改进,精确吸取不同浓度的样品溶液1 mL,分别与3 mL 1×10-4mol/L的DPPH·溶液混合,避光放置30 min,在517 nm处测吸光度Ay。以相应溶剂代替样品作为空白对照,吸光度为As,相应样品溶液的吸光度为A0。DPPH·自由基清除活性按下式计算:

Ay–1mL样品溶液与3mLDPPH·溶液混匀后的吸光度值
As–1 mL乙醇溶液与3 mLDPPH·溶液混匀后的吸光度值
A0–1 mL样品溶液与3 mL乙醇溶液混匀后的吸光度值
[9]计算自由基半数清除率。
2 结果与讨论
2.1 紫外光谱分析
芦丁在359 nm和257 nm处有两个吸收峰,分别属于π→ π*(B环)电子跃迁,和n→ π*(A环)电子跃迁,分别对应两个生色团:359 nm吸收带由肉桂酰生色团产生,为Ⅰ带;257 nm吸收带由苯甲酰生色团产生,为Ⅱ带。

图2 芦丁的紫外光谱特征Fig.2 UV-visible absorption spectrum of rutin
当芦丁与锗形成配合物后,由于锗的作用使峰带Ⅰ向红移至385 nm,红移了26 nm,而峰带Ⅱ向红移至270 nm。由于金属离子与芦丁螯合成环,使体系内共轭体系增加,电子跃迁需要的能量较低,紫外吸收光谱向波长较长的方向移动。芦丁锗的UV红移说明了配合物的形成。

图3 芦丁和芦丁锗的紫外光谱Fig.3 UV-visible absorption spectrum of rutin and the rutin-Ge complex
2.2 红外光谱分析
红外吸收光谱是经过红外光照射的化合物分子吸收部分红外光后,产生分子振动和转动能级的跃迁而形成的分子吸收光谱。红外光谱是对分子结构的客观反映,图谱中的吸收峰都对应着分子中化学键或者基团的各种振动,因此,每种化合物都有其特征的红外光谱图。
芦丁分子主要官能团红外吸收峰分别是:υC=O1655.03 cm-1;苯环骨架振动频率 υC=C1603.69 cm-1,1504.96 cm-1;羟基 υ-OH3423.42 cm-1,υC-OH1361.52 cm-1[10]。
芦丁锗的IR分别是:υC=O1651.80 cm-1;苯环骨架振动频率 υC=C1566.20 cm-1,1488.04 cm-1;羟基υ-OH3405.23cm-1。υC-OH1305.51 cm-1。芦 丁 在1655.03 cm-1处有明显的羰基(C=O)伸缩振动强吸收峰,而芦丁锗的吸收峰是1651.80 cm-1,这是由于芦丁与锗形成配位键后,使C=O键减弱,故相应吸收峰向低波数区位移。643.10 cm-1处有强吸收峰,这是Ge-O金属键的特征吸收峰。这进一步证明在芦丁锗中有金属键生成。
2.3 芦丁锗的氢谱
1H NMR谱是鉴定黄酮化合物的结构类型、确定取代基的位置和进行结构研究的有效方法。氢谱可以提供有关分子中不同种类氢原子的情况,如根据化学位移和偶合常数可以判断有关氢原子的化学环境,每种不同环境下氢原子的数目以及每个氢原子相邻的基团的结构等。
1H NMR谱中氢原子的归属。芦丁的氢谱:12.60(5-OH),10.82(7-OH),9.68(4'-OH),9.42(3'-OH),7.55(2'-H,5'-H,6'-H),6.87(8-H),6.40(6-H)[11]。芦丁锗的氢谱:12.77(5-OH),8.50(3'-OH),7.46(2'-H),7.27(5'-H),7.07(6'-H),6.47(8-H),6.35(6-H)。芦丁锗中 7-OH和4'-OH的氢消失,说明在此生成了新的化学环境。结合UV和IR图谱,锗离子很可能在这两个位置形成了配位键。结合UV、IR、1H NMR分析,推测芦丁锗可能具有如下结构:
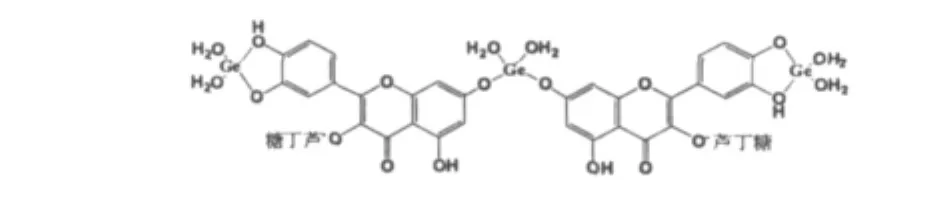
图4 芦丁锗的结构Fig.4 Structure of the rutin-Ge complex
2.4 芦丁锗的热分析
近年来,热分析技术已经在药物分析领域里有了广泛的应用。通过加热化合物可引起其物理化学变化,伴随放热和吸热的产生以及质量的变化。而通过热重分析,可以了解配合物的稳定性与结构。在静态空气气氛,升温速度为10℃/min,差热量程为100μV,测定温度范围从室温到700℃。

图5 芦丁锗的TGFig.5 TG of the rutin-Ge complex
芦丁锗受热过程中分为四个失重阶段。首先,在30~256℃,TG曲线有个失重台阶,失重率为16.07%,对应于DSC上91.7℃出现一个小的吸热峰,说明了芦丁锗分子结构中配位水的存在。从256℃开始,TG曲线又呈现出一个失重台阶,失重率为18.13%,对应DSC上323.2℃出现一个放热峰;从400℃到630℃,TG曲线陡峭,失重率为45.27%,对应DSC上496.8℃出现放热峰;这两个阶段是芦丁锗的分解,630℃以后,TG/DSC曲线趋于平稳,推测芦丁锗分解完全。至此,芦丁锗的总失重率为79.47%,由于加热过程在空气气氛中进行,因此最后残渣剩余量20.53%应为GeO2。由此可计算出芦丁锗中锗所占的百分比为14.25%。而根据图6所推测的分子结构,我们可以计算出锗的理论含量为14.12%。这进一步佐证了图6所推测的结构。

图6 芦丁锗的DSCFig.6 DSC of the rutin-Ge complex
2.5 芦丁锗体外清除DPPH自由基的作用
DPPH在有机溶剂中是一种稳定的自由基,其乙醇溶液在517 nm处有最大吸收,当有自由基清除剂存在时,由于DPPH自由基的单电子被配对,从而使得在517 nm处的吸光度减小,因此该法常被用来评价样品的抗氧化能力。从图9可见,芦丁和芦丁锗对DPPH自由基的清除活性均呈剂量依赖性,且芦丁锗对DPPH自由基的清除能力明显强于芦丁。根据实验结果,芦丁锗与芦丁的EC50分别是55.84 mg/L和58.95 mg/L,进一步说明芦丁在与锗配位后,其清除DPPH自由基能力增强,这可能与形成的配合物后,分子的共轭体系增大有关。

图7 芦丁锗对DPPH自由基的清除作用Fig.7 Scavenging effect of the rutin-Ge complex on DPPH radical
黄酮类化合物的抗氧化能力取决于其特殊的分子结构。芦丁的抗氧化活性主要归功于B环的3'-OH和4'-OH,可与锗配位形成稳定的五元环结构,由于配合物的共轭体系增大,更易于发生氧化还原反应,捕获自由基的电子,并提供H原子给DPPH,使其生成稳定的DPPHH,从而发挥抗氧化作用,氧化机理见图10。

图8 芦丁锗对DPPH自由基的清除作用机理Fig.8 DPPH radical scavengingmechanism of the rutin-Ge complex
2.6 抗肿瘤实验
采用MTT法测定芦丁锗的抗肿瘤活性,选取10 μM和100μM的芦丁锗分别作用于人子宫颈癌Hela细胞、肺癌SPC-A-1细胞、人食管癌EC9706细胞,考察其对癌细胞的增殖抑制作用。随着芦丁锗浓度的增加,与空白对照组相比,给药组细胞的形态变化不明显,细胞生长良好,具有肿瘤细胞的一般特征。结果表明,芦丁锗(100μM)对人子宫颈癌Hela细胞、肺癌SPC-A-1细胞、人食管癌EC9706细胞均无明显的抗肿瘤作用(P>0.01)。
3 结论
芦丁可以与氧化锗在碱性条件下形成芦丁锗配合物,通过核磁、紫外、红外图谱及差热分析,进一步论证了芦丁锗配合物的结构。清除自由基实验表明,芦丁锗较芦丁具有更好的活性。体外抗肿瘤活性实验表明,芦丁锗对 Hela细胞、SPC-A-1细胞、EC9706细胞的增殖均无明显抑制作用。
参考文献
1 Tian X,Li FJ,Zhu L,et al.Study on the electrochemical behavior of anticancer herbal drug rutin and its interaction with DNA.JElectroanal Chem,2008,621:1-6.
2 Viskupicova J,Danihelova M,Ondrejovic M,et al.Lipophilic rutin derivatives for anti-oxidant protection of oil-based foods.Food Chem,2010,123:45-50.
3 GhiasiM,Herav MM.Quantum mechanical study of antioxidative ability and antioxidative mechanism of rutin(vitamin P)in solution.Carbohydr Res,2011,346:739-744.
4 ZhaiGY(翟广玉),Xue HZ(薛华珍),Zhou Q(邹祺).Progress in the study of rutin complex.Chem Reag(化学试剂),2007,29:463-468.
5 Petkovic M,Vujacic A,Schiller J,et al.Application of flavonoids-quercetin and rutin-as new matrices formatrix-assisted laser desorption/ionization time-of-flightmass spectrometric analysis of Pt(II)and Pd(II)complexes.Rapid Comm Mass Spectrom,2009,23:1467-1475.
6 Dorota N,Anna K,Maria M.Solid complexes of iron(II)and iron(III)with rutin.Struc Chem,2010,21:323-330.
7 Chen TJ,Lin CH.Germanium:environmental pollution and health effects.Environ Sci Pollut Res Int,2011,2:927-933.
8 Dehghan G,Khoshkam Z.Tin(II)-quercetin complex:synthesis,spectral characterization and antioxidantactivity.Food Chem,2012,131:422-426.
9 FotiMC,Daquino C,DiLabio GA,etal.Kinetics of the oxidation of quercetin by 2,2-diph-enyl-1-picrylhydrazyl(dpph·).Org Lett,2011,13:4826-4829.
10 UivarosiV,Barbuceanu SF,Aldea V,etal.Synthesis,spectral and thermal studies of new rutin vanadyl complexes.Molecules,2010,15:1578-1589.
11 Ahmedova A,Paradowska K,Wawer I.1H,13C MAS NMR and DFT GIAO study of quercetin and its complex with Al(III)in solid state.J Inorg Biochem,2012,110:27-35.
