葛根素对慢性乙醇中毒大鼠多脑区阿片肽的调控作用*!
2013-05-16崔淑芹
崔淑芹
山东德州学院医学系,德州 253023
长期大量饮酒可导致慢性乙醇中毒,产生认知障碍、行为异常、精神异常和乙醇中毒性脑病等[1-3]。认知障碍是指因脑部功能受损而产生的学习记忆以及思维判断功能的异常。学习记忆是人和动物赖以生存的重要脑功能之一,学习记忆障碍是长期饮酒对人们生活健康影响最普遍和最严重的问题之一,目前认为最可能参与记忆痕迹形成的结构是小脑、海马、杏仁体和大脑皮层,其中海马在信息的获得和储存方面起着重要作用。研究表明,阿片肽、乙酰胆碱、γ-氨基丁酸(GABA)等多种中枢神经递质与学习记忆有关。本实验通过建立慢性乙醇中毒大鼠模型,采用放射免疫分析法系统检测慢性乙醇中毒及葛根素干预后大鼠皮层、海马、小脑和纹状体内阿片肽含量的变化,探讨葛根素对慢性乙醇中毒大鼠多脑区内源性阿片肽含量的调控作用,为临床治疗慢性乙醇中毒和开发中药葛根作为解酒药物提供实验基础。
1 材料与方法
1.1 材料
健康雄性SD大鼠24只(山东鲁抗医药股份有限公司),56%(V/V)白酒(北京怀柔红星股份有限公司生产),2%的注射用葛根素(山东瑞阳制药有限公司),β-内啡肽(β-EP)、亮脑啡肽(L-EK)和强啡肽 A(DnyA)放免试剂盒(第二军医大学神经生物学教研室)。
1.2 实验分组及方法
24只雄性SD大鼠随机分为对照组、慢性乙醇中毒组(乙醇组)和葛根素组,每组8只,自由进食。参照文献[4]制备动物模型。慢性乙醇中毒组:用56%(V/V)白酒灌胃,第1周每天6g/kg,1次灌胃,第2、3周每天12g/kg,1次灌胃,第4周每天15g/kg,分2次灌胃。葛根素组:白酒灌胃+葛根素腹腔注射,白酒剂量与慢性乙醇中毒组相同,葛根素剂量第1周为100mg/kg,第2、3周为150mg/kg,第4周为200mg/kg。对照组给予等容量生理盐水灌胃及腹腔注射。
1.3 标本检测
于实验第4周末次给药24h后,断头处死大鼠,立即取下鼠脑,在沸生理盐水中煮5min,分离皮层、小脑、海马和纹状体,准确称重,分别置于玻璃匀浆管内,加入1mol/L的 HAc 1mL,充分匀浆后转入到塑料试管中,室温放置100min。4℃,4 000 r/min离心20min,取上清加入1mol/L NaOH 1 mL,中和酸,按照试剂盒说明检测β-EP、DnyA和L-EK的含量。
1.4 统计学分析
应用统计软件 GraphPad Prism 4.0进行统计分析,β-EP、DnyA和L-EK的检测结果用±s表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 皮层、小脑、海马、纹状体β-EP的测定
从图1可以看出,慢性乙醇中毒组各脑区β-EP含量均低于对照组(均P<0.01),葛根素组各脑区β-EP较慢性乙醇中毒组升高(P<0.05,P<0.01)或有升高趋势(图1A),提示葛根素对慢性乙醇中毒大鼠脑内β-EP有调节作用。
2.2 皮层、小脑、海马、纹状体L-EK的测定
从图2可以看出,慢性乙醇中毒组各脑区LEK含量均高于对照组(均P<0.01),葛根素组各脑区L-EK较乙醇中毒组降低(均P<0.01),尤其是纹状体,该指标已接近对照组。提示,葛根素对慢性乙醇中毒大鼠脑内L-EK有抑制作用。

图1 皮层、小脑、海马和纹状体β-EP含量Fig.1 Contents ofβ-EP in the cortex,cerebellum,hippocampus and striatum
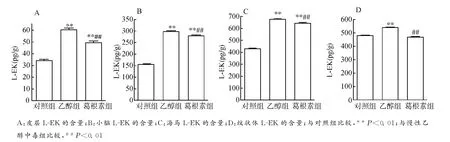
图2 皮层、小脑、海马和纹状体L-EK的含量Fig.2 Contents of L-EK in the cortex,cerebellum,hippocampus and striatum
2.3 皮层、小脑、海马、纹状体DnyA的测定
从图3可以看出,慢性乙醇中毒组各脑区DnyA含量均显著高于对照组(均P<0.01),葛根素组各脑区DnyA含量均较慢性乙醇中毒组明显降低(均P<0.01),在纹状体,该指标接近正常对照组。提示,葛根素对慢性乙醇中毒大鼠脑内DnyA有抑制作用。
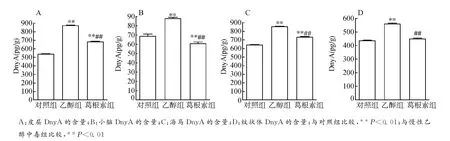
图3 皮层、小脑、海马和纹状体DnyA的含量Fig.3 Contents of DnyA in the cortex,cerebellum,hippocampus and striatum
2.4 葛根素对慢性乙醇中毒大鼠各脑区阿片肽调节幅度的比较
通过阿片肽相对值反映葛根素对慢性乙醇中毒大鼠各脑区阿片肽的调节幅度,阿片肽相对值(%)=(葛根素组阿片肽含量-慢性乙醇中毒组阿片肽含量)/慢性乙醇中毒组阿片肽含量×100%。从图4看出,葛根素对各脑区β-EP的调节幅度差异较大(图4A),调节幅度最小为4.57%,最大则高达38.00%;葛根素对L-EK的调节幅度较小,调节幅度最大的是皮层,为17.56%(图4B);葛根素对DnyA的调节幅度居中,各脑区差异较小(图4C)。
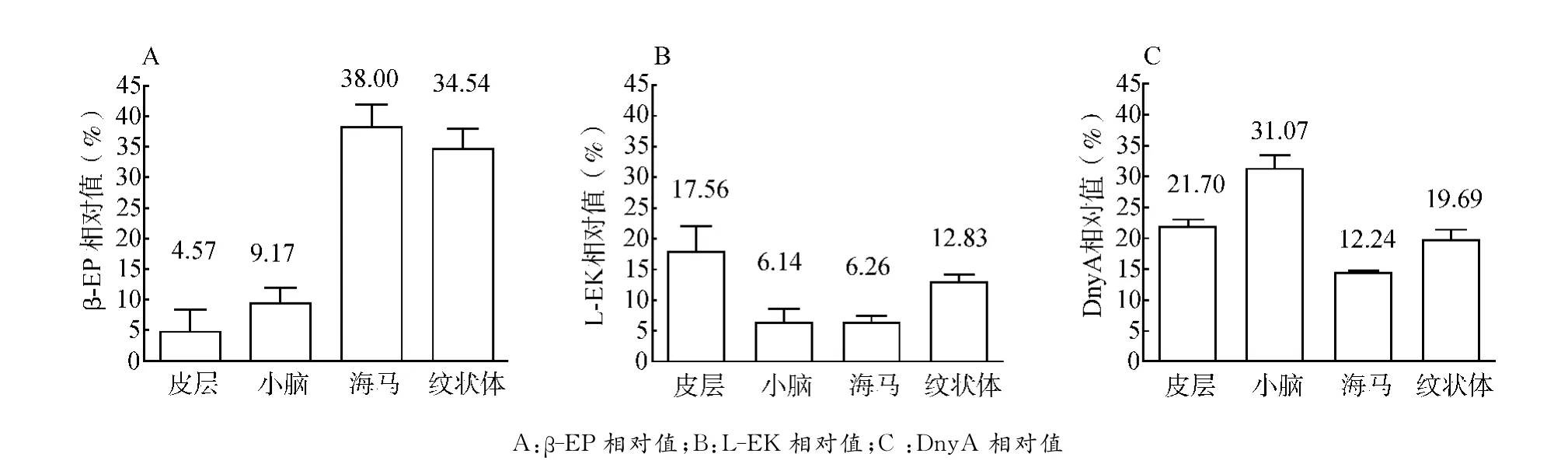
图4 葛根素对慢性乙醇中毒大鼠各脑区阿片肽含量的调节幅度Fig.4 Regulation of puerarin on opioid peptide in the cortex,cerebellum,hippocampus and striatum
3 讨论
阿片肽的研究已有30多年的历史,20世纪70年代,阿片肽陆续在体内外被发现,它所具有的类吗啡活性掀起了科学家们的研究热潮。阿片肽是一种神经活性物质,有激素和神经递质的功能,分内源性和外源性两种,内源性阿片肽主要包括脑啡肽(leuenkaphalin,L-EK)、内啡肽(endorphin,EP)、强啡肽(dynorphin,DnyA)、孤啡肽(orphanin FQ,OFQ)和内吗啡肽(endomorphins,EM)等5大家族。目前对L-EK、β-EP和DnyA的研究较多,因发现其有激素和神经递质的功能,因此被称为神经免疫肽。传统的观点认为,阿片肽主要涉及了成瘾物质如乙醇、吗啡的强化和奖赏效应[5]。但是,近年研究发现阿片系统也参与了学习记忆,其过程非常微妙、复杂[6]。乙醇对中枢神经系统的损害可能是通过内源性阿片类物质介导的这一理论是由Davis等[7]首次提出的。他们发现,乙醇的代谢产物乙醛与多巴胺的某种代谢产物相互作用,所产生的生物碱类可以和阿片受体结合产生阿片样效应,除此之外,乙醇还可通过以下方式兴奋内源性阿片受体:①乙醇中间代谢产物乙醛与儿茶酚类形成类阿片物质加和物;②乙醇可以通过多巴胺和γ-氨基丁酸等递质系统引起内源性阿片类物质的释放,间接兴奋其受体;③乙醇可非特异性提高内源性阿片受体对阿片类物质的敏感性。也有动物实验表明乙醇中毒可影响内源性阿片肽的含量和基因表达,急性乙醇摄入可以增加大脑某些区域内源性阿片肽基因的表达[8],慢性乙醇中毒对阿片肽的影响却有着诸多不同甚至相反的结论[9-10],可能与实验方法、取材部位及标本处理方式不同有关。
乙醇中毒现象的严重性引发了众多学者对解酒药物的研究[11-12],解酒药物层出不穷。在我国葛根用于解酒已有4千多年的历史,葛根素是葛根的主要有效成分之一,因其在体内分布广、消除快、不易积蓄等特点被广泛用于临床治疗心脑血管疾病。葛根素对乙醇中毒脑内阿片肽的影响研究报道较少,董学妍等[13]曾报道葛根素对急性乙醇中毒下丘脑阿片肽具有调节作用,但葛根素对慢性乙醇中毒大鼠多脑区阿片肽的系统干预研究尚未见报道。关于葛根素调节内源性阿片肽释放的作用机制目前还不是很清楚,推测其可能通过降低脑循环血液中乙醇及其代谢产物乙醛的浓度间接调节内源性阿片肽的释放,还可能通过影响多巴胺和氨基酸类递质间接调节了阿片肽物质的释放。
本实验结果显示,慢性乙醇中毒组大鼠各脑区L-EK和DnyA含量显著高于对照组,葛根素组LEK和DnyA含量较慢性乙醇中毒组降低(图2,3),说明葛根素可能通过以上机制调节脑内L-EK和DnyA含量,对乙醇中毒大鼠脑组织产生保护性调控作用。β-EP的变化与L-EK和DnyA结果相反,慢性乙醇中毒组各脑区β-EP的含量比对照组低,而葛根素组β-EP含量比慢性乙醇中毒组高(图1),该结果可能与长期的乙醇摄入降低前阿黑素原基因的表达,从而减少β-EP的释放有关[14]。对比4个脑区葛根素干预后β-EP、L-EK和DnyA含量的变化幅度(图4)发现,葛根素对各脑区各指标的调节幅度不完全一致,对皮层和小脑调节幅度较小,对海马和纹状体调节幅度较大。海马是记忆的主要脑功能区,其余各脑区均与机体的记忆和运动功能有关,由本实验结果推断:葛根素可能对乙醇中毒所致空间记忆障碍及运动功能异常有较为显著的调控作用,详细机制还需进一步实验研究。
[1] Julia W,Helge F,Thomas H,et al.Hippocampal volume loss in patients with alcoholism is influenced by the consumed type of alcoholic beverage[J].Alcohol Alcohol,2008,43(3):296-299.
[2] Marksteiner J,Bodner T,Gurka P.Alcohol-induced cognitive disorder:alcohol dementia[J].Wien Med Wochenschr,2002,152(3):98-101.
[3] Hulse G K,Lautenschlager N T,Tait R J,et al.Dementia associated with alcohol and other drug use[J].Int Psychogeriatr,2005,17(1):S109-S127.
[4] 崔淑芹 .不同用药时间葛根素对急慢性乙醇中毒大鼠心脏的干预作用[J].吉林大学学报:医学版,2011,37(6):1083-1086.
[5] Oswald L M,Wand G S.Opioids and alcoholism[J].Physiol Behav,2004,81(2):339-358.
[6] Yang S,Kawamura Y,Yoshikawa M.Effect of rubiscolin,a delta opioid peptide derived from Rubisco,on memory consolidation[J].Peptides,2003,24(2):325-328.
[7] Davis V E,Walsh M J.Alcohol,amines and alkaloids:apossible biochemical basis for alcohol addiction[J].Science,1970,167(920):1005-1007.
[8] Agapito M,Mian N,Boyadjieva N I.Period 2gene deletion abolishes beta-endorphin neuronal response to ethanol[J].Alcohol Clin Exp Res,2010,34(9):1613-1618.
[9] Boyadjieva N,Dokur M,Advis J P.et al.Chronic ethanol inhibits NK cell cytolytic activity:role of opioid peptide beta-endorphin[J].J Immunol,2001,167(10):5645-5652.
[10] Zalewska-Kaszubska J,Czarnecka E.Deficit in beta-endorphin peptide and tendency to alcohol abuse[J].Peptides,2005,26(4):701-705.
[11] Zhao M,Du Y Q,Yuan L,et al.Protective effect of puerarin on acute alcoholic liver injury[J].Am J Chin Med,2010,38(2):241-249.
[12] 曹芹芳,虞涤霞,王密 .肝泰胶囊对大鼠乙醇性肝纤维化的治疗作用[J].华中科技大学学报:医学版,2013,42(1):22-26.
[13] 董学妍,程秀臻 .急性乙醇中毒大鼠下丘脑阿片肤含量的变化及葛根素的干预研究[J].潍坊医学院学报,2009,1(4):10-13.
[14] Boyadjieva N,Sarkar D K.Effects of ethanol on basal and adenosine-induced increases in beta-endorphin release and intracellular cAMP levels in hypothalamic cells[J].Brain Res,1999,824(1):112-118.
