响应面法优化红景天中红景天苷超声波-微波协同提取工艺
2013-05-15曾庆华孙小凡刘桂芹
曾庆华,樊 琛,孙小凡,李 燕,刘桂芹,王 会
(聊城大学食品科学与工程系,山东聊城252059)
红景天(Rhodiola sachalinensis A.Bor.)属被子植物门蔷薇目景天科(Crassulaceae)红景天属(Rhodiola L.),为多年生草本或亚灌木野生植物,其品种繁多,资源丰富,全世界共有90多种,我国约有73种,主要分布在四川、东北、新疆、甘肃、西藏、云南、贵州等地[1-3]。红景天具有特殊的适应性和很强的生命力,素有“高原人参”和“雪山仙草”之称[4-5]。红景天全株可入药,尤以其根茎及根为最佳。《神农本草经》将红景天列为药中上品,2005版第一部《中国药典》也将红景天收录其中,这些都充分证明了红景天养生保健的药用价值[6]。
红景天苷是红景天的主要有效性成分,也是评价红景天的最重要指标[7-8]。现代药理学表明,红景天苷具有消除疲劳、抗衰老、抗缺氧、抗微波辐射、抗肿瘤等作用;对神经系统、内分泌系统起到调节作用;改善心血管系统、影响三大物质的代谢。另外,红景天苷还具有调节机体免疫及适应原样等作用,被称为继人参、刺五加之后的新一代极具发展潜力的环境适应药物,在军事医学、航空医学、运动保健医学等领域均具有十分重要的应用价值[9-11]。
目前,国内外学者对红景天的化学成分、药理作用、主要有效成分的结构鉴定有较为深入的研究,但对于其提取纯化工艺的研究,还处于初始阶段[12]。因此,红景天苷的提纯工艺优化研究意义重大。已有的科研报道中,对红景天有效成分的粗提取大多采用溶剂提取法[13](包括热提取法和浸泡提取法)、微波辅助法[14]、超声波提取法[15]、超临界萃取法[16]等。溶剂提取法耗时较长。超临界萃取法所得产品质量高,但设备一次性投入较大。微波辅助法与超声波提取法在红景天苷提取中的应用一般作为单一技术使用。周明等[17]利用超声波-微波协同提取灵芝多糖,结果超声波-微波协同萃取法与常规热水提取工艺相比,可减少3/4的提取时间,提高26.27%的提取效率。利用超声波-微波协同提取红景天苷的工艺研究尚未见报道。本实验利用响应面法对超声波-微波协同提取红景天苷的工艺进行优化,为超声波-微波协同提取红景天苷产业化提供理论依据。
1 材料与方法
1.1 材料与仪器
红景天 产地云南,购于聊城市利民中药饮片有限公司,粉碎后过40目筛备用;红景天苷对照品 贵州迪达科技有限责任公司;蒸馏水、95%乙醇、10%醋酸铅溶液、正丁醇、饱和硫酸钠溶液 均为分析纯。
KQ3200型超声波清洗器 超声功率150W,昆山市超声仪器有限公司;常压微波合成/萃取工作站 上海新仪微波化学科技有限公司;TG-16WS型台式离心机 长沙湘智离心机仪器有限公司;TU-1810型紫外可见分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 检测波长确定 精密称取红景天苷对照品20.1mg,置于100mL的容量瓶中,加蒸馏水定容,并摇匀,即得浓度为0.20g/L的红景天苷标准溶液。取标准溶液3.0mL置10mL容量瓶中,加蒸馏水定容,并摇匀,在200~400nm波长下扫描[18]。
1.2.2 标准曲线的绘制 分别量取1.2.1所得红景天苷标准溶液1.0﹑2.0﹑3.0﹑4.0﹑5.0﹑6.0mL,放于10mL容量瓶中,用蒸馏水定容,摇匀,在276nm处测定其吸光度。以吸光度Y为纵坐标,浓度x为横坐标,绘制标准曲线。
1.2.3 红景天中红景天苷的提取方法
1.2.3.1 红景天苷提取工艺流程 红景天根→粉碎(过40目筛)→超声波处理→微波提取→抽滤→滤液定容→除杂→离心→定容→测定吸光度。
1.2.3.2 红景天苷的提取方法 将干燥的红景天根置于中药粉碎机中粉碎,过40目筛备用。准确称取红景天粉末5.0000g,置于100mL微波仪专用三颈烧瓶中,加入一定比例的乙醇溶液,在一定条件下超声一定时间,然后在实验条件下微波辅助提取一定时间,抽滤得滤液,滤液定容于100mL容量瓶中,摇匀,量取10mL滤液于烧杯中,加入2mL 10%醋酸铅溶液,摇匀充分反应后再加入0.5mL饱和硫酸钠溶液,摇匀脱铅。将反应液以4000r/min离心15min,取上清液用蒸馏水定容于50mL容量瓶,摇匀。以蒸馏水作参比液,于276nm测定吸光度。
1.2.3.3 红景天苷得率测定 按照1.2.3.2中的方法做实验,获得吸光度值,将此值代入回归方程y=4.6676x-0.006,得出提取液中有效成分的浓度a(mg/mL)。将此浓度代入公式:红景天苷的得率(%)=(a×500/b)×100;式中,b代表样品的质量(g)。
1.2.4 单因素实验 超声波-微波协同提取红景天中红景天苷的实验优化主要包括乙醇体积分数、料液比、超声波时间、微波时间、微波功率的选择。针对这几个因素分别按照1.2.3.2中的方法做单因素实验,考察它们对得率的影响,选择最佳的提取条件。
1.2.4.1 乙醇体积分数的选择 固定料液比1∶20,超声波时间20min,微波时间10min,微波功率400W,在乙醇体积分数分别为10%、30%、50%、70%、90%的条件下提取。
1.2.4.2 料液比的选择 固定乙醇浓度70%,超声波时间20min,微波时间10min,微波功率400W,分别在料液比为1∶10﹑1∶15﹑1∶20﹑1∶25﹑1∶30的条件下提取。
1.2.4.3 超声时间选择 固定乙醇体积分数70%,料液比1∶20,微波时间10min,微波功率400W,分别在超声波时间为10﹑20﹑30﹑40﹑50min的条件下提取。
1.2.4.4 微波时间选择 固定乙醇体积分数70%,超声波时间20min,料液比1∶20,微波功率400W,分别在微波时间为6、8、10、12、14min的条件下提取。
1.2.4.5 微波功率选择 固定乙醇体积分数70%,料液比1∶20,超声波时间20min,微波时间10min,分别在微波功率为300、400、500、600、700W的条件下提取。1.2.5 响应面实验 在单因素实验的基础上,选取乙醇体积分数、料液比、微波时间作为自变量进行3因素3水平中心组合实验设计,对红景天苷的提取工艺进行优化。水平因素设计见表1。
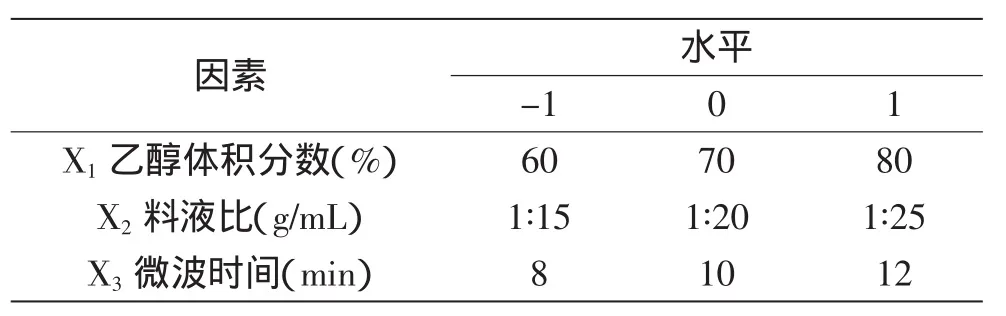
表1 响应面实验因素水平表Table 1 Analytical factors and levels for RSA
2 结果与分析
2.1 检测波长确定
吸收光谱如图1所示,红景天苷标准溶液在221nm和276nm处具有最大吸收峰,但供试品溶液在221nm附近存在干扰性杂质[19],对吸光度的稳定性有影响,因此,本文选择以276nm作为红景天苷有效成分的检测波长。
2.2 标准曲线
标准曲线如图2所示,吸光度(Y)与红景天苷浓度(x,mg/mL)的线性回归方程为:Y=4.6676x-0.006,R2=0.9997,其中,Y与x在0~0.12mg/mL范围内呈良好的线性关系。
2.3 单因素实验
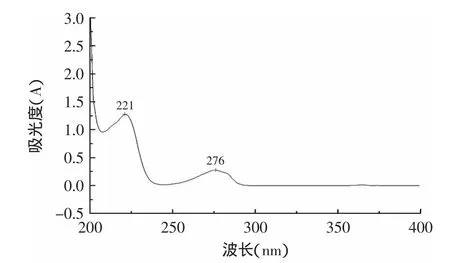
图1 红景天苷标准溶液紫外吸收光谱图Fig.1 UV absorption spectra of the standard salidroside solution

图2 红景天苷标准曲线Fig.2 Standard curves of the standard salidroside solution
2.3.1 乙醇体积分数对红景天苷得率的影响 由图3可知,红景天苷得率随着乙醇体积分数的增加而有所提高,但超过70%以后有所下降。因此选择乙醇体积分数70%作为最佳提取浓度。浓度过高或过低都不利于有效成分的提取,这是因为浓度较大时,过高的渗透压使溶剂不易渗入红景天组织细胞壁和细胞膜,而浓度过低又不利于有效成分的溶解和吸收所导致的。

图3 乙醇体积分数对红景天苷得率的影响Fig.3 Effect of volume fraction of ethanol on the yield of salidroside
2.3.2 料液比对红景天苷得率的影响 由图4可知,在料液比为1∶10~1∶20的区间内,随着溶媒量的增加,红景天苷得率逐渐增大,因为在此液料比范围内,浸提用的溶剂量还不足以溶解浸出的红景天苷,提取液已达到饱和;但在料液比1∶20以后增加不明显,另一方面,溶媒量增加,生产成本及后续处理的难度也会增大,考虑到经济效益和抽滤时间,因此选用1∶20的料液比作为最佳料液比。

图4 料液比对红景天苷得率的影响Fig.4 Effect of liquid-solid ratio on the yield of salidroside
2.3.3 超声波时间对红景天苷得率的影响 由图5可知,随着超声时间的增加,红景天苷得率不断增加,但超过30min后不断减小,考虑到提取时间和经济效益,因此选择20min作为最佳超声波提取时间。分析原因为:在一定时间范围内,随超声波提取时间的延长,样品中的含水量增加,加快了固相中红景天苷向水中的溶解,使红景天苷的浸出更充分;而超声波时间过长,则会导致红景天苷水解进程的加快,从而使提取率有所下降。

图5 超声波时间对红景天苷得率的影响Fig.5 Effect of ultrasonic wave extraction time on the yield of salidroside
2.3.4 微波时间对红景天苷得率的影响 由图6可知,随着微波时间的增加,红景天苷得率基本不变,超过10min以后有所下降。因此选择10min作为最佳微波提取时间。

图6 微波时间对红景天苷得率的影响Fig.6 Effect of microwave extraction time on the yield of salidroside
2.3.5 微波功率对红景天苷得率的影响 由图7可知,红景天苷得率随着微波功率的增加而有所提高,但超过400W以后有所下降。因此选择微波功率400W作为最佳微波功率。
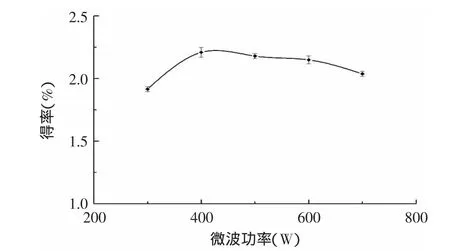
图7 微波功率对红景天苷得率的影响Fig.7 Effect of microwave power on the yield of salidroside
2.4 响应面分析实验
乙醇体积分数(X1)、料液比(X2)、微波时间(X3)编码值与实验值间的转换公式为:X1=(Z1-70)/10,X2=(Z2-20)/5,X3=(Z3-10)/2。式中Z1、Z2、Z3分别表示乙醇体积分数、料液比、微波时间的真实值。以X1、X2、X3为自变量,红景天苷得率为响应值,采用SAS RSREG程序进行响应面分析实验,实验设计与结果如表2所示。采用SAS 8.0软件处理上述实验设计所得响应面图见图8~图10。
由图8可知,当微波提取时间一定时,得率随乙醇体积分数和料液比的增加显示增加,在到达最高点后,下降明显。
由图9可知,当料液比一定时,得率随乙醇体积分数和微波提取时间的增加显示增加,在到达最高点后,下降明显。
由图10可知,当乙醇体积分数一定时,得率随料液比和微波提取时间的增加显示增加,在到达最高点后,下降明显。

表2 响应面分析方案及数据结果Table 2 Program and experimental results of RSA
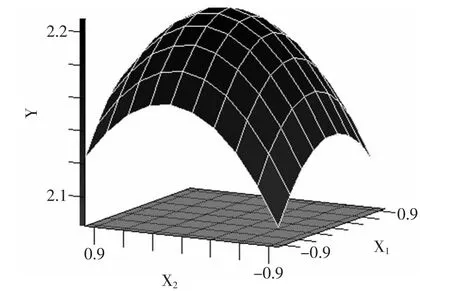
图8 乙醇体积分数和料液比对得率影响的响应面分析Fig.8 Response surface analysis of volume fraction of ethanol and solid-liquid ratio on the yield of salidroside
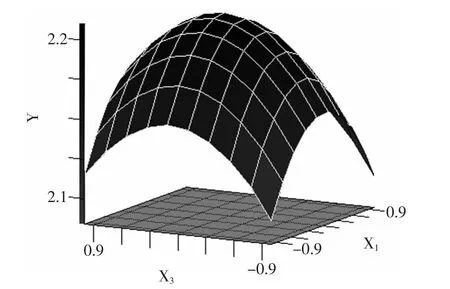
图9 乙醇体积分数与微波提取时间对得率影响的响应面分析Fig.9 Response surface analysis of volume fraction of ethanol and microwave extraction time on the yield of salidroside

图10 料液比与微波提取时间对得率影响的响应面分析Fig.10 Response surface analysis of solid-liquid ratio and microwave extraction time on the yield of salidroside
采用SAS RSREG程序对响应值与各因素进行回归拟合后,得到回归方程:
Y=2.208333-0.00375X1+0.008X2+0.00225X3-0.050542X12+0.00225X1X2+0.00225X1X3-0.061542X22+0.01375X2X3-0.042042X32
由表3可见,X22为高度显著,X12,X32为显著。同样对响应值具有较大影响,进一步说明各具体实验因子对响应面的影响不仅仅是简单的线性关系,使用该方程模拟真实的三因素三水平的分析是可行的。由表3可知,回归模型也是显著的。该模型相关系数R2=0.9017,说明该模型与实际实验拟合较好。
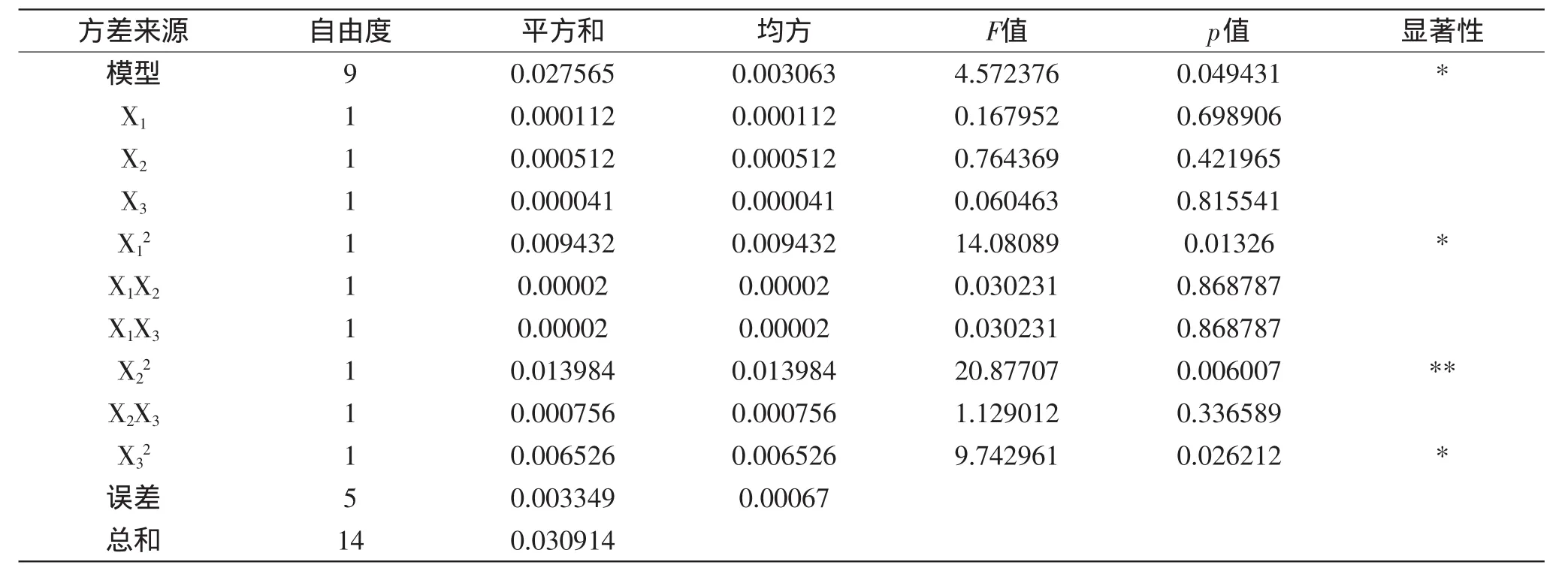
表3 回归方程的方差分析结果Table 3 ANOVA for response surface quadratic model
因此,回归方程可以较好地描述各因素与得率之间的真实关系,可以利用该回归方程确定最佳工艺条件。经过计算得到最佳乙醇体积分数为70.39533%,料液比为1∶20.350535,微波提取时间为10.078562。考虑到实验仪器的实际限制,将其修正为乙醇体积分数为70%,料液比为1∶20,微波时间为10min,即红景天苷最佳提取条件为:乙醇体积分数为70%,料液比为1∶20,微波时间为10min。用此数学模型预测最佳条件下的得率为2.21%。
2.3 验证实验
为进一步精确实验结果,按照1.2.3.2中的方法做三次验证实验,红景天苷的得率平均可达2.209%,而拟合的数学模型得到的理论预测值为2.21%。验证实验结果表明,该模型拟合效果较好,可以得到准确可靠的提取工艺参数。
3 结论
本文主要以大花红景天的根为原料,以乙醇为溶媒,采用超声协同微波的方法提取红景天苷,优化红景天苷的提取工艺。在单因素实验的基础上,利用中心组合实验设计对红景天苷的提取工艺进行优化,采用三因素三水平实验设计,根据回归分析确定工艺影响因子,以红景天苷提取率为响应值做响应面图,在分析各个因素的显著性和交互作用后,得出最佳提取工艺条件为:乙醇体积分数70%,料液比1∶20,超声波时间20min,微波时间10min,微波功率400W,在此条件下提取3次,得到红景天苷的平均得率为2.21%。综上,采用超声协同微波的方法提取红景天苷取得了较好的效果,为工业化生产提供了理论依据。
[1]王伟,蔡银燕,陈耀.红景天苷制备工艺的探讨[J].现代中药研究与实践,2007,21(5):50-52.
[2]范明辉,许时婴.红景天苷纳米脂质体的制备及若干工艺参数的优化[J].食品科学,2007,28(11):189-190.
[3]聂建群,王保兴,汪旭,等.微波辅助提取大花红景天中红景天苷的工艺研究[J].食品研究与开发,2006,27(5):35-38.
[4]魏志莉.红景天的生理特点及保健功能[J].实用医技术杂志,2011,18(12):99.
[5]马涛,郭亚东.大花红景天正丁醇提取物的化学成分研究[J].天然产物研究与开发,2007,19:34-36.
[6]国家药典委员会.中华人民共和国药典[M].第一部.北京:化学工业出版社,2005.
[7]HAN X,ZHANG T Y,WEI Y,et al.Separation of salidroside from Rhodiola crenulata by high-speedcounter-current chromatography[J].Journal of Chromatography A,2002,971(1/2):237-241.
[8]戴传云,刘春玲,徐玉琼,等.红景天中高纯度红景天苷制备工艺[J].食品科学,2009,30(22):165-167.
[9]赵武奇,殷涌光,梁歧,等.微波辅助提取红景天苷[J].食品与发酵工业,2004,30(2):19-22.
[10]王华田,龚钢明.食用乙醇常温浸提法提取红景天苷[J].食品工业,2006(3):34-35.
[11]杨晓艳,芦启琴,张晓峰.HPLC法测定红景天根皮中红景天苷的含量[J].分析实验室,2008,27(5):305-306.
[12]胡锦美.红景天有效成分的提取[J].福州师专学报,1999,19(3):51-54.
[13]陈小明,徐超群.红景天中红景天苷的提取工艺研究[J].华西药学杂志,2010,25(3):329-331.
[14]闵建华,曹旻旻,韦冬菊,等.微波辅助提取红景天苷的工艺研究[J].中草药,2012,43(8):1536-1539.
[15]吴少雄,郭祀远,李琳,等.超声波法提取大花红景天有效成分的工艺研究[J].食品科技,2006(1):46-49.
[16]王化田,祖元刚,毛子军.超临界CO2萃取红景天中红景天苷、苷元酪醇的研究[J].植物研究,2004,24(4):462-465.
[17]周明,杜欣,杨德,等.超声波-微波协同萃取对灵芝多糖提取率的影响[J].湖北农业科学,2009,48(7):1727-1729.
[18]吉欣,张利娟,李育亮,等.紫外分光光度法测定高山红景天根及其浸膏的有效成分[J].化学研究,2007,18(4):55-58.
[19]杨道宾,刘丽,贾国夫,等.红景天酒中红景天苷含量的高效液相色谱测定[J].时珍国医国药,2010,21(11):2799-2800.
