循环胸腔热灌注化疗治疗恶性胸腔积液的临床研究
2013-05-14钱晓哲潘文标孙志勇汤峻付于捷梁而慷叶清曹子昂
钱晓哲,潘文标,孙志勇,汤峻,付于捷,梁而慷,叶清,曹子昂
(上海交通大学医学院附属仁济医院胸外科,上海 200127)
恶性胸腔积液(malignant pleural effusion, MPE)是晚期恶性肿瘤的常见并发症,表明疾病进展和预后险恶。一旦确诊为MPE,患者的生存期约为3~12个月,平均4个月[1,2]。对于这类患者,通过单纯的胸腔穿刺或引流排液,胸水会很快再生,反复排液会造成大量蛋白丢失,加重病人消耗,往往也常会继发胸腔感染。
MPE治疗手段的选择由多个因素决定,包括患者症状、行为状态、原发肿瘤的类型以及其对全身治疗的敏感性、排空胸水后复张的程度等。其中置入肋间引流管引流及引流后的胸膜固定术通常可预防积液复发,是治疗MPE的重要手段[3~8]。目前胸膜固定术中使用最为有效的硬化剂为无菌滑石粉Talc(Mg3Si4O10(OH)2),但其总体疗效仍然有限,有效率在50%以下[9]。患者由于不能有效地控制胸水,使得液体、蛋白及电解质丢失严重,加重了全身衰竭以及加速了疾病进展。因此寻找有效的方式治疗MPE,成为目前临床研究的重点,并得到越来越多临床医生的重视。
我院胸外科于2008年8月至2012年7月间采用循环胸腔热灌注化疗治疗恶性胸腔积液,取得了较为满意的临床效果,现报道如下:
1 临床资料
1.1 一般资料
选取我院胸外科2008年8月至2012年7月经病理学和细胞学证实的恶性胸腔积液患者60例,其中男33例,女27例,平均年龄63(37~75)岁;其中非小细胞肺癌54例,胸膜间皮瘤2例,胸腺癌1例,肺转移瘤(乳腺癌胸膜转移)3例。Karnofsky评分均≥60分, 此前均未接受过系统抗肿瘤治疗及胸腔灌注治疗, 预期生存期均≥6个月。所有病例随机均分为观察组和对照组:观察组30例,其中男16例,女14例,平均年龄61.5(37~74)岁;对照组30例,男17例,女13例,平均年龄64.3(40~75)岁。两组性别、 年龄比较无显著性差异 (均P>0.05)。所有患者在治疗前均签署知情同意书,并经医院伦理委员会论证通过。
1.2 治疗方法
观察组: 采用循环胸腔热灌注化疗治疗。患者取平卧位, 在全麻插管后进行治疗。术前行CT检查,观察胸腔积液分布及判定有无胸腔内粘连。常规于第5肋间腋前线位置置入上胸引流管放于胸顶部位置(作为灌注管),于第7肋间腋后线位置置入下胸引流管放于膈肌上部位置(作为回流管)。如术前CT提示胸内包裹粘连则应尽量避免粘连处置管以免损伤肺脏。置管后排空胸腔积液,随后应用YHP-Ⅰ型灌注式热化疗肿瘤治疗系统(上海交通大学精密仪器研究所设计,江苏亚华生物科技工程有限公司生产)进行治疗。灌注液流速控制在200 ml/min,灌注液温度维持在43℃,持续60 min。治疗过程中实时监测上、下胸引流管的温度。灌注液常规为灭菌蒸馏水2 000 ml,并加入 顺铂(cis-diaminodichloroplatinum,CDDP)(齐鲁制药有限公司生产),剂量为200 mg/m2。为了避免术后肺水肿,常规灌注10 mg地塞米松于灌注液。术中监测心率、有创血压、指脉氧浓度、肛温。热灌注治疗结束后,尽量排净胸腔内灌注液,麻醉状态下鼓肺,使肺最大限度复张。拔除上胸引流管,留置下胸引管术后观察引流情况,待引流量减少至<150 ml/d后拔除下胸引流管。术后常规当天拍摄床边胸片,并监测心率、呼吸频率、无创血压、指脉氧浓度。
对照组:本组于局麻下采用肋间置管引流,灌注无菌滑石粉浆行胸膜固定术。胸腔内注入利多卡因溶液, 剂量为3 mg/kg, 最大剂量250 mg, 继之将无菌滑石粉5 g (上海科邦医用材料有限公司生产)溶于50 ml生理盐水后于胸腔内注入。胸腔内灌注硬化剂后应夹闭引流管1~2 h,以防止硬化剂从引流管中流出。待肋间引流管中没有过多的胸腔积液(<150 ml/d)引流出,行X线胸片检查,显示胸水消散、肺完全复张可撤除肋间引流管。
1.3 术后随访
均采用门诊随访,患者术后每月门诊复诊。术后第2个月起每月复查胸水B超,每3个月复查胸部CT。
1.4 评价方法
1.4.1 近期疗效判定
根据WHO癌性渗液疗效判定标准评定:完全缓解(complete remission,CR)为胸腔积液完全消失并持续4周以上;部分缓解(partial remission,PR)为胸腔积液显著减少>1/2持续4周以上;稳定(stable disease,SD)为胸水量减少<1/2持续4周以上;进展(progressive disease,PD)为胸水量无变化或增加。治疗后恶性胸腔积液完全缓解及部分缓解(CR+PR)被视为治疗有效,恶性胸腔积液稳定及进展(SD+PD)为治疗无效。
1.4.2 生活质量评价
按Karnofsky评分标准(KPS评分)在治疗前、治疗后6周评定。好转:评分增加≥10分,并维持4周以上;稳定:评分无明显变化;恶化:KPS评分减少≥10分。好转患者的比率为改善率。
1.5 统计学分析
应用SPSS20.0软件进行分析和处理,计数资料率的比较采用χ2检验和方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者近期疗效比较
观察组的总有效率为83.3%,对照组为43.3%,观察组的总有效率明显高于对照组,差异有统计学意义(P=0.001),见表1。
2.2 两组患者治疗后KPS评分的变化比较
观察组的KPS评分总提高率为73.3%,对照组为46.7%。观察组的KPS评分总提高率明显高于对照组,差异有统计学意义(P<0.05),见表2。
2.3 两组患者不良反应比较
两组患者围手术期均未出现严重并发症。观察组术后出现胸痛1例, 低热5例, 恶心呕吐2例; 对照组出现灌注后胸痛5例,发热4例,恶心呕吐3例。两组患者出现不良反应后予对症治疗后症状均缓解。两组患者均未出现白细胞下降、肝肾功能损害等不良反应。比较两组不良反应差异无统计学意义(P>0.05),见表3。

表1 两组患者近期疗效比较(n(%))

表2 两组患者治疗后KPS评分变化比较(n(%))
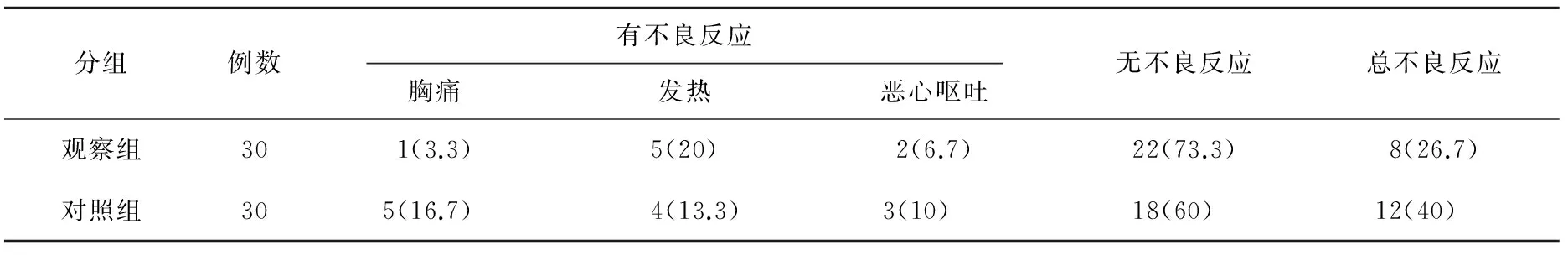
表3 两组患者治疗后不良反应比较(n(%))
3 讨 论
MPE指恶性肿瘤转移至胸膜或原发于胸膜的恶性肿瘤所致的胸腔积液,是晚期肿瘤患者常见并发症。大量恶性胸水的产生导致患者呼吸困难,同时也会丢失大量的白蛋白和血细胞,使得这部分患者的生活质量明显恶化,严重影响其预后。目前临床上治疗MPE的方法较多,但总体疗效有限[10]。单纯胸腔置管引流可暂时缓解MPE症状,但远期效果较差,平均4.2 d液体就可再积聚,且长期引流时,液体、蛋白及电解质丢失严重,加重全身衰竭[4~6]。胸膜固定术是治疗本病的重要手段,目前腔内注入的药物有硬化剂、化疗药物、生物反应调节剂等[7,8]。其中无菌滑石粉可诱发胸膜炎症反应并使局部纤维素沉积,激活局部凝血反应,促进脏层胸膜与壁层胸膜粘连,可一定程度地控制胸水复发,是临床推荐首选应用的胸膜固定药物[11~13]。但采用无菌滑石粉浆行胸膜固定术的有效率仍然较低(50%以下),不能令人满意[9]。临床上亟需找到有效治疗MPE的新方法。
近年来国际上兴起将热疗和化疗相结合治疗肿瘤的新方法,已被认为继手术、放化疗后的又一种治疗晚期癌症的有效手段[14]。肿瘤热疗技术的原理是根据正常组织和肿瘤组织对高热的敏感性存在差异:正常组织细胞对温度的安全界值是45℃,局部可以长时间耐受42℃~43℃高热而不受损害,而肿瘤细胞在43℃持续1 h,即可出现不可逆损害[15,16]。同时,有研究[17~19]报道,温热效应还可以增强化疗药物的作用,使一些化疗药抗癌效果增强10~100倍。温度升高(37℃~43℃)可促进药物进入瘤体,增加肿瘤细胞对药物的摄取及敏感性,并延长化疗药物的作用时间,从而使其对肿瘤细胞的杀伤作用也随之增强[20~22],其中CDDP是最常用的胸腔灌注药物。本组采用循环胸腔热灌注化疗治疗恶性胸腔积液,其优点可概述为: ①物理冲刷作用将滞留在体腔内的癌细胞冲出体外;②可以提高用药剂量,使腔内抗癌药的浓度大大高于体循环浓度,但不增加全身毒性;③由于水的流动性比较好,可以充满胸腔的每个角落,减少死腔,达到最佳治疗效果;④增强某些化疗药物的肿瘤渗透性(直接渗透深度可达5 mm)和细胞毒性,诱导肿瘤细胞凋亡,预防肿瘤和胸水复发[23,24]。
目前国内热疗机构众多,治疗方法多样并无统一的标准。笔者等总结多年的治疗经验,概括为以下几点心得体会:①国内大多报道胸腔内热灌注治疗在局麻下完成,但笔者等主张治疗应在全麻插管下完成。在实际治疗过程中,笔者等发现:局部胸腔在43℃下热疗其实是较难耐受的,同时局麻下患者因紧张焦虑等情绪可引起心动过速等症状,很难与潜在的真正不良反应相鉴别。本研究观察组患者均于全麻插管麻醉下进行,在减轻患者痛苦的同时,也使治疗可以安全顺利地完成。②同时,全麻插管呼吸机辅助通气时务必给予呼气末正压(positive end expiratory pressure,PEEP),这有利于患侧肺的复张,是相当重要的。PEEP是保持肺泡充张状态的重要保证[25]。既往研究表明,肺萎陷是胸膜固定术失败的最主要原因[5,8,10]。同样的,在热灌注化疗过程中,也需要患者患侧肺尽量膨胀以消除胸内死腔。同时患侧肺在正压通气下充分复张,有利于化疗药物对于肺脏表面肿瘤细胞组织的渗透,更有利于热化疗的疗效。笔者等一般根据术中肺部质地条件给予5~10 cmH2O(1 cmH2O=98.07 Pa)压力值的PEEP,选择肺复张容积有大幅度增加的PEEP可能较为合适[26]。③灌注液注意采用灭菌蒸馏水:相关文献[27,28]报道,认为蒸馏水无渗透压,灌洗后可造成肿瘤细胞处于低渗状态,低渗可直接破坏肿瘤细胞膜,损伤肿瘤细胞,因而主张用灭菌蒸馏水灌注。
本研究中,与对照组相比,观察组治疗的有效率、生活质量改善率明显升高,差异有统计学意义(P=0.001和P=0.035);且不增加治疗的不良反应,两组差异无统计学意义(P>0.05)。因此,从姑息治疗晚期肿瘤的角度而言,循环胸腔热灌注化疗可安全、有效地控制顽固性恶性胸腔积液,且明显提高患者的预后生活质量,值得临床推广应用。同时Burrows等[29]研究表明恶性胸腔积液患者的行为状态评分与病死率明显相关,Karnofsky评分<30者的平均生存期约为1.1个月,Karnofsky评分>70者的平均生存期可达到13.2个月。在本研究中,观察组的KPS评分总提高率明显高于对照组,差异有统计学意义(P=0.035)。因而循环胸腔热灌注治疗恶性胸腔积液,在控制胸腔积液,改善患者生活质量的同时,有很大可能延长这部分晚期肿瘤患者的生存期,有待今后进一步研究证实。
[参考文献]
[1] Heffner JE. Diagnosis and management of malignant pleural effusions[J]. Respirology,2008,13(1):5-20.
[2] Heffner JE, Nietert PJ, Barbieri C. Pleural fluid pH as a predictor of survival for patients with malignant pleural effusions[J]. Chest, 2000,117(1):79-86.
[3] Davies HE, Mishra EK, Kahan BC, et al. Effect of indwelling pleural catheter vs chest tube and talc pleurodesis for relieving dyspnea in patients with malignant pleural effusion the TIME2 randomized controlled trial[J]. Jama,2012,307(22):2383-2389.
[4] Maceachern P, Tremblay A. Pleural controversy:pleurodesis versus indwelling pleural catheters for malignant effusions[J]. Cancer Invest,2011,16(5):747-754.
[5] Musani Al. Treatment option for malignant pleural effusion[J]. Curr Opin Pulm Med, 2009,15(4):380-387.
[6] Spector M, Pollak JS. Management of malignant pleural effusions[J]. Semin Respir Crit Care,2008,29(4):405-413.
[7] Comert SS, Caglayan B, Parmaksiz ET, et al. Chemical pleurodesis:from the point of view of pulmonary physicians and thoracic surgeons[J]. Turk Gogus Kalp Dama,2013,21(2):408-415.
[8] Uzbeck MH, Almeida FA, Sarkiss MG, et al. Management of malignant pleural effusions[J]. Adv Ther,2010,27(6):334-347.
[9] Dresler CM, Olak J, Herndon JE 2nd, et al. Phase III intergroup study of talc poudrage vs talc slurry sclerosis for malignant pleural effusion effusion[J]. Chest,2005,127:909-915.
[10] Davies HE, Lee YC Gary. Management of malignant pleural effusions:questions that need answers[J]. Curr Opin Pulm Med, 2013,19(4):374-379.
[11] Roberts ME, Neville E, Berrisford RG, et al. Management of a malignant pleural effusion-British Thoracic Society pleural disease guideline[J]. Thorax, 2010,65(Suppl 2):32-40.
[12] Hooper C, Lee YC, Maskell N,et al. Investigation of a unilateral pleural effusion in adults: British Thoracic Society Pleural Disease Guideline 2010[J]. Thorax, 2010,65( Suppl 2):ii4- ii 17.
[13] Tan C, Sedrakyan A, Browne J, et al. The evidence on the effectiveness of management for malignant pleural effusion:a systematic review[J]. Eur J Cardio-Thorac Surg,2006,29(5):829-838.
[14] Monneuse O, Beaujard AC, Guibert B, et al. Long-term results of intrathoracic chemohyperthermia (ITCH) for the treatment of pleural malignancies[J]. Brit J Cancer,2003,88(12):1839-1843.
[15] Smythe WR. Hyperthermia:Has its time come? [J]. Ann Surg Oncol, 2003,10(3):210-212.
[16] Roger AV, Angela L, Mark G, et al. Whole-body hyperthermia:a review of theory,design and application[J]. Perfusion,2002,17 (4): 279-290.
[17] Bogliolo GV, Lerza R, Bottino GB, et al. Regional pharmacokinetic selectivity of intrapleural cisplatin[J]. Eur J Cancer,1991,27(7):839-42.
[18] Chen WJ, Yuan SF, Yan SF, et al. Intrapleural chemo- and hyperthermotherapies for malignant pleural effusion:a randomized prospective study[J]. Cancer invest,2012,30(2):126-130.
[19] Yang CL, Liu SS, Ma YG, et al. The influence of intraoperative pleural perfusion with matrine-cisplatin or cisplatin on stromal cell-derived factor-1 in non-small cell lung cancer patients with subclinical pleural metastasis[J]. Med Oncol,2012,29(2):574-581.
[20] Bogliolo GV, Lerza R, Bottino GB, et al. Regional pharmacokinetic selectivity of intrapleural cisplatin[J]. Eur J Cancer,1991,27(7):839-42.
[21] Chen WJ, Yuan SF, Yan SF, et al. Intrapleural chemo- and hyperthermotherapies for malignant pleural effusion:a randomized prospective study[J]. Cancer invest, 2012,30(2):126-130.
[22] Yang CL,Liu SS,Ma YG, et al. The influence of intraoperative pleural perfusion with matrine-cisplatin or cisplatin on stromal cell-derived factor-1 in non-small cell lung cancer patients with subclinical pleural metastasis[J]. Med Oncol,2012,29(2):574-581.
[23] Yellin A, Simansky DA, Paley M, et al. Hyperthermic pleural perfusion with cisplatin-Early clinical experience[J]. Cancer,2001,92(8):2197-2203.
[24] Ried M, Potzger T, Braune N, et al. Local and systemic exposure of cisplatin during hyperthermic intrathoracic chemotherapy perfusion after pleurectomy and decortication for treatment of pleural malignancies[J]. J Surg Oncol, 2013, 107(7):735-740.
[25] Couture MA. Dead space fraction: one of many choices to assess PEEP titration[J]. Respir Car, 2013,58(7):84-5.
[26] Suarez-Sipmann F, Bohn SH, Tusman G, et al. Use of dynamic compliance for open lung positive end-expiratory pressure titration in an experimental study[J]. Crit Care Med, 2007, 35(1):214-221.
[27] Mercill DB, Jones NR, Harbell JW. Human tumor cell destruction by distilled water. An in vitro evaluation[J]. Cancer,1985, 55(12):2779-82.
[28] Margenthaler JA. The potential role and mechanisms of distilled water-induced hypotonic shock on malignant cells[J]. J Surg Res, 2013,181(1):67-68.
[29] Burrows CM, Mathews WC, Colt HG. Predicting survival in patients with recurrent symptomatic malignant pleural effusions: an assessment of the life measures of extent of disease[J]. Chest,2000,117(1):73-78.
