转基因大豆GTS 40-3-2基体标准物质联合定值研究及不确定度分析
2013-05-14刘瑛颖隋志伟傅博强
刘瑛颖 隋志伟 王 晶 傅博强
(中国计量科学研究院,北京 100013)
0 引言
近年来,全球农业生物技术产业取得了巨大发展,转基因作物种植面积逐年上升。转基因大豆为主要种植的转基因作物,2009 年种植面积达到6920万公顷,占全世界转基因作物种植面积的52%[1]。
大豆品系GTS 40-3-2是由加拿大孟山都公司(Monsanto)开发的,它使得在大豆种植中可以选用草甘膦做除草剂。GTS40-3-2抗草甘膦转基因大豆是通过农杆菌介导方法,将矮牵牛Ti 质粒(CaMy)中35S启动子控制epsps 基因导入到大豆植株,培育成的新大豆品种,其含有的4个来源于土壤细菌(Agrobacteriumspp.CP4)的5-烯醇丙酮莽草酸-3-膦酸合成酶(epsps)基因,是草甘膦抗性的主要来源[2]。
转基因大豆在全球范围的迅猛发展也使其食用安全和环境安全问题引起了各国政府和相关国际组织的高度重视,纷纷出台了转基因生物安全管理相应的法规,对转基因植物检测技术的灵敏度和准确性提出了高标准严要求。目前农业部已经颁布了转基因大豆定性PCR检测方法的国家标准,而我国却缺乏转基因大豆产品的标准物质,这就要求加快对转基因大豆GTS40-3-2标准物质的研制。转基因大豆GTS40-3-2标准物质的研制可用于转基因大豆检测和安全评价、实验室质量控制、转基因大豆GTS40-3-2的定量检测等领域。
1 实验部分
1.1 主要仪器与试剂
主要试剂:Taqman PCR master mix试剂盒(美国ABI),内标基因引物、外源基因引物和TaqMan 探针(上海英峻),植物基因组提取试剂盒(天根生物)。3个水平的转基因大豆GTS40-3-2基体标准物质和纯阳性材料由上海交通大学提供。
主要仪器:定量PCR仪 AB7900。
1.2 实时定量PCR扩增体系和条件
根据植物基因组提取试剂盒说明书提取大豆粉中的DNA,经过紫外分光光度计测量DNA浓度、凝胶电泳观察DNA完整性。参考相关文献[3-5]并通过实验选择并优化了插入外源序列特异性引物、探针,选择大豆内源性基因设计并优化引物和探针,结果如表1所示。
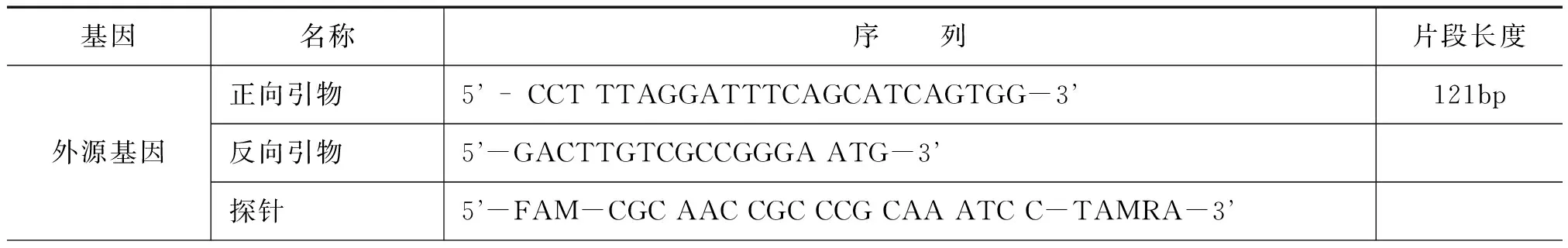
表1 Taqman探针实时PCR检测引物和探针序列信息

续表
扩增体系如表2所示,扩增程序为:95℃,300s;95℃,15s,60℃,60s,45个循环。
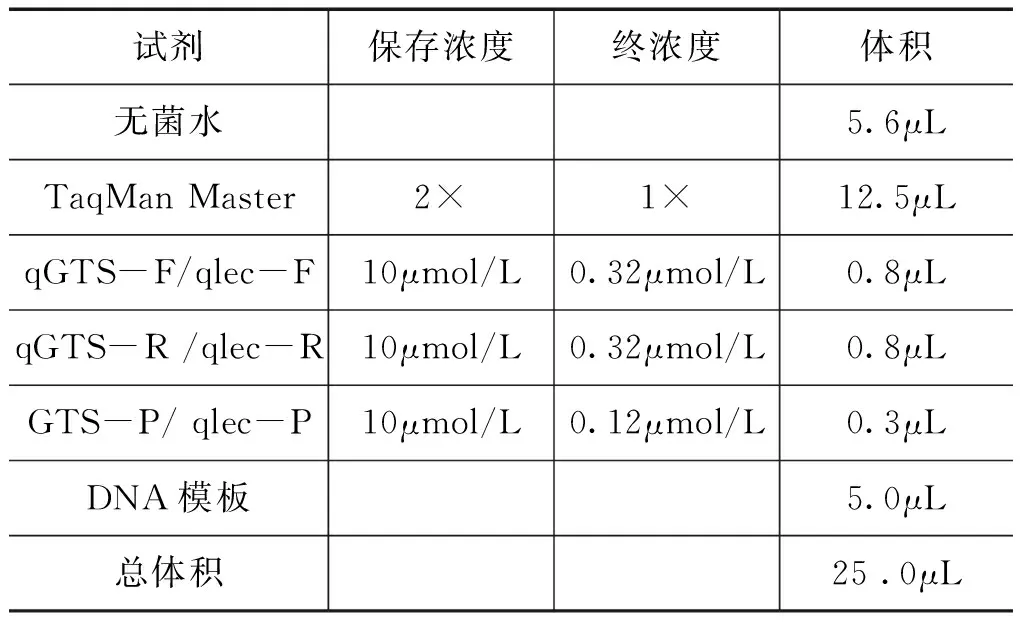
表2 GTS40-3-2结构特异性与大豆内标准基因的荧光定量PCR扩增体系
1.3 标准曲线和测量结果计算
将阳性转基因大豆GTS40-3-2提取的基因组DNA作为标准品,根据下面的公式换算成基因组DNA拷贝数浓度,通过梯度稀释法配制成5个浓度梯度的标准溶液,以拷贝数为横坐标和扩增得到的Ct值(每个反应管内的荧光信号到达设定的域值时所经历的循环数)为纵坐标绘制标准曲线。拷贝数计算公式:
Cp=6.02×1023×CDNA/Mw
式中,CDNA为测定的样本基因组DNA浓度;Mw为基因组分子量大小,大豆基因组大小为1100Mb。
根据得到的内外源基因的拷贝数计算转基因成分的含量,公式如下:
胶塞体系泵入井筒后,随着温度的上升和时间的延长以及泵注的剪切搅动,稠化剂逐渐溶解,交联中心离子逐渐释放,胶塞体系逐渐成胶,最终形成具有高强度和黏弹性的固体胶状物(见图2),120℃下的初始黏度达30000 mPa·s以上。由于稠化剂浓度较高,且成胶前交联剂已与稠化剂充分混合,最终使得半乳甘露聚糖与交联剂中心离子形成较为致密的空间网状结构,表现为高黏弹性的固体状。
转基因产品的含量(%)=测试样品中外源基因的拷贝数/(测试样品中内源基因的拷贝数×内标比)×100%
1.4 室内重复性检查
验证实验室用建立的定量PCR方法对转基因大豆GTS40-3-2A、B、C三个梯度水平的9个样品进行了定量分析,以进一步确认建立的PCR定量方法能进行转基因大豆GTS40-3-2基体标准物质的定值。
1.5 多家实验室定值
选择有资质的实验室参加协同实验,实验室选择的原则是:1)通过ISO/IEC 17025的认可或CNAS-CL01:2006的资质、农业部认可;2)或者参加过能力验证计划;3)或者经盲样测试合格。
2 结果与讨论
2.1 定量PCR实验方法确认
经验证实验室研究,转基因大豆GTS40-3-2内、外标准基因定量PCR的扩增效率在0.85以上,线性相关系数在0.99以上,说明构建的标准曲线适合于转基因大豆GTS40-3-2样品的定量检测。所有样品定量分析的相对标准偏差RSD(%)在25%以内,说明转基因大豆GTS40-3-2定量PCR方法的重复性能够满足定量的要求[5](见表3)。
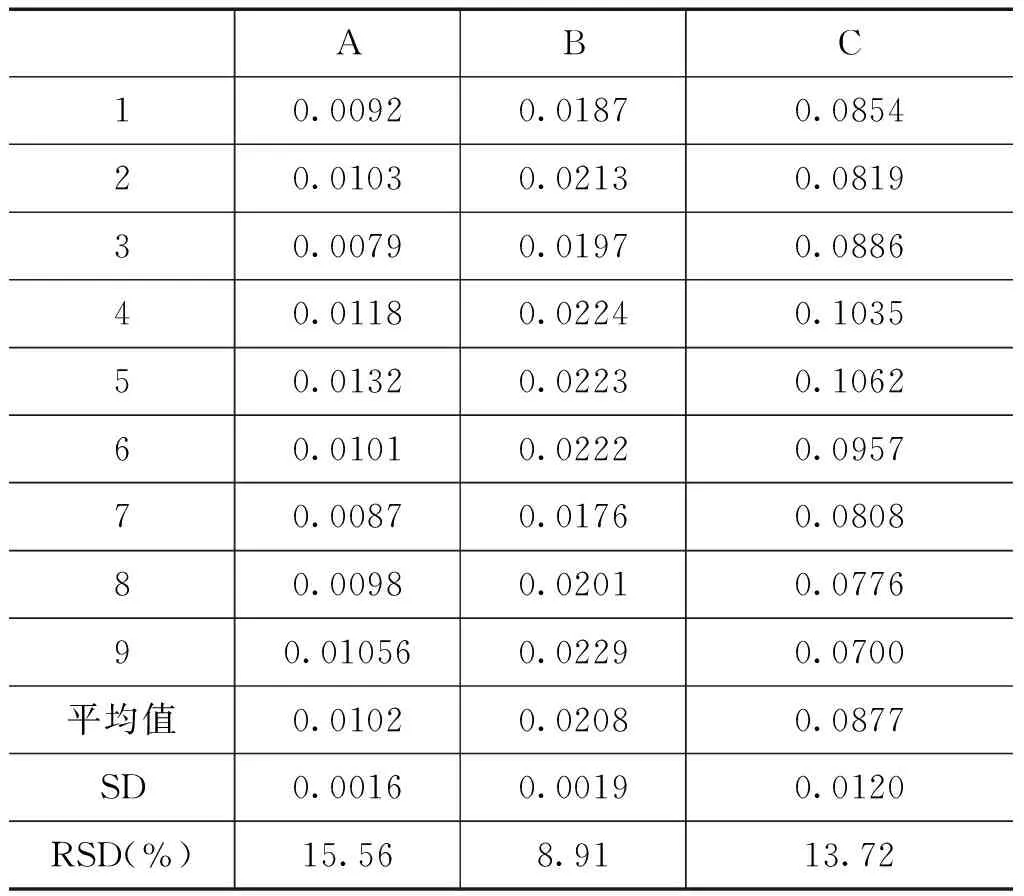
表3 转基因大豆GTS40-3-2定量PCR检测的重复性结果
2.2 协同实验结果
参与联合定值的各实验室分别对转基因大豆GTS40-3-2A、B、C三个水平的转基因玉米样品每种各三瓶进行测定,每瓶进行不少于3次的重复测试。各家实验室协同比对结果如表4~表6所示,参与实验室的室内标准偏差均达到了标准[5]。参与实验室使用了不同定量PCR仪器,主要为ABI系列和Roche。通过上述建立的PCR实验方法,各实验室不同的PCR仪器均得到了好的扩增效率和线性相关系数,进一步说明该定量PCR体系适用于不同的PCR仪器,具有很好的稳定性。

表4 转基因大豆GTS40-3-2基体标准物质水平A的协同实验结果
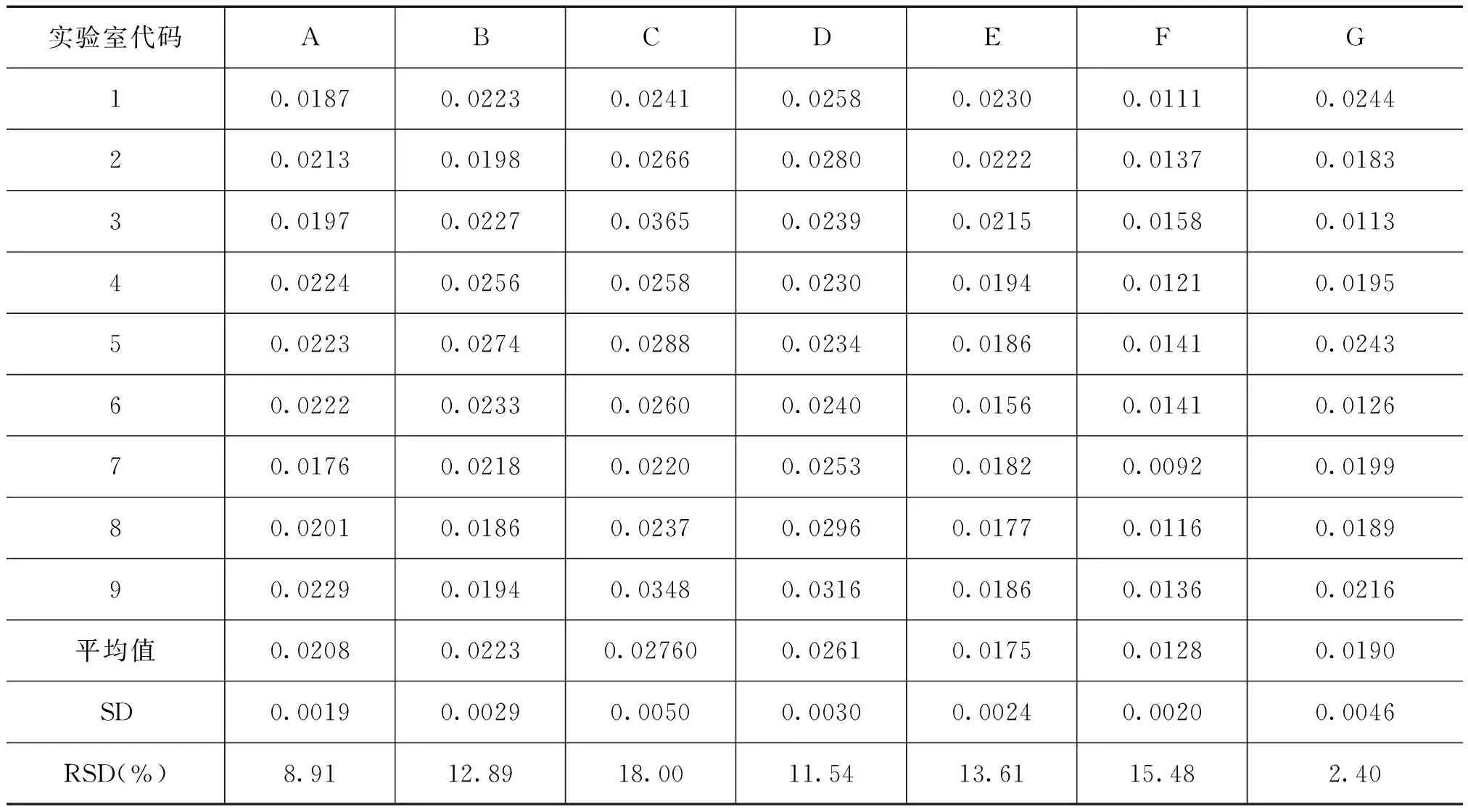
表5 转基因大豆GTS40-3-2基体标准物质水平B的协同实验结果
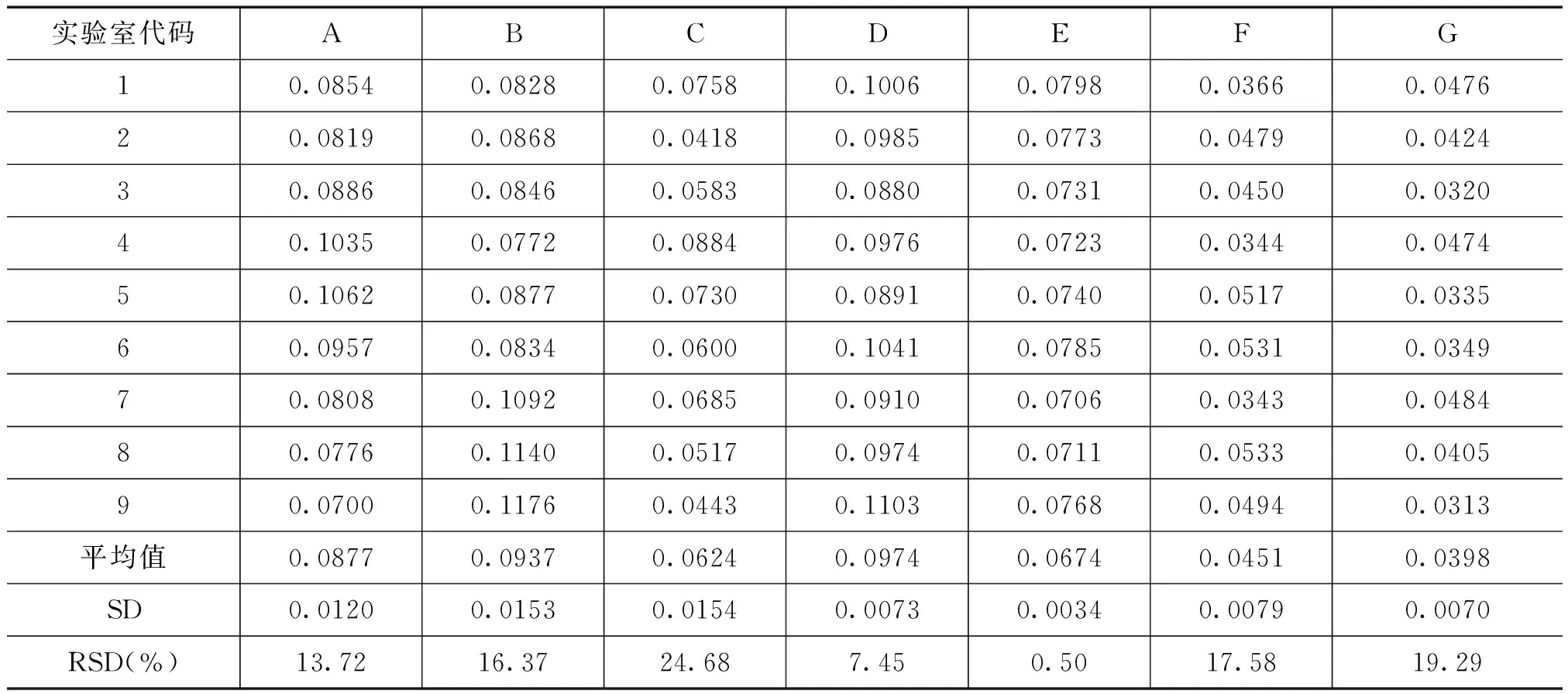
表6 转基因大豆GTS40-3-2基体标准物质水平C的协同实验结果
2.3 室间精密度分析
对各实验室返回的数据进行统计分析,转基因大豆GTS 40-3-2A、B、C三个水平的实验室间定量PCR的相对标准偏差分别为28.08%、24.29%、32.88%。根据格拉布斯准则从统计上剔除离群值后[6],重新进行室间精密度分析,转基因大豆GTS40-3-2A、B、C三个水平的实验室间定量PCR的相对标准偏差分别为22.72%、17.83%、27.24%。均小于35%,转基因大豆GTS40-3-2实时荧光定量PCR方法的室间精密度能够满足定量要求[5]。
3 不确定度评定
3.1 A类不确定度uA评定
该分量是通过测量数据的标准偏差、测量次数及所要求的置信水平按统计方法计算出的不确定度。通过剔除多家实验室定值结果中的离群数据之后,各实验室的数据平均值等精度,因此,A类不确定度的具体计算方法如下:
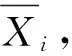
转基因大豆GTS 40-3-2的A,B,C三个含量水平的多家实验室量为:uA(A)= 0.001002;uA(B)=0.001618;uA(C)= 0.00841。
3.2 B类不确定度uB评估
B类不确定的主要来源包括:1)移液器带来的不确定度;2)标准溶液系列稀释带来的不确定度;3)内外源标准曲线扩增引入的不确定度;4)标准物质引入的不确定度。
3.3 均匀性的标准不确定度uH评估
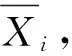
ν1=m-1
ν2=m(n-1)
经计算,A、B、C三个水平的均匀性的标准不确定度分别为:uH(A)=0.202%;uH(B)=0.380%;uH(C)=0.231%。
3.4 稳定性的标准不确定度uS评估
4℃储存条件下,6个月内在五个时间点上(0、1、2、4和6个月)对转基因大豆GTS40-3-2基体标准物质考察了稳定性。以稳定性考察的时间为x轴,以标准物质相应时间的特性值为y轴,拟合成一条直线。直线的斜率为b1,截距为b0。
斜率的不确定度s(b1)通过下式计算[8]:
稳定性对不确定度的贡献为:uS=s(b1)t
式中,t为稳定性的考察时长(月)。
转基因大豆GTS40-3-2基体标准物质稳定性分别产生的标准不确定度,A水平,uS=0.346%;B水平,uS=0.033%;C水平,uS=0.108%。
3.5 合成标准不确定度评定
考虑到四部分标准不确定度相互独立,根据下面公式合成标准不确定度。
A、B、C三个水平定值部分的合成标准不确定度分别为:
u(A)=0.41%,u(B)=0.41%,u(C)=0.91%
4 结论
对转基因大豆GTS40-3-2定量PCR方法进行了室内研究。组织了7家有资质实验室对转基因大豆GTS40-3-2A、B、C三个水平的基体标准物质进行了多家定值,对多家定值的数据进行了统计分析。经过统计分析得出,转基因大豆GTS40-3-2A、B、C三个水平的转基因含量及标准不确定度分别为:水平A定值结果为 1.08%,不确定度为0.82%(k=2,p=95%);水平B定值结果为 2.22%,不确定度为0.82%(k=2,p=95%);水平C定值结果为 7.56%,不确定度为1.82%(k=2,p=95%)。
[1] 钟金传,吴文良,夏友富.全球转基因大豆发展概况.生态经济,2005(10)
[2] Monsanto Company.Crop Year/Fiscal Year Financials:Consolidated Restatement Financials.http://www.monsanto.com/monsanto/layout/investor/crop_year/default.asp,2005
[3] Philippe Corbisier,Stefanie Trapmann,David Gancberg,Liesbeth Hannes,Pierre Van Iwaarden,Gilbert Berben,Heinz Schimmel,Hendrik Emons.Quantitative determination of Roundup Ready soybean (Glycine max)extracted from highly processed flour.Anal Bioanal Chem.2005,383(2),282-290
[4] Swiss Food Manual (Schweizerisches Lebensmittelbuch)
[5] European Network of GMO Laboratories.Definition of minimum performance requirements for analytical methods of GMO testing.2008
[6] ISO Guide 35:2006,Reference materials-general and statistical principles for certification
[7] 全浩,韩永志.标准物质及其应用技术(第二版)[M].北京:中国标准出版社,2003
[8] 中国标准物质管理委员会.标准物质定值原则和统计学原理[M].北京:中国质检出版社,2011
