抗结核治疗期间患者出现肝损伤相关症状 与致肝损伤的关系分析
2013-05-14房宏霞武珊珊吕晓珍夏愔愔詹思延
房宏霞 武珊珊 吕晓珍 夏愔愔 詹思延
在结核病疫情依然严重的今天,发现并治疗传染性肺结核患者是控制结核病疫情的最好办法。但在抗结核治疗过程中,有可能会出现不良反应[1],其中最严重、且发生频率最高的不良反应是肝损伤[2];患者出现肝损伤后如不能及早发现,继续使用抗结核药物,会加重肝脏负担,导致肝脏出现不可逆性损伤,甚至威胁患者生命。规律性肝功能监测可以及早发现肝损伤[3],专家建议应在开始治疗后1~2周查肝功能,此后治疗中应每月检查肝功能[4]。这对及早发现肝损伤,尤其是无症状的肝损伤患者(占肝损伤患者的33%以上[5])具有重要意义。但我国目前还有相当比例患者做不到定期检查肝功能。
部分患者在治疗过程中会出现不良反应症状,充分认识不良反应症状与肝损伤的关系,可以提高患者及督导其服药人员(简称“督导员”)对肝损伤的警觉,督促出现肝损伤相关症状的患者及时就诊,这对不能规律监测肝功能的患者来说更加重要。
为了解肺结核患者服用一线抗结核药物后肝损伤相关症状出现情况及其与肝损伤的关系,现对全球基金第一轮结核病控制项目实施性研究——中国结核病防治规划抗结核药品不良反应研究(anti-tuberculosis drugs induced adverse reactions in China national tuberculosis prevention and control scheme study,ADACS)资料中患者自填的随访日历资料和结局调查相关信息进行深入分析。
资料和方法
一、资料来源和研究对象
本研究资料来源于2007年5月至2009年2月实施的“全球基金第一轮结核病控制项目实施性研究——中国结核病防治规划抗结核药品不良反应研究(ADACS)”。
研究项目经中国结核病实施性研究伦理学委员会批准。在研究过程中遵守伦理学道德法则,在开始调查和检查前告知患者将要进行的内容,征得患者知情同意并签署知情同意书,将自愿参与调查者纳入研究对象,对于拒绝配合者将不作为研究对象。
研究采用多阶段分层整群抽样的方法,在广西壮族自治区、吉林省、浙江省、重庆市共抽取52个调查点,以现场研究期间(2007年10月至2008年6月)在当地接受标准短程化疗方案的所有新发涂阳肺结核患者作为研究对象,建立研究队列。患者签署知情同意书后,对其进行基线调查,同时免费检测服药前肝功能情况。尔后开始6~9个月的随访观察,在服药后1个月左右再次检测肝功能,并通过主动监测、患者随访记录、调查点不良反应监测中心报告等方式监测其肝损伤发生情况。为每例患者建立随访日历,记录其服药和不良反应症状出现情况。随访日历由课题组邀请国内结核病领域著名专家组成的专家组讨论后确定,内容包括结核病防治知识、随访日历使用方法、日历中不良反应症状编码、每天服药情况及不良反应症状出现情况。研究方案详见文献[6]。
本次研究对象纳入标准:(1)完成治疗;(2)接受6~9个月的随访;(3)在随访日历中报告了治疗过程中是否出现过不良反应症状或接受过其他不良反应调查;(4)签署知情同意。排除标准:患者症状开始于治疗前且开始治疗后无新症状出现。
在ADACS研究随访的4488例患者中,有4304例患者完成治疗,其中4080例患者符合纳入标准,但有15例患者根据排除标准被排除,本研究实际纳入分析肺结核患者4065例,回收合格随访日历4065份。
二、抗结核药物性肝损伤(ATLI)的判断标准[3,7]
1.ATLI检测方法:间隔2周以上、连续2次检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TB)>正常值上限(ULN),或单次检测ALT、AST、TB>2ULN;同时与抗结核药品的因果关系评价为肯定、很可能或可能者诊断为ATLI。
2.ATLI严重程度分级:(1)肝功能异常:1ULN<3项指标(ALT、AST、TB)≤2ULN;(2)轻度肝损伤:2ULN<2项指标(ALT、AST)≤3ULN,或(和)2ULN
三、数据收集、整理及质量控制方法
在ADACS研究中经过培训的当地CDC调查人员采取面对面调查的方式了解患者的基本信息,并记录整个治疗过程和治疗效果、实验室检测结果;治疗期间患者每天在随访日历中记录服药情况及服药后自身感觉,患者督导医生定期了解患者不良反应发生情况并检查随访日历填写情况,随访日历中记录90%以上服药日患者服药信息和不良反应症状出现情况者为合格。为保证调查资料的真实和准确,本研究建立中央、省、县三级质控系统,县级和省级对全部资料复核,中央级抽取10%的资料核查并在资料全部收集后,再次对资料进行审核,保证有效资料达到95%以上。
使用EpiData软件建立数据库,采用双人平行录入法由经过培训的资料录入人员将全部资料录入数据库并进行一致性复核和修正,研究人员抽取5%的资料进行复审,保证录入完整率和正确率均在95%以上,否则将对所有资料重新复核录入。对录入资料各项目有疑问者,与原始资料核对,以确保数据的准确性。
在对ADACS资料进一步核查的基础上,再次进行数据清理和逻辑查错,核查校正异常值、极端值,对其他不良反应调查问卷中报告症状而在随访日历中未记录者,按出现相应症状补充进随访日历;对所有“其他症状”逐一筛查,能归入各类症状中者按归入后结果分析;对缺失数据(由于其他不良反应调查问卷中不收集症状出现时间,后补充进随访日历症状的症状出现时间为缺失数据)按已经获得的各类症状出现时间的中位数进行填补。上述清理过程独立进行2次,并对2次结果进行一致性复核,对不一致数据根据清理原则进行更正。
四、研究指标及其分析方法
参考英国Walker等[8]的建议及唐神结等[9]的论著内容,本研究分析的肝损伤相关症状包括发热、恶心和(或)呕吐、乏力和(或)疲倦、皮疹和(或)瘙痒、腹部不适(包括腹泻、腹痛、腹胀、腹部不适)、食欲不振和(或)厌油腻和其他肝损伤相关症状(包括肝肿大、肝区压痛、皮肤或巩膜黄染及尿色加深)。其中前5种症状为随访日历中的症状分类,食欲不振和其他肝损伤相关症状自随访日历中的其他症状分离。由于肝掌、蜘蛛痣在本研究对象中没有出现,因此未将这些症状纳入分析。
结 果
一、研究对象总体特征及肝损伤相关症状出现情况
在4065例患者中,男2911例,占71.6%;女1154例,占28.4%。年龄10~87岁,平均年龄(42.7±16.5)岁。规律服药3646例(占89.7%),间断服药419例(占10.3%)。在治疗过程中始终双日服药者3589例(占88.3%),每日服药者73例(占1.8%),有403例(占9.9%)患者治疗过程中服药频度有改变。698例(占17.2%)患者有结核病治疗史,137例(占3.4%)患者有肝炎病史,乙肝病毒检测 HBsAg、HBsAb、HBeAg、HBeAb和HBcAb阳性者分别为219、22、5、13和35例。在4065例患者中,有1377例(占33.9%)出现肝损伤相关症状,各类患者出现肝损伤相关症状情况详见表1。
在1377例有肝损伤相关症状者中恶心发生率最高(70.8%,975/1377),其他依次为乏力(36.7%,505/1377)、皮疹(31.5%,434/1377)、腹部不适(28.1%,387/1377)、发热(13.8%,190/1377)、食欲不振(3.8%,53/1377)和其他肝损伤相关症状(2.0%,27/1377)。
在1377例出现肝损伤相关症状的患者中,91.1%(1255/1377)出现1~3种症状,其中48.4%的患者(666/1377)只出现单一症状,其中恶心出现比例最高,其次是皮疹,腹部不适和乏力并列第三位;27.7%的患者(382/1377)出现2种症状,15.0%(207/1377)的患者出现3种症状,6.7%(92/1377)的患者同时出现4种症状,2.0%(28/1377)的患者同时出现5种症状,0.1%(2/1377)的患者同时出现6种症状(表2)。
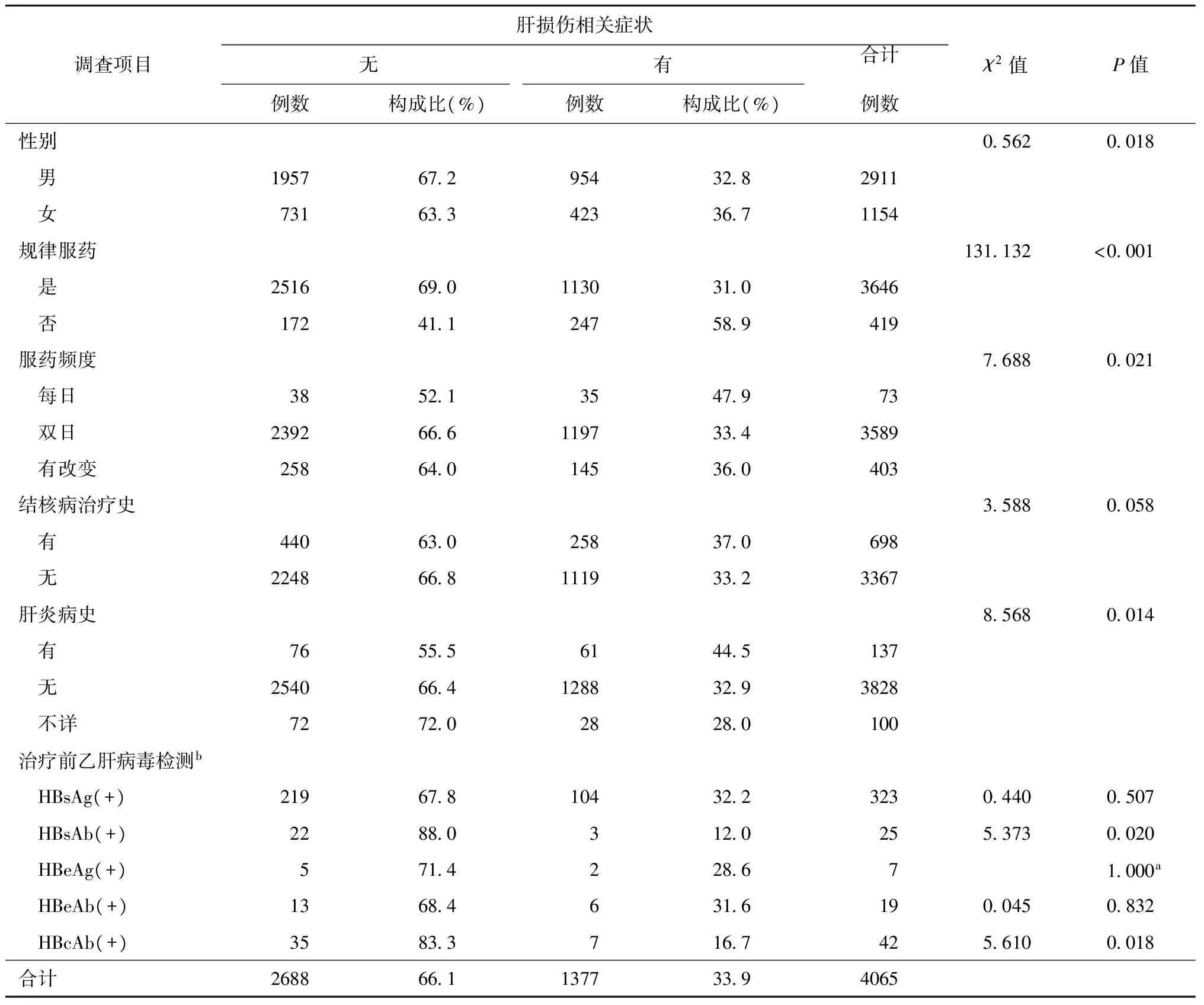
表1 不同调查项目中肝损伤相关症状出现情况
注a:为确切概率法计算结果,计算结果只有P值,没有检验统计量χ2值;b:只列出治疗前乙肝病毒检测阳性病例
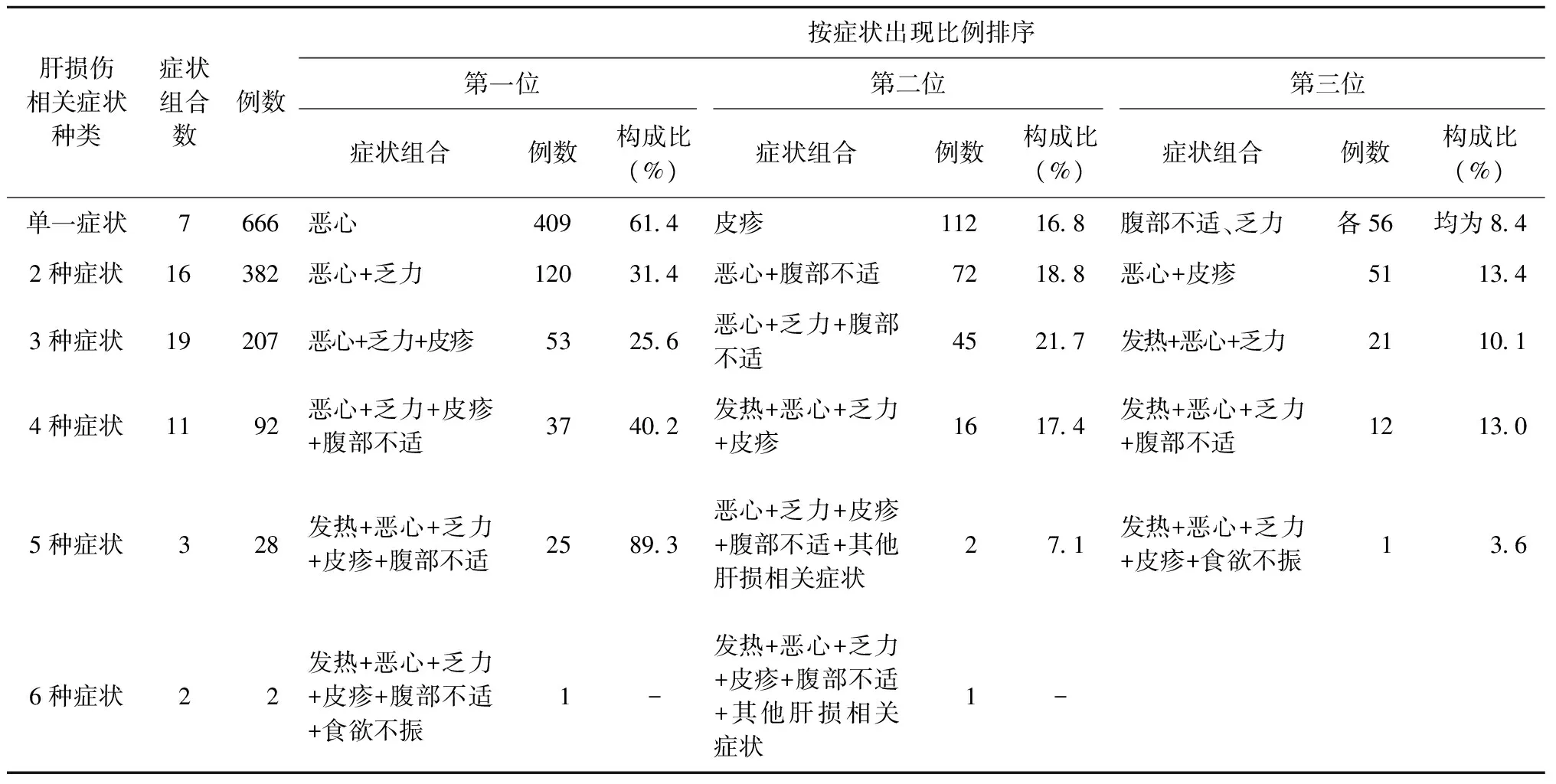
表2 抗结核治疗后不同肝损伤相关症状种类在1377例肺结核患者中的分布
注症状组合数:表示不同肝损伤相关症状种类中出现各类症状的数量;“-”表示由于总例数太少,统计构成比没有意义
因为食欲不振和其他肝损伤相关症状来自于随访日历中的其他症状,随访日历中记录的其他症状出现时间不能确定是这2种症状的,还是2种症状以外其他肝损伤相关症状的出现时间,因此在进行症状出现时间分析时,这2种症状未纳入分析。
从各种症状出现时间来看,在1377例有肝损伤相关症状的患者中,92.2%(1269/1377)的患者在治疗开始后60 d内出现症状, 治疗到症状出现时间间隔中位数(P25,P75)为6(1,18)d; 有10.6%(146/1377)的患者在治疗当天就出现症状,累计40.9%(563/1377)的患者肝损伤相关症状出现在治疗最初3 d内,累计72.5%(998/1377)出现在治疗最初2周内,累计92.2%(1269/1377)出现在强化期内。从不同症状来看,恶心出现较早,出现时间中位数为8(2,33)d,其次为腹部不适10(3,30)d;80.0%~88.8%的症状出现在强化期内(表3)。
二、有肝损伤相关症状患者的肝损伤发生情况
在4065例研究对象中有273例患者发生肝损伤,其中中~重度肝损伤120例(占44.0%)。在1377例有肝损伤相关症状者中有177例出现肝损伤,肝损伤发生率为12.9%(177/1377);其中83例为中~重度肝损伤,中~重度肝损伤发生率为6.0%(83/1377)。在2688例无肝损伤相关症状者中肝损伤发生率为3.6%(96/2688),中~重度肝损伤发生率为1.4%(37/2688)。有症状者发生肝损伤的危险度是无症状者的3.6倍(95%CI:2.9~4.5倍),发生中~重度肝损伤的危险度是无症状者的4.4倍(95%CI:3.1~6.2倍)。
从不同症状来看,患者中出现腹部不适、恶心、乏力、皮疹、食欲不振和其他肝损伤相关症状发生肝损伤和中~重度肝损伤的危险都高于无该症状者,其中食欲不振者肝损伤发生率最高,达77.4%(RR值=13.4;95%CI:10.5~17.1),其次是其他肝损伤相关症状 (55.6%,RR值=8.7;95%CI:5.7~13.2),二者均以中~重度肝损伤多见,发生中~重度肝损伤的危险度是无该症状者的27.5倍(95%CI: 21.2~35.7倍)和18.2倍(95%CI:12.1~27.3倍)。虽然出现发热症状者发生肝损伤的危险度与无该症状者间差异无统计学意义(χ2=0.14,P=0.713),但发热患者一旦出现肝损伤,85.7%为中~重度,发生中~重度肝损伤的危险度是无发热者的2.3倍(95%CI:1.3~4.0倍) (表4)。

表3 肺结核患者治疗后肝损伤相关症状出现时间分析

表4 肺结核患者治疗后出现肝损伤相关症状者的肝损伤发生情况
注a:RR值=有该症状者肝损伤发生率/没有该症状者肝损伤发生率;b:RR值=有该症状者中~重度肝损伤发生率/没有该症状者中~重度肝损伤发生率
讨 论
尽管患者自我报告的不良反应症状,也就是主诉信息可能不够准确[10],甚至有很大主观性,不同患者对症状和自身健康状况敏感程度不同,其报告的症状出现情况也会有较大差别;同时,患者虽知道出现了哪些不良反应症状,由于缺乏识别症状产生原因的能力,无法排除其他诱因的干扰。但患者主诉是临床诊疗过程中非常重要的部分之一,医务人员在对患者进行诊断和疗效观察时都需要倾听和参考患者主诉。
目前国内报道中关于抗结核药物性肝损伤内容多介绍肝损伤患者有哪些临床症状,以及如何处理[9,11],多以报告肺结核患者治疗后不良反应症状、肝损伤的临床特点、危险因素及诊疗为主[12-26],这些内容对临床医生具有非常重要的指导意义,但对督导员和患者指导作用有限。本研究从不良反应症状入手,分析患者抗结核药物治疗后肝损伤相关症状出现情况,以及出现症状患者发生肝损伤的风险,研究内容对督导员和患者来说更具指导意义。
本研究报告了肺结核患者服用抗结核药物后出现肝损伤相关症状的症状谱。虽然不同研究得到每种症状出现率不同,但本研究结果表明肝损伤相关症状中以恶心、呕吐等胃肠道症状出现率最高(24.0%),这与同样采用一线抗结核药物进行不住院抗结核药物治疗的内蒙古自治区监测结果接近(185例/858例,占21.56%)[27],而与采用住院治疗方案患者不良反应症状出现情况(胃肠反应117例/1222例,占9.6%)明显不同[24],这说明患者治疗后症状出现情况与其所采取的治疗方案关系密切。
本研究中肝损伤各相关症状80%以上出现在强化期内,与结核病专著[9]和文献报道[28]结果接近。从肝损伤的发生机制来看,抗结核药物引起的肝损伤主要为肝细胞中毒性损伤和过敏性损伤[29],临床上一般认为发生在2个月以内的不良反应属超敏反应可能性大(瘙痒、皮疹、恶心、呕吐、腹泻、发热等都有可能是超敏反应),发生在2个月以上者考虑毒性反应可能性大[11], 本研究中患者的肝损伤相关症状以超敏反应为主。
从肝损伤相关症状与肝损伤的关系来看,出现肝损伤相关症状者发生肝损伤和中~重度肝损伤的危险均高于无症状者,在除发热外的各研究症状中也同样得到类似的结论,说明肺结核患者治疗后一旦出现腹部不适、恶心、乏力、皮疹、食欲不振和其他肝损伤相关症状,提示其发生肝损伤的危险性增加。其中食欲不振和其他肝损伤相关症状者发生肝损伤和中~重度肝损伤的危险度分别是无该症状者的10余倍,应引起患者和督导员的高度重视。有条件的地区和患者,建议按医生要求定期复查肝功能;对于做不到定期复查肝功能者,当出现肝损伤相关症状,尤其是食欲不振和(或)厌油腻、其他肝损伤相关症状(包括肝肿大、肝压痛、皮肤或巩膜黄染及尿色加深)时,要及时复查肝功能,以尽早发现肝损伤并采取相应干预措施,避免严重肝损伤的发生。
一直以来,很少有人将发热作为抗结核药物性肝损伤的指示症状,本研究发现有发热症状者发生中~重度肝损伤的RR值达到2.279(95%CI:1.287~4.035),该值与出现腹部不适、恶心症状者发生中~重度肝损伤的RR值接近,高于乏力、皮疹症状者。尽管本研究只对发热症状进行描述性分析,不能据此确定发热为肝损伤的指示症状,但这一结果提示研究人员有必要对发热与中~重度肝损伤的关系进行深入研究,同时也提醒提医务人员对治疗过程中出现发热症状的肺结核患者应给予一定关注。
本研究为对现有数据的深入分析,随访日历中共收集9类症状和其他症状,本研究在确定肝损伤相关症状时,参考了Walker及唐神结等[8-9]的研究结果,纳入其中的5类症状和部分其他症状(食欲不振和其他肝损伤相关症状来自于随访日历的其他症状),力求选取的症状能反应肝损伤发生情况。也因为是对现有数据分析,随访日历中按类统计各种症状出现情况,患者也未标记其出现的症状是否还有其他诱因,因此本研究无法对同一类别内,如腹部不适类中的腹泻、腹痛、腹胀或腹部不适症状分别分析,也无法排除其他因素的干扰,这是本研究的一个局限。
通过患者记录随访日历方法得到的症状出现情况和症状出现时间要比患者复诊时通过医生询问方式获得的数据更容易避免回忆偏倚,信息也更准确一些。但随访日历毕竟为患者自己记录,虽主治医生和督导员定期检查,仍难免会出现漏记情况,本研究中也有少量患者症状信息来自于其他不良反应调查表,这是本研究的又一个局限。
志谢感谢吉林省疾病预防控制中心结核病防治所袁燕莉、重庆市结核病防治所胡代玉、广西壮族自治区疾病预防控制中心结核病防治所刘飞鹰、浙江省疾病预防控制中心结核病防治所王晓萌与钟节鸣在数据复核过程中给予的大力支持和帮助!
参 考 文 献
[1] 屠德华. 正确认识和处理抗结核药品的不良反应. 中国防痨志, 2008, 30(4):269-270.
[2] 夏愔愔,詹思延. 国内抗结核药物不良反应发生率的综合分析. 中华结核和呼吸杂志, 2007, 30(6):419-423.
[3] Wu SS, Xia YY, Lv XZ, et al. Effect of scheduled monitoring of liver function during anti-tuberculosis treatment in a retrospective cohort in China. BMC Public Health, 2012, (12):454.
[4] 高微微,李琦,高孟秋,等. 特殊人群结核病防治. 北京: 科学出版社, 2011:19.
[5] Shang PH, Xia YY, Liu FY, et al. Incidence, clinical features and impact on anti-tuberculosis treatment of anti-tuberculosis drug induced liver injury (ATLI) in China. PLoS One, 2011, 6(7):e21836.
[6] Xia YY, Hu DY, Liu FY, et al. Design of the anti-tuberculosis drugs induced adverse reactions in China National Tuberculosis Prevention and Control Scheme Study (ADACS). BMC Public Health, 2010, (10):267.
[7] Tostmann A, Boeree MJ, Aarnoutse RE, et al. Antituberculosis drug-induced hepatotoxicity: Concise up-to-date review. J Gastroenterol Hepatol, 2008, 23(2):192-202.
[8] Walker NF, Kliner M, Turner D, et al. Hepatotoxicity and antituberculosis therapy: time to revise UK guidance? Thorax, 2009, 64(10):918.
[9] 唐神结,高文. 临床结核病学. 北京: 人民卫生出版社, 2011: 195.
[10] 代小秋,刘民. 症状监测的研究进展. 国际流行病学传染病学杂志, 2009, 36(5):317-320.
[11] 马玙,朱莉贞,潘毓萱. 结核病. 北京:人民卫生出版社, 2006: 561-568.
[12] Lv XZ, Tang SW, Xia YY, et al. NAT2 genetic polymorphisms and anti-tuberculosis drug-induced hepatotoxicity in Chinese community population. Ann Hepatol, 2012, 11(5):700-707.
[13] Tang SW, Lv XZ, Zhang Y, et al. CYP2E1, GSTM1 and GSTT1 genetic polymorphisms and susceptibility to antituberculosis drug-induced hepatotoxicity: a nested case-control study. J Clin Pharm Ther, 2012, 37(5):588-593.
[14] 钟芳红, 肖会玲, 张天华. 板式抗结核组合药物所致肝损害监测分析. 延安大学学报(医学科学版), 2011, 9(2):56-57,59.
[15] 石富国, 古明, 马世平. 一线主要抗结核药不良反应分布特点文献分析. 中国药物警戒, 2011, 8(7):434-437.
[16] 卢水华, 王琳, 肖和平. 抗结核药物性肝损害. 医药导报,2011, 30(6): 767-769.
[17] 刘士敬. 抗结核药物引发的肝损害. 中国社区医师, 2011,(20):12.
[18] 安慧茹, 吴雪琼, 王仲元,等. 抗结核药物引起药物性肝损害的临床特点分析. 四川医学,2011, 32(5):633-636.
[19] 苏长海, 季晖, 卢立山, 等. 抗结核药物不良反应及其危害. 中国医院药学杂志, 2010, 30(2):176-178.
[20] 陈福敏, 陈勃江, 周晓晴, 等. 318 例抗结核性药物所致肝功能损害的临床分析. 西部医学,2010, 22(5):889-890.
[21] Sun F, Chen Y, Xiang Y, et al. Drug-metabolising enzyme polymorphisms and predisposition to anti-tuberculosis drug-induced liver injury: a meta-analysis. J Tuberc Lung Dis, 2008, 12(9):994-1002.
[22] 安慧茹,吴雪琼. 抗结核药物性肝损害研究进展. 中国抗生素杂志,2010, 35(10): 727-733
[23] 殷素素,何钟宓. 抗结核药物致肝损害116 例临床分析. 华西医学, 2008, 23(5): 1065-1067.
[24] 谢莉,高微微,卜建玲,等. 702 例抗结核药物所致不良反应分析. 中国防痨杂志,2008, 30(4):275-278.
[25] 江岚. 446 例肺结核患者应用抗结核药物引起肝损害的临床分析. 黑龙江医学, 2008, 32(12):924-926.
[26] 王静, 屠德华, 李波, 等. 北京市一线抗结核药品不良反应发生情况及其对化疗工作的影响. 中国防痨杂志,2008,30(4):271-274.
[27] 樊辰霞, 任育麟, 冯贷, 等. 内蒙古自治区抗结核药物不良反应监测结果分析. 疾病监测与控制, 2010, 4(8):473-475.
[28] 中华结核和呼吸杂志编委会. 抗结核药物引起的副作用综合报告. 中华结核和呼吸杂志, 1998, 21(1):40-43.
[29] 严碧涯,端木宏谨. 结核病学. 北京: 北京出版社, 2003:1153-1165.
