“复瓣玫瑰红”组织培养快繁体系的建立
2013-05-11刘建民薛其勤李美芹吕金浮裴华丽
刘建民,薛其勤,李美芹,吕金浮,裴华丽,乔 宁
(潍坊科技学院蔬菜花卉研究所,山东 寿光 262700)
“复瓣玫瑰红”组织培养快繁体系的建立
刘建民,薛其勤,李美芹*,吕金浮,裴华丽,乔 宁
(潍坊科技学院蔬菜花卉研究所,山东 寿光 262700)
以“复瓣玫瑰红”茎段为外植体,进行腋芽取材时期、腋芽节径、培养基中无机盐离子浓度、不同激素配比和组培苗驯化移栽试验。结果表明:“复瓣玫瑰红”蔷薇取材的最佳时期是5月和11月,所取材料是当年生枝条的中间部分,采用1/2MS为基本培养基并添加0.1 mg/L NAA+1.0 mg/L6-BA的激素组合腋芽萌发效果最好,其萌发率最高可达100%;腋芽分化的最佳培养基为:1/2MS+0.2 mg/LNAA+2.0 mg/L6-BA,增殖系数达到8.3;最佳生根培养基为1/2MS+0.1 mg/L NAA+0.2 mg/L 6-BA组合,生根率可达97.1%;组培苗移栽时,以纯蛭石为基质,先将生根瓶苗移至炼苗室进行9 ~ 13 d的移栽前锻炼,并保持雾状喷水,移栽成活率可达80.0%。
“复瓣玫瑰红”蔷薇;组织培养;快速繁殖
蔷薇属蔷薇科(Rosaceae)蔷薇属(Rosa)植物,是世界著名的观赏植物之一,其花色鲜艳、芳香浓郁,在我国园林绿化中应用普遍[1~2]。“复瓣玫瑰红”蔷薇是潍坊科技学院蔬菜花卉研究所选育的新品种。该品种的适应性、抗病性强,花型大、花期长、颜色鲜艳,具有较高的观赏价值、经济价值及应用前景。
蔷薇通常采用嫁接、扦插、组培等方法进行繁殖。采用嫁接和扦插进行该品种快繁,其繁殖系数较低,而采用组织培养技术繁殖,既可以得到整齐一致的无性系繁殖材料,又能提高繁殖系数,而且不受繁殖材料的限制,可在短期内获得大量苗木。目前国内外已有不少关于蔷薇属植物的组培报道[3~5],但有关蔷薇组培的报道较少,有关蔷薇组培快繁体系还不完善,存在着诱导率、增殖系数和生根率低等问题;并且不同品种的蔷薇所要求的组培条件差异较大[6~8]。因此有必要开展”复瓣玫瑰红”蔷薇组培快繁体系的研究,建立成熟的繁殖体系,为新品种的推广应用奠定基础。
本研究对影响“复瓣玫瑰红”蔷薇组织培养快繁的因素进行探讨,主要从腋芽的取材时期、腋芽节位、培养基中无机盐离子浓度和激素配比等对”复瓣玫瑰红”蔷薇组培快繁的影响,建立一套“复瓣玫瑰红”蔷薇高效离体快繁技术体系。
1 材料和方法
1.1 试验材料
取潍坊科技学院试验田内培养的当年生”复瓣玫瑰红”蔷薇茎段,分别取上、中、下部腋芽为外植体。
1.2 试验方法
1.2.1 外植体的消毒与初代培养 取当年生枝条,剪去叶片,用吐温-20和清水冲洗3 ~ 5次,分上(完全未木质化)、中(半木质化)、下(完全木质化)3种腋芽,剪成含有一个腋芽的茎段,做好标记,分别处理:先后浸于75%的酒精中10 s、0.1%HgCl2溶液中20 min,进行表面消毒,再用无菌水漂洗4次。用无菌滤纸吸干外植体多余的液体,用已消毒处理过的手术刀切去每个带芽茎段的两端,腋芽朝上竖插,接种于初代培养基上,每日13 h,在25℃、光照3 000 lx下培养,促使腋芽萌发。
1.2.2 不同取材时期对蔷薇腋芽萌芽的影响 2011年5-11月,分别于5、7、9、11月的上旬,于晴朗的上午采蔷薇植株当年生新梢。接种于1/2MS+0.1 mg/L NAA+1.0 mg/L 6-BA的诱导培养基上,每个处理接种外植体数目为30个,重复2次。20 d后统计腋芽萌发率,其计算公式如下:
腋芽萌发率% =(腋芽萌发的带芽茎段数/接种的带芽茎数)×100%
1.2.3 无机盐离子浓度对腋芽萌发的影响 于2011年9月上旬,取“复瓣玫瑰红”蔷薇当年抽出的新枝条,从枝条顶端开始分成上、中、下3种腋芽,剪成带有一个腋芽的茎段,接种于添加0.1mg/L NAA和l.0mg/L6-BA的MS、1/2MS、1/4MS培养基上,每种材料接种数目30个,重复2次,20 d后统计腋芽萌发率。
1.2.4 诱导培养基的激素组成对蔷薇腋芽萌发和丛生芽诱导的影响 将消毒处理的茎段接种于含有 NAA和6-BA组合的1/2MS诱导培养基上。每处理接种30株外植体,重复2次。20 d后统计腋芽萌发率。
初代培养分化的不定芽和直接分化的试管苗长到2 ~ 3 cm时,将其纵切分成单株,之后每株再分成单芽接种于添加NAA和6-BA组合或者添加NAA和IBA组合的增殖培养基上(见表1)。每瓶接种6个,每个处理每次接种5瓶(30个芽),重复2次。培养30d后,统计每个处理的新生芽数,增殖系数计算公式如下:
增殖系数 = 新生芽数/原来接种芽数
1.2.5 无菌苗的壮苗与生根培养 当再生小苗长到3 ~ 4 cm时,切取单株幼苗,接种于添加0.1 ~ 0.7 mg/L NAA、0.5 ~ 4 mg/LIBA和0.1 ~ 0.4 mg/L6-BA的1/2MS培养基诱导生根,长成完整植株。每个处理接种20株幼苗,重复2次,30 d后统计生根率和根系生长情况。
生根率 =(已生根的苗数/接种的组培苗数)×100%
1.2.6 驯化与移栽 待试管苗在生根培养基内长出5 ~ 6条、长1 ~ 3 cm的粗壮根时,进行试管苗的驯化移栽。移栽前先将生根瓶苗移至炼苗室9 ~ 13 d,进行移栽前的锻炼,使其适应外界的光照、温度。移栽试验在温室中进行,选用3种基质,分别为蛭石、珍珠岩、蛭石+珍珠岩(1:1)。将小苗从瓶内取出,洗净附着在根上的培养基,栽植于3种基质中。移入基质后,保持雾状喷水,使环境相对湿度保持在90 %以上,无需设置保温保湿的小环境,一周后喷施营养液。60 d后可移栽至大田,统计成活率。
成活率 =(已成活的苗数/移栽的总苗数)×100%
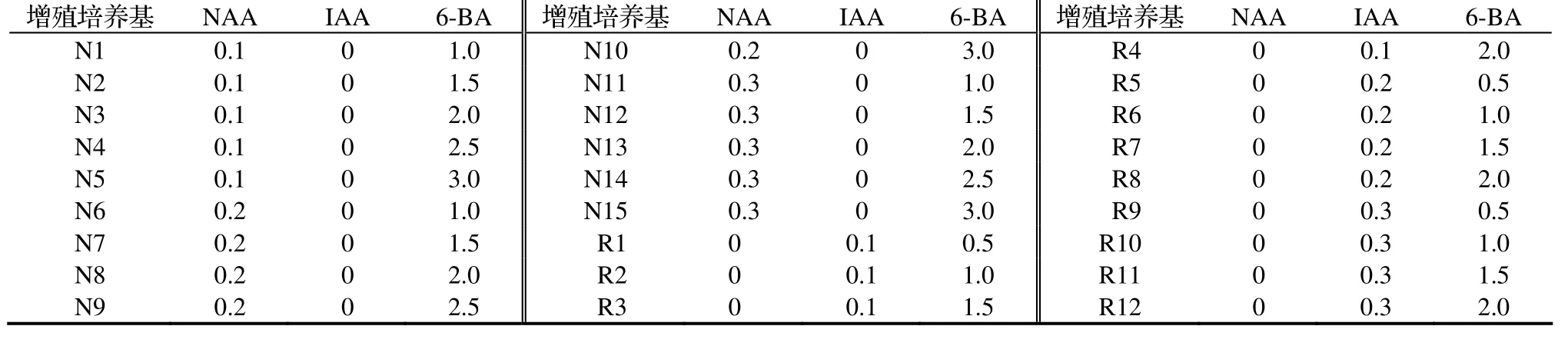
表1 增殖培养基的类型Table 1 Types of medium for multiplication mg/L
2 结果与分析
2.1 初代培养
2.1.1 不同取材时期对腋芽萌发的影响 由图1可见,接种材料的采集时期较为显著地影响腋芽的萌发,以5月和11月采集的枝条萌发效果较好,萌芽率分别达到90.32%和98.21%;7月最低,其萌芽率为68.49%。原因是5月初田间蔷薇刚刚萌动,体内养分充足,激素水平适宜于芽的萌发;11月蔷薇体内充分积累养分,腋芽非常饱满。所以,11月是取材的最好时期,并且在11月取的材料培养5 d后就开始萌发,萌发所需时间最短,且生长旺盛。在此试验中,整体发芽率普遍较高,可能是因为选用的培养基较适于萌发的原因。
2.1.2 无机盐离子浓度对腋芽萌发的影响 由图2可以看出,无机盐浓度显著影响腋芽的萌发,基本培养基为1/2MS时,3种腋芽的萌发率都是最高。接种材料的腋芽部位对其萌发效果影响显著,以枝条的中间位置,也就是半木质化枝条的腋芽萌发效果最好,在1/2MS培养基上萌芽率为89.9%;而木质化部分最低,在1/2MS培养基上萌芽率为 67.3%。半木质化枝条的腋芽萌发率高,是由于半木质化枝条上腋芽的分生能力强、内源激素水平利于芽萌发。
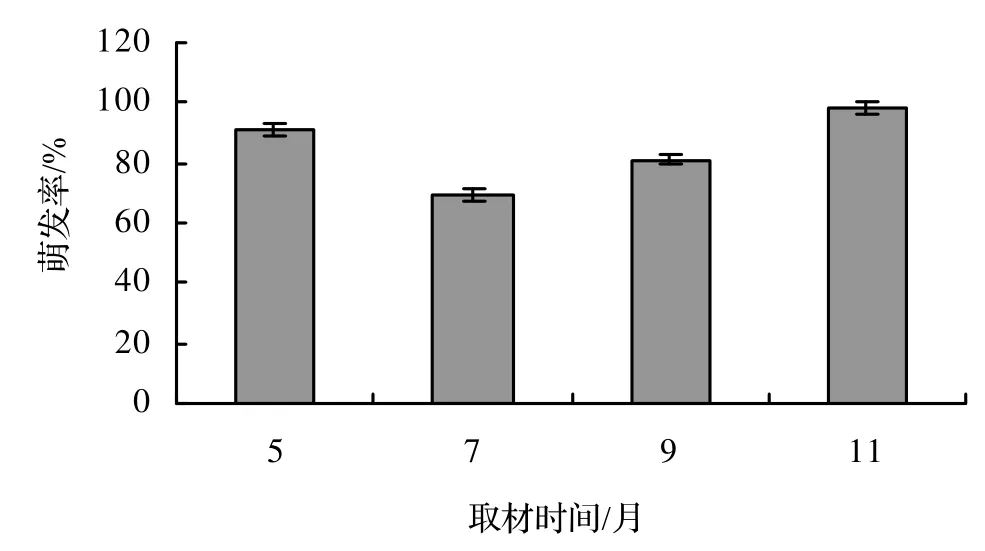
图1 不同取材时间对腋芽萌发的影响Figure 1 Effect of sampling time on germination of bud

图2 不同无机盐离子浓度对腋芽萌发的影响Figure 2 Effect of different medium on germination of bud
2.2 诱导培养基的激素组成对腋芽萌发和丛生芽诱导的影响
2.2.1 诱导培养基的激素组成对蔷薇腋芽萌发的影响 由表2可以看出,激素及其配比显著影响腋芽萌发,NAA浓度为0.1mg/L时,腋芽萌发率较好,其中以l/2MS+0.1 mg/L NAA+1.0 mg/L 6-BA的组合最好;而l/2MS+ 0.1 mg/L NAA+2.0 mg/L 6-BA和l/2MS+0.1 mg/L NAA+3.0 mg/L 6-BA的组合,其腋芽萌发率也较高,但萌发出的小苗玻璃化现象较为严重,尤其是l/2MS+0.1 mg/L NAA+3.0mg/L 6-BA组合。NAA浓度为0.2 mg/L时,腋芽萌发率达88%左右,其萌发率不及NAA浓度为0.1 mg/L的组合,并且也有部分小苗出现玻璃化现象。
2.2.2 不同激素配比对蔷薇丛生芽诱导的影响 由图3可以看出,在NAA和6-BA组合中,l/2MS+0.2 mg/L NAA+2.0 mg/L 6-BA的组合,其腋芽增殖效果最好,增殖系数达到8.3,生长旺盛;其次是l/2MS+0.3 mg/L NAA +1.0mg/L 6-BA的组合,其增殖系数为7.8。NAA在0.1 mg/L的水平上,6-BA的浓度为3 mg/L时,增殖系数最高;并且随着6-BA浓度的增加,其增殖系数有升高的趋势,但再生苗的玻璃化现象加重。NAA在0.2 mg/L的水平上,随6-BA浓度的升高,增殖系数呈先增后减的趋势,6-BA的浓度在2 mg/L的水平上增殖系数最高,并且再生苗的叶色墨绿、生长正常。NAA在0.3 mg/L的水平上,6-BA的浓度在1 mg/L的水平上增殖系数最高,随着6-BA浓度的升高,增殖系数呈现下降的趋势。6-BA在1 mg/L的水平上,随NAA浓度的增加,其增殖系数有升高的趋势;6-BA在1.5 ~ 2.5mg/L的水平上,随NAA浓度的增加,增殖系数呈先增后减的趋势,其中以1.5 mg/L最为显著;6-BA的浓度在3 mg/L的水平上,随NAA浓度的增加,增殖系数呈现下降趋势。
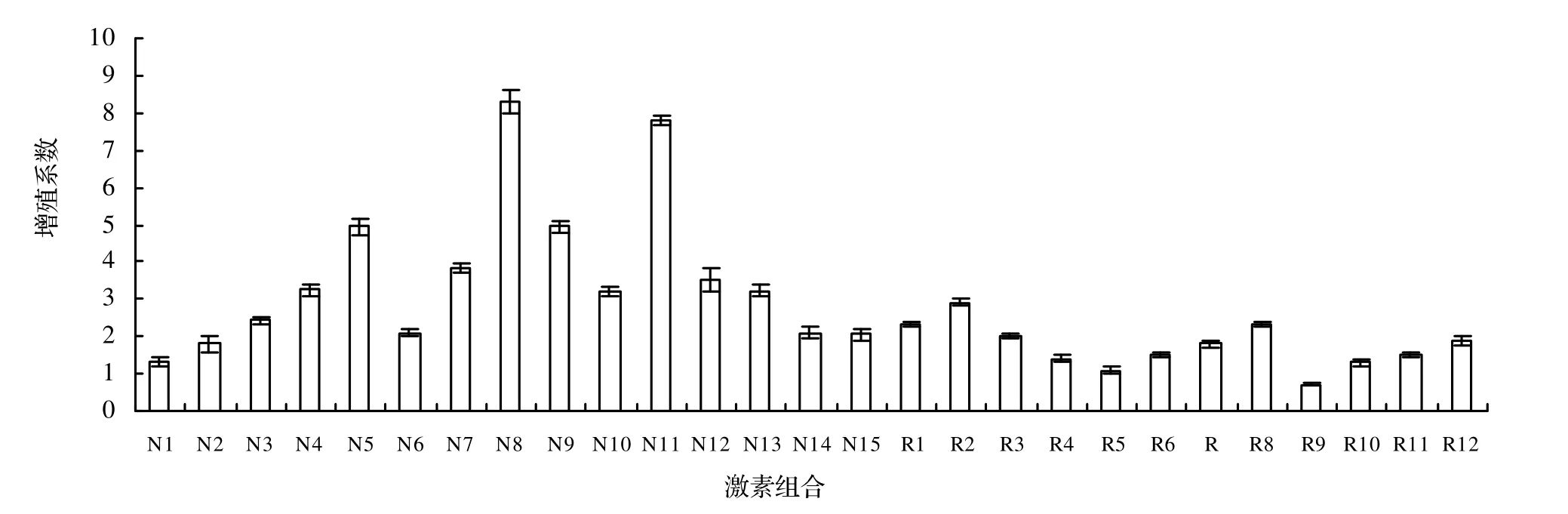
图3 不同激素组合对丛生芽诱导的影响Figure 3 Effect of different hormones ratio on induction of clump shoot
在IAA和6-BA的组合中,l/2MS+0.1 mg/L IAA+1.0 mg/L 6-BA的组合最好,其增殖系数为2.9。在IAA为0.1 mg/L的水平上,随着6-BA浓度的升高,增殖系数呈现先增后减的趋势。IAA在0.2和0.3 mg/L的水平上,随6-BA浓度的升高,增殖系数呈现增高的趋势,但总体增生系数都较低。6-BA在0.5 ~ 1.5 mg/L的水平上,随IAA浓度的增加,增殖系数呈现下降的趋势;6-BA的浓度在2.0 mg/L的水平上,随IAA浓度的增加,增殖系数呈现先增后减的趋势。
总之,本试验组合中,NAA和6-BA组合增殖效果优于IAA和6-BA组合。
2.3 壮苗生根培养
2.3.1 激素配比对壮苗生根培养的影响 从表3中可以看出,当只添加NAA时,随着NAA浓度的增大,生根率有降低的趋势,愈伤组织的呈加重趋势。在NAA和6-BA的组合中,NAA在0.1 mg/L的水平上时,整体生根率最高,其中1/2MS+0.1 mg/L NAA+ 0.2 mg/L 6-BA组合生根率最高;NAA在0.3 ~ 0.7 mg/L的水平上时,随6-BA浓度的增大,生根率有上升的趋势,但总体上还是随NAA浓度的增加,生根率下降。在NAA和IBA的组合中,NAA在0.1 mg/L的水平上时,整体生根率水平最低,并随IBA浓度的升高,生根率有降低的趋势;NAA在0.3 mg/L的水平时,整体生根率最高,其中1/2MS+0.3 mg/L NAA+2 mg/L IBA组合生根率最高;NAA在0.5 ~ 0.7 mg/L的水平时,随IBA浓度的增大,生根率有上升的趋势,但总体上还是随NAA浓度的增加,生根率下降。
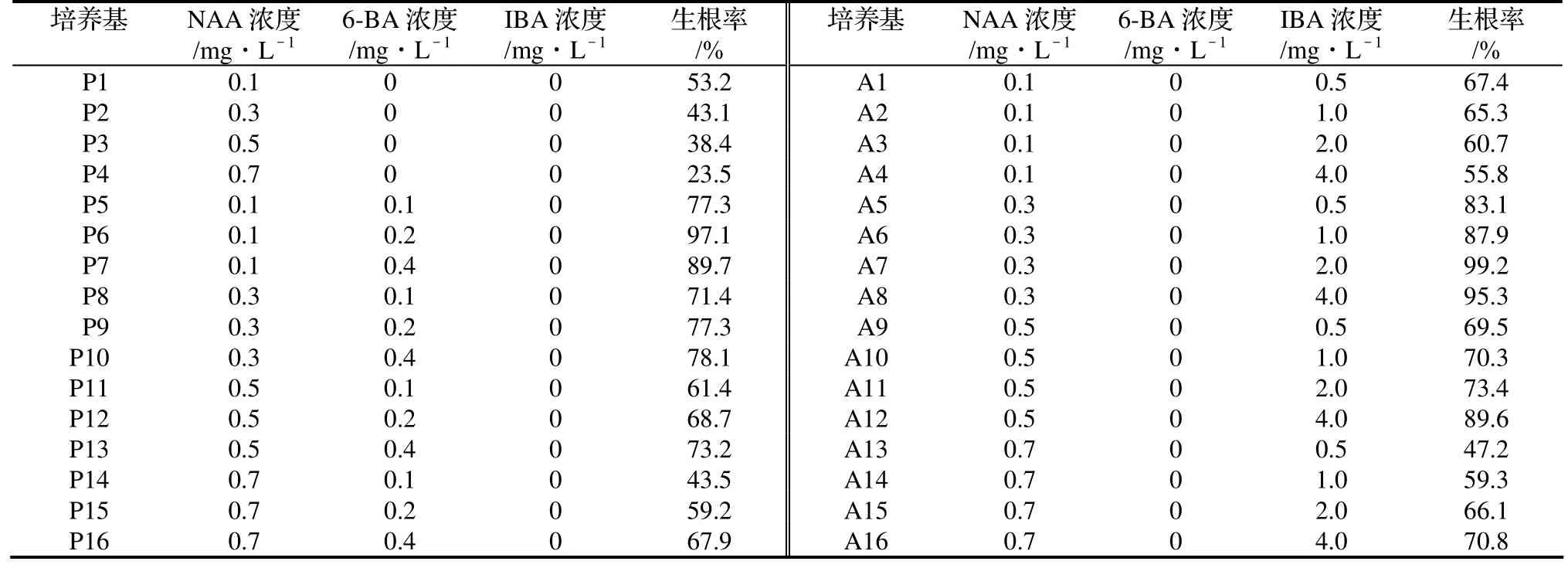
表3 不同激素及其配比对不定根形成的影响Table 3 Effect of different hormones and ratio on rooting rate
2.4 组培苗的驯化与移栽
在生根培养基内培养20 d即可形成较健壮的根,平均每株可生根8 ~ 12条,根长1 ~ 3 cm,株高4.0 ~ 7.0 cm,此时可准备移栽。移栽前先将生根瓶苗移至炼苗室9 ~ 13 d,进行移栽前的锻炼。
在移栽试验中,以纯蛭石为基质移栽成活率最高,为80%以上;蛭石:珍珠岩(1:1)成活率为72%;以珍珠岩为基质,移栽成活率低于前二者。从珍珠岩与蛭石的物理性能看,蛭石吸水性及保水性均优于珍珠岩;色深,吸热性能好;质地比珍珠岩致密,散热慢,基质温度、尤其是夜间温度高,有利于新根的形成。
试管生根苗,移入基质后,保持雾状喷水,相对湿度保持在90%以上,一周后喷施营养液。本移栽试验证明,其移栽成活率可达80%以上,60 d后可移栽至大田。
3 结论
试验结果表明,“复瓣玫瑰红”蔷薇的组织培养快速繁殖体系的建立受多种因素的限制,外植体的取材时期和部位、培养基的无机盐离子浓度、激素组成对其组织培养快繁体系的建立具有显著影响。
“复瓣玫瑰红”蔷薇取材的最佳时期是5月和11月,所取材料是当年生枝条的中间部分,采用1/2MS为基本培养基并添加0.1mg/L NAA+1.0 mg/L6-BA的激素组合腋芽萌发效果最好,其萌发率最高可达100%,腋芽分化的最佳培养基为:1/2MS+0.2 mg/LNAA+2.0 mg/L6-BA,增殖系数达到8.3。生根试验表明,采用1/2MS为基本培养基并添加0.1mg/L NAA+0.2 mg/L 6-BA组合生根率最高,可达97.1%。组培苗移栽时,以纯蛭石为基质,先将生根瓶苗移至炼苗室进行9 ~ 13 d的移栽前锻炼,并保持雾状喷水,移栽成活率可达80.0%。
[1] 俞德俊. 中国植物志[M]. 北京:科学出版社,1985. 360-455.
[2] Wu Z Y, Hong D Y. Flora of China(9)[M]. Beijing:Science Press,2001. 339-382.
[3] 丁雪珍. 大马士革蔷薇的组织培养与快速繁殖[J]. 山东林业科技,2008,38(3):51-52.
[4] 田传卫,尚爱芹,张建甫,等. 多花蔷薇假珠芽诱导、体细胞胚发生及植株高效再生[J]. 园艺学报,2008,35(3):403-408.
[5] 陈正华. 木本植物组织培养及其应用[M]. 北京:高等教育出版社,1986. 307-308.
[6] 刘根林,梁珍海,朱军. 活性炭在植物组织培养中的作用概述[J]. 江苏林业科技,2001,28(5):46-48.
[7] 李青,苏雪痕,李湛东. 藤本月季组织培养快繁研究[J]. 北京林业大学学报,1999,21(6):17-21.
Establishment of Rapid in-vitro Propagation System for Rosa multiflora var. ‘multipetal Rose-red ’
LIU Jian-min,XUE Qi-qin,LI Mei-qin*,LU Jin-fu,PEI Hua-li,QIAO Ning
(Weifang University of Science and Technology, Shouguang 262700, China)
Experiments were conducted on effect of sampling time, explants types, different cultures and different hormones ratio on rapid in-vitro propagation of Rosa multiflora var. ‘multiprtai Rose-red’ using the stem segment as the explant. The results showed that the best sampling time was in May and November, the best stem segment was the semi-lignified branches in the middle of the shoots. The germination rate of bud topped to 100% when the medium was 1/2MS supplemented with 0.1mg/L NAA and l.0mg/L 6-BA. The optimal medium for multiplication of adventitious buds was 1/2MS supplemented with 0.2mg/L NAA and 2.0mg/L 6-BA, and the multiplication coefficient was up to 8.3. The best medium for rooting was 1/2MS supplemented with 0.1mg/L NAA and 0.2mg/L 6-BA, and the rooting rate was up to 97.1%. The conservation rate after transplanting reached up to 80.0% using the pure vermiculite as substrate after 9-13 days acclimatization, and keeping mist spray.
Rosa multiflora var. ‘multiprtai Rose-red’; rapid propagation; tissue culture in vitro
S723.1+32.6
B
1001-3776(2013)05-0057-05
2013-04-29;
2013-06-19
山东省高等学校科技计划项目(J10LC78)
刘建民(1968-),男,山东寿光人,副教授,从事植物生物技术研究;*通讯作者。
