肺疾病的超声诊断
2013-05-06戴九龙
戴九龙
肺疾病的超声诊断
戴九龙
肺疾病;超声检查;综述
空气对超声波的传导性较差,因而含气良好的肺组织是超声显像的盲区[1],但若肺组织发生病变,则不仅可以显像,还可能具有一定的声像特征,为诊断提供重要信息。肺疾病的系统性超声诊断在国内开展相对较少,主要集中在胸腔积液探查和引导穿刺、周围型肺肿瘤引导活检等方面,但在国外尤其是发达国家,应用超声检查诊断各类肺疾病已成为临床研究和应用热点。近年来人们对放射性电离辐射损伤的关注度增加,迫切需要寻找一种无创技术来部分或完全替代胸部X线或胸部CT,以减少不必要的放射线暴露,尤其是减少新生儿、婴幼儿和儿童等敏感人群或发育阶段人群的早期放射线暴露。超声作为一项成熟、安全、无创的影像学诊断方法,在合理运用现有常规技术的基础上,能够诊断多种肺疾病。本文拟对超声诊断肺疾病的发展现状作一综述。
1 肺急性感染性病变
发生急性支气管肺炎和大叶性肺炎时,支气管管壁、肺泡壁水肿增厚,各级支气管管腔及肺泡腔被炎性物质充填,腔内气体部分或完全消失。肺炎病灶基本保持正常良好充气时的形态。支气管肺炎(图1)病变区域一般呈类实性低回声,其内可见正常走行的支气管管壁、支气管动脉壁,呈等号状强回声或管状强回声;若支气管管腔内仍有气体,则可见强回声,有时伴彗尾征,可影响后方管壁的显示,由于支气管、肺泡未完全阻塞,因而在呼吸时,气体强回声的位置和数量可发生变化,这是支气管肺炎声像图的重要特征;若支气管腔内仅含炎性物质或炎性渗液,则呈低回声或无回声,后者称为含液支气管征[2]。大叶性肺炎(图2)病变区域一般呈实性中等回声,与肝实质回声相似,其内亦可见正常走行的支气管,管腔内常充满炎性物质而无气体,少见彗尾征形成,故病变区域的层次结构较支气管肺炎更为清晰。急性肺炎是超声检查的良好适应证,Parlamento等[3]对49例疑似肺炎患者行超声和胸部X线检查,32例确诊为肺炎,超声诊断率(96.9%, 31/32)远高于胸部X线检查(75.0%, 24/32)。Copetti等[4]对79例疑似肺炎患儿行超声和胸部X线检查,超声诊断阳性率为75.9%(60/79),亦高于胸部X线的67.1%(53/79)。Cortellaro等[5]纳入120例样本,超声诊断肺炎的敏感度和特异度分别为98.0%、95.0%,高于胸部X线的67.0%、85.0%。常规超声检查及超声造影均可以应用于肺炎的诊断。Reissig等[6]研究发现典型肺炎病灶在行超声造影时,动脉期快速强化,实质期均匀强化,延迟期仍见造影剂存留,强化时间可达90 s以上。
肺脓肿是肺部炎症的特殊表现形式,当脓肿形成时,病变区域可以探及范围较大的无回声区,可单发亦可多发,有时可见液平。
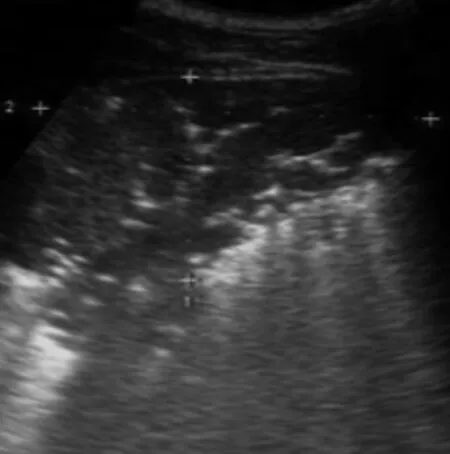
图1 右下肺小叶性肺炎(支气管肺炎),横切面显示病变区呈稍低回声。小支气管内残存气体,呈短条状、树枝状强回声
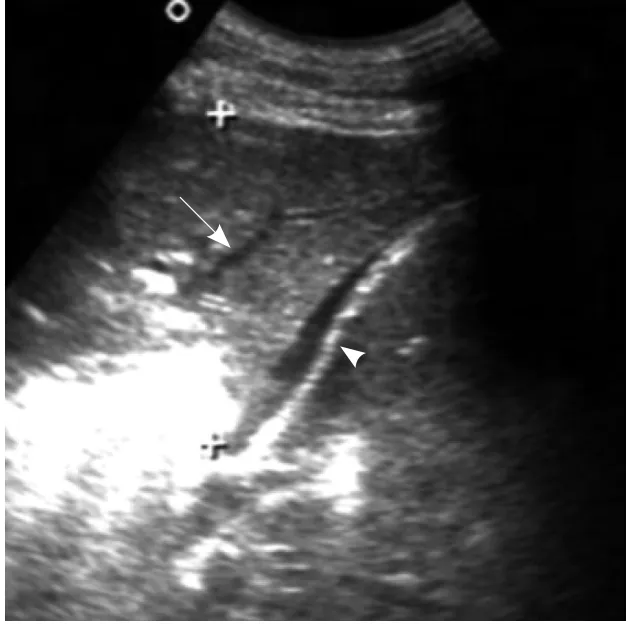
图2 大叶性肺炎肝变期,纵切面显示右肺下叶实变。肺叶呈充盈形态,但气体强回声完全消失,内部呈肝实质样中等回声,并显示正常走行的血管结构。箭示肺,箭头示肝
2 周围型肺动脉栓塞和肺梗死
CT肺血管成像是目前诊断肺动脉栓塞和肺梗死的最佳影像学方法[2]超声亦有良好表现,超声诊断周围型肺梗死的敏感度达80.0%~94.0%,特异度达84.0%~92.0%,总体准确率达82.0%~91.0%[7-9]。典型的周围型肺梗死病灶表现为单发或多发的低回声区,基底面对胸膜,尖端指向肺门,由于解剖或血流动力学的原因,约2/3的周围型肺梗死位于后基底段,尤其好发于右肺[2]。低回声区与周围肺组织有良好的分界,多呈三角形或楔形,也可呈其他形状。一项纳入352例样本的多中心前瞻性研究报道,约58.0%的病灶为尖端指向肺门的三角形,42.0%的病灶呈圆形或三角形与圆形的混合形态,同时49.0%的病例合并少量胸膜腔积液[10]。虽然声像图上低回声区边界较为清晰,但由于病灶深部边缘存在气体伪像,可能遮盖部分病灶,因而低回声区的边界不一定是病灶的真实边界,故临床上常见超声所见病灶小于CT所见病灶的情况[10]。彩色多普勒血流显像示肺梗死灶内部不显示血流信号,即无血流灌注的肺实变(图3)[11],可与其他疾病所致肺实变相鉴别。

图3 周围型肺梗死,病变区呈三角形,基底面对胸膜。彩色多普勒血流显像示病变区未见血流显示
3 肺肿瘤
超声可以显示周围型肺肿瘤并获得大量的诊断信息,并引导穿刺活检,以取得最终病理诊断。周围型支气管肺癌常显示为边界相对清晰的圆形或椭圆形实性低回声结节(图4),有时也可以为多囊性结节[12],内部回声均匀或不均匀[2]。肿块内不显示含气支气管征。当肿瘤内部有坏死时,病灶内出现无回声区,并在超声造影时更确切地显示为无灌注区。浸润性生长、胸膜牵拉、胸膜腔积液等声像均提示恶性可能,胸膜牵拉时,可见胸膜增厚凹陷,胸膜与病灶互相制约导致二者随呼吸的活动度均下降。若肿块不随呼吸运动,说明可能侵犯超过脏层胸膜,亦高度提示恶性可能。胸膜线中断、肋骨侵蚀、胸壁结构破坏等声像均是肿块浸润生长的表现[2]。彩色多普勒血流显像不能区别肿瘤的良恶性[2],但超声造影对鉴别肿瘤良、恶性有一定帮助,典型的周围型肺癌表现为不同程度的延迟强化,与其血供主要来源于支气管动脉有关[13-15]。近来利用超声对肺癌进行诊断和TNM分期取得了初步进展[16]。周围型良性肿瘤相对少见,一般表现为边界清晰、形态规则、回声均匀的实性肿块,无浸润性、破坏性生长的特点。
有恶性肿瘤病史者发现1个或多个肺内结节常强烈提示肺转移。螺旋CT是诊断肺转移癌的最佳影像学方法[2]。超声缺乏对肺实质的整体观,在诊断肺转移癌方面有一定的局限,但超声能够发现细小的周围病灶并引导穿刺活检,对诊断有一定帮助[17]。

图4 周围型肺癌,病灶呈类圆形,大部分位于肺内,小部分突向肺外,呈不均质高回声。由于大量胸膜腔积液压迫,肿瘤外肺组织呈压缩型实变
4 气胸
超声检查气胸时,受检者一般取仰卧位,探头垂直于前胸壁探查。正常肺组织呼吸时脏、壁两层胸膜产生滑动现象,称为“胸膜滑动征”,可被动态观察。发生气胸时,气体进入胸膜腔,分开脏、壁两层胸膜,导致胸膜滑动征消失,是诊断气胸的要点之一[1]。此外,声波在气体-胸壁表面反射,形成彗尾征,使积气区仅见大量强回声水平线(图5),也是重要征象之一[1,18]。部分性气胸诊断较为困难,常需将探查范围自前胸壁扩展到侧胸壁,利用M型超声寻找正常肺声像与气胸声像的交界点,称为肺点(图5)[19]。虽然超声可以明确诊断气胸,但其无法了解积气的厚度(仰卧位时的前后径),因而不能判断气胸程度、肺组织压缩量[1]。此外,检查者需经过专门培训以识别特殊的声像表现。
5 弥漫性肺实质病变
弥漫性肺实质病变可以分为已知病因的疾病(如肺胶原血管病)、未知病因的特发性肺间质病变(如特发性肺纤维化、肺肉芽肿)、急性肺水肿等,这些疾病不仅累及肺泡间隔及小叶间隔,也常累及胸膜,故可以在超声上显像[1]。肺部超声一般将此类病变归为肺泡-间质综合征,探及垂直胸膜的B线是特征性的声像表现。B线也称彗尾征,是一种基于胸膜线向深部扩大并延伸至屏幕边缘的强回声振铃伪像,有时在正常肺组织也可探及1~2条B线,而超过2条B线则对诊断弥漫性肺实质病变有重要意义,B线数量的多少与肺含气量消失的程度有关,而回声强度则随吸气增强[20,21]。B线实质上代表病变肺组织间的含气肺组织。多条B线间的距离>7 mm常是肺间质水肿等所致小叶间隔增厚引起的特征性声像(图6),≤3 mm常是肺泡性肺水肿的特征性声像,对应X线或CT上所见毛玻璃样变[21]。对B线的探查及其性质的判断已应用于急诊、ICU对患有弥漫性肺疾病的孕妇等需要尽量减少或避免放射线暴露的人群[1]。
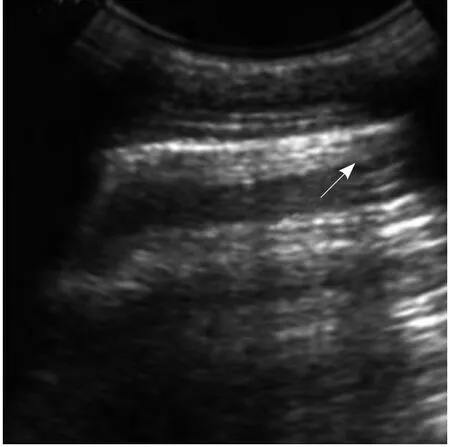
图5 气胸。声像图显示肺点(箭)。气体反射形成较多平行强回声线
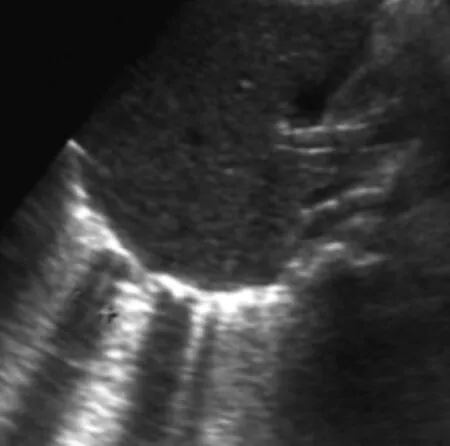
图6 间质性肺水肿,B线之间距离>7 mm
6 成人和新生儿呼吸窘迫综合征
成人呼吸窘迫综合征和新生儿呼吸窘迫综合征的主要特点是弥漫性肺泡受累及肺实质病变[1]。超声探查时,患者一般取仰卧位,在上腹部分别以肝右叶和脾为透声窗探查右肺和左肺。多数正常人在这一切面显示干净的膈-胸膜-肺界面声像,少数在膈上形成肝、脾的镜面伪像,表现为近似肝、脾的均匀中等回声,极少数人可出现1~2条较短的B线。而成人或新生儿呼吸窘迫综合征患者则可由混响效应形成膈上极强回声反射,为本病的典型声像。振铃伪像形成的B线也是典型声像之一,出现在实变肺组织旁的含气肺组织处(图7)[22]。Bober等[23]对131例有呼吸衰竭表现的新生儿行超声检查,诊断新生儿呼吸窘迫综合征的敏感度为100%,特异度为92.0%。尽管目前超声诊断成人和新生儿呼吸窘迫综合征仍处于初步研究阶段,但超声的重要价值已得到证实[22,23]。

图7 新生儿呼吸窘迫综合征,于右肋缘下斜切,声像图显示膈上大量强回声B线
7 肺不张
肺不张主要分为压缩性和阻塞性肺不张,前者常见原因为中至大量胸膜腔积液或气胸、血气胸等,后者常见原因为肿瘤、慢性炎症、异物等。典型的压缩性肺不张病灶呈实性低回声,常漂浮在液性无回声区内。病区仍有部分通气,吸气时低回声区内可以出现气体强回声。典型的阻塞性肺不张病灶回声类似肝脏(图8),与肺炎的声像表现相似,由于进气道阻塞,病区支气管腔内无气体强回声。管腔内可见分泌物充填,表现为含液支气管征。超声实时监测,阻塞性肺不张病灶在吸气时无气体进入,而肺炎病灶在呼吸时可见动态变化的支气管含气征,这一点鉴别二者的特异度可达94.0%[24]。

图8 肺癌并阻塞性肺不张,声像图显示带声晕的中等回声肿块。肿块外周肺组织阻塞性实变,气体强回声消失,呈较均匀中等回声
成人或儿童行肺部超声检查一般取卧位,若检查气胸,可取半卧位或坐位。婴幼儿由于配合度有限,需由成人怀抱安抚后取坐位、立位探查。扫查前应熟悉病史并进行常规肺部听诊、叩诊,重点探查感兴趣区。探头一般与肋间隙平行以获得最佳切面,但在观察胸膜滑动征时,应使探头与肋间隙垂直,即探头长轴与人体长轴一致。
尽管超声诊断肺疾病有较高的准确率,但也存在一定的局限性。①超声无法显示含气良好的肺组织,对纵隔组织的显示也难以令人满意,若病变位于纵隔附近或被含气良好的肺组织包围,则可能无法探及;②声像图难以提供肺的整体结构图;③目前对病变所在位置难以进行准确分叶、分段。
总之,超声检查在多种肺疾病的诊断中有重要价值,临床上可作为肺部常规检查。超声对于减少婴幼儿、儿童、孕妇等特定人群的放射线暴露十分有益。对于病史和病情简单的患者,可以考虑将超声列为首选影像学检查;亦可考虑先用X线或CT检查等对肺内病变进行诊断和整体评估,再用超声对特定病灶进行动态观察,了解病情变化和治疗效果。对常规影像学诊断困难的肺内病变,超声可引导穿刺活检等介入操作,对肺癌等患者,超声亦可引导化疗药物灌注、冷冻、射频消融等介入操作。
[1] Bolliger CT, Herth FJF, Mayo PH, et al. Clinical chest ultrasound: from the ICU to the bronchoscopy suite. Prog Switzerland: Karger, 2009: 11-20.
[2] Sartori S, Tombesi P. Emergency roles for transthoracic ultrasonography in pulmonary diseases. World J Radiol, 2010, 2(6): 203-214.
[3] Parlamento S, Copetti R, Di Bartolomeo S. Evaluation of lung ultrasound for the diagnosis of pneumonia in the ED. Am J Emerg Med, 2009, 27(4): 379-384.
[4] Copetti R, Cattarossi L. Ultrasound diagnosis of pneumonia in children. Radiol Med, 2008, 113(2): 190-198.
[5] Cortellaro F, Colombo S, Coen D, et al. Lung ultrasound is an accurate diagnostic tool for the diagnosis of pneumonia in the emergency department. Emerg Med J, 2012, 29(1): 19-23.
[6] Reissig A, Görg C, Mathis G. Transthoracic sonography in the diagnosis of pulmonary diseases: a systematic approach. Ultraschall Med, 2009, 30(5): 438-454.
[7] Mathis G, Bitschnau R, Gehmacher O, et al. Chest ultrasound in diagnosis of pulmonary embolism in comparison to helical CT. Ultraschall Med, 1999, 20(2): 54-59.
[8] Reissig A, Heyne JP, Kroegel C. Sonography of lung and pleura in pulmonary embolism: sonomorphologic characterization and comparison with spiral CT scanning. Chest, 2001, 120(6): 1977-1983.
[9] Lechleitner P, Riedl B, Raneburger W, et al. Chest sonography in the diagnosis of pulmonary embolism: a comparison with MRI angiography and ventilation perfusion scintigraphy. Ultraschall Med, 2002, 23(6): 373-378.
[10] Mathis G, Blank W, Reissig A, et al. Thoracic ultrasound for diagnosing pulmonary embolism: a prospective multicenter study of 352 patients. Chest, 2005, 128(3): 1531-1538.
[11] Reissig A, Kroegel C. Transthoracic ultrasound of lung and pleura in the diagnosis of pulmonary embolism: a novel noninvasive bedside approach. Respiration, 70(5): 441-452.
[12] Beckh S, Bölcskei PL, Lessnau KD. Real-time chest ultrasonography: a comprehensive review for the pulmonologist. Chest, 2002, 122(5): 1759-1773.
[13] Görg C. Transcutaneous contrast-enhanced sonography of pleural-based pulmonary lesions. Eur J Radiol, 2007, 64(2): 213-221.
[14] Sperandeo M, Sperandeo G, Varriale A, et al. Contrastenhanced ultrasound (CEUS) for the study of peripheral lung lesions: a preliminary study. Ultrasound Med Biol, 2006, 32(10): 1467-1472.
[15] Görg C, Kring R, Bert T. Transcutaneous contrast-enhanced sonography of peripheral lung lesions. Am J Roentgenol, 2006, 187(4): W420-W429.
[16] Prosch H, Mathis G, Mostbeck GH. Percutaneous ultrasound in diagnosis and staging of lung cancer. Ultraschall Med, 2008, 29(5): 466-478.
[17] Sartori S, Tombesi P. Emergency roles for transthoracic ultrasonography in pleuropulmonary pathology. World J Radiol, 2010, 2(2): 83-90.
[18] Lichtenstein D, Mezière G, Biderman P, et al. The comet-tail artifact: an ultrasound sign ruling out pneumothorax. Intensive Care Med, 1999, 25(4): 383-388.
[19] Lichtenstein D, Mezière G, Biderman P, et al. The "lung point": an ultrasound sign specific to pneumothorax. Intensive Care Med, 2000, 26(10): 1434-1440.
[20] Lichtenstein D, Goldstein I, Mourgeon E, et al. Comparative diagnostic performances of auscultation, chest radiography, and lung ultrasonography in acute respiratory distress syndrome. Anesthesiology, 2004, 100(1): 9-15.
[21] Lichtenstein D, Mézière G, Biderman P, et al. The comet-tail artifact. An ultrasound sign of alveolar-interstitial syndrome. Am J Respir Crit Care Med, 1997, 156(5): 1640-1646.
[22] Gardelli G, Feletti F, Gamberini E, et al. Using sonography to assess lung recruitment in patients with acute respiratory distress syndrome. Emerg Radiol, 2009, 16(3): 219-221.
[23] Bober K, Swietliński J. Diagnostic utility of ultrasonography for respiratory distress syndrome in neonates. Med Sci Monit, 2006, 12(10): CR440-CR446.
[24] Lichtenstein D, Mezière G, Seitz J. The dynamic air bronchogram. A lung ultrasound sign of alveolar consolidation ruling out atelectasis. Chest, 2009, 135(6): 1421-1425.
R563;R445.1
2011-11-30
2012-10-16
(责任编辑 张春辉)
10.3969/j.issn.1005-5185.2013.08.021
广州医学院2011级同等学力研究生班 广东广州 510182
戴九龙 E-mail: savagery2006@163.com
