PRL-3促进子宫内膜腺癌细胞侵袭能力
2013-05-05姜国成姜彦多
姜国成 明 健 姜彦多
•论著•
PRL-3促进子宫内膜腺癌细胞侵袭能力
姜国成 明 健 姜彦多
目的 探讨肝再生磷酸酶(PRL-3)在子宫内膜腺癌细胞中的表达及其与子宫内膜腺癌细胞迁移和侵袭的关系。方法应用逆转录-聚合酶链式反应(RT-PCR)和Western方法检测了PRL-3在2种子宫内膜腺癌细胞系中的表达情况,并在两种细胞中转染PRL-3 siRNA 24、36、48、60和72 h后检测PRL-3的表达情况。同时应用transwell小室观察抑制PRL-3后,两种细胞侵袭能力的变化。采用独立t检验比较实验组与对照组间PRL-3的结果的差异。结果PRL-3在2种子宫内膜腺癌细胞系中均高表达。在两种细胞中,转染PRL-3 siRNA 36 h后,PRL-3表达最低(P < 0.01),并进一步发现,转染后HEC-1-B和AN3 CA细胞迁移[细胞数为(18.67 ± 7.49)个、(15.96 ± 8.42)个,与各对照组比较,t值分别为5.23 ~ 6.45、3.32 ~ 5.33间,P均= 0.000];转染后HEC-1-B和AN3 CA细胞侵袭[细胞数为(4.67 ± 0.98)个、(3.89 ± 1.09)个,与各对照组比较,t值分别为4.86 ~ 6.98、4.36 ~ 5.64间,P均= 0.000]。结论PRL-3在子宫内膜腺癌细胞中高表达,且下调PRL-3能够抑制细胞迁移和侵袭能力。
PRL-3; 子宫内膜肿瘤; 腺癌; 肿瘤侵润
【Key words】Phosphatase of regenerating liver-3; Endometrial neoplasms; Adeno carcinoma; Neoplasm invasiveness
“肝再生磷酸酶3(phosphatase of regenerating liver-3,PRL-3)是一种蛋白酪氨酸磷酸酶,通过调节蛋白质分子酪氨酸残基的磷酸化,调控蛋白质活性,它参与多种细胞生命活动。Saha等[1]筛选结直肠原发癌与肝转移灶的差异表达基因时发现,正常结直肠组织、良性腺瘤和结直肠癌原发灶中,PRL-3基本不表达或低表达,而在肝转移灶中均高表达,因此推测,该基因与结直肠癌的转移相关。随后许多学者相继发现PRL-3在乳腺癌、卵巢癌、肠癌、肺癌和胃癌等肿瘤中呈现高表达并与其转移密切相关[2-7]。但在子宫内膜腺癌细胞中PRL-3表达如何,其表达与子宫内膜腺癌细胞迁徙和转移是否存在相关性尚未见报道。本研究应用逆转录-聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR) 和 Western blot方法检测了2种子宫内膜腺癌细胞中PRL-3的表达情况,并对PRL-3影响子宫内膜腺癌细胞迁移和侵袭进行了初步的研究。
材料与方法
一、细胞培养
冻存于液氮的细胞经复苏后,子宫内膜腺癌细胞HEC-1-B和AN3 CA细胞用MEM(minimum essential medium,MEM,Gibco,USA)培养液(含有10﹪新生牛血清,100 U/ml的青霉素和100 μg/ml的链霉素),在37℃、5﹪CO2饱和湿度条件下培养。
二、RT-PCR
提取细胞总RNA,按RT-PCR(TaKaRa)试剂盒方法进行逆转录反应,反应体系为 20 μl,取 4 μl的 RT产 物 进 行 PCR反应,反 应 体 系 为 20 μl。PCR引 物 经 在GeneBank上比对后在 bio-spring公司合成。F:5'-GGGACTTCTCAGGTCGTGTC-3',R:5'-AGCCCCGTACTTCTTCAGGT-3'片段长度 245 bp。β-actin F:5'-AAATCGTGCGTGACA TTAA-3',R:5'-CTCGTCATACTCCTGCTTG-3',片段长度:513 bp。PCR产物琼脂糖凝胶电泳进行检测,采用凝胶成像分析系统进行半定量分析。
三、Western Blot法
在收集的细胞内加入裂解液充分裂解,低温高速离心(4℃,12000 r/min,30 min),提取上清为总蛋白。上样蛋白量为60 μg。电泳(12﹪SDS-PAGE凝胶)、转印(50V,120 min)、5﹪正常小牛血清封闭,一抗PRL-3(1:100)和β-actin(1:200)(美国Santa Cruz公司),4℃孵育过夜,分别与各自对应的二抗(1:2500,美国chemicon公司)室温孵育2 h,DAB显色,结果经自动电泳凝胶成像分析仪(Chemi Imager 5500,美国Alpha Innotech公司)采集,进行灰度值测定。
四、RNA干扰
用LipofetamineTM 2000(美国Invitrogen公司)将20 μmol/L PRL-3 siRNA(美国Santa Cruz公司)转染入6孔板中HEC-1-B和AN3 CA细胞中为RNA提取和transwell备用。实验分4组:Untreated为未加任何处理因素的细胞(对照1组),Empty为只转染LipofetamineTM 2000的细胞(对照2组),scramble为转染乱码序列的细胞(对照3组),sense为转染PRL-3 siRNA的细胞(PRL-3组)。其中对照组细胞为(untreated、empty和scramble)。每个实验均重复3次,转染具体步骤按LipofectamineTM2000(美国Invitrogen公司)试剂说明书进行。
五、细胞迁移和侵袭能力检测
在transwell小室(美国Corning公司)下室加入600 μl含10﹪小牛血清培养基,上室中加入100 μl无血清培养基,接种细胞数为2.5 × 104个。37℃、5﹪CO2孵箱中培养6 h后吸净培养基,PBS清洗后,甲醇室温固定15 min,用棉签轻擦掉微孔膜上表面的细胞,苏木素染色,室温干燥过夜。取下微孔膜,置载玻片上,镜下观察。细胞侵袭能力的测定用预冷的无血清培养基以1:7稀释Matrigel(美国BD Biosciences公司)加入上室100 μl,在室温下放置6 h。使用前用培养基重新水化并吸净,其他与迁移实验相同,培养18 h后观察结果。
六、统计学分析方法
采用SPSS13.0统计分析软件,WesternBlot和RT-PCR表达结果及迁移和侵袭细胞数采用s表示,各实验组与对照组间比较采用独立t检验,以P < 0.05为差异有统计学意义。
结 果
一、PRL-3在2种子宫内膜腺癌细胞系中的表达
为了明确子宫内膜腺癌细胞中PRL-3的表达情况,本研究用RT-PCR和Western相对定量的方法检测了2种子宫内膜腺癌细胞HEC-1-B和AN3 CA细胞中PRL-3的表达情况。结果显示,2种子宫内膜腺癌细胞细胞中PRL-3均高表达(图1)。
二、在HEC-1-B和AN3 CA细胞中转染PRL-3 siRNA的时效性
为了确定PRL-3 siRNA在子宫内膜腺癌细胞中沉默PRL-3表达的最佳效率,在PRL-3 siRNA 0、24、36、48、60、72 h后,用RT-PCR相对定量的方法检测了PRL-3的表达情况。结果发现,转染36 h时,PRL-3表达最低(P < 0.01,图2)。
三、阻断PRL-3能抑制HEC-1-B和AN3 CA细胞迁移和侵袭能力
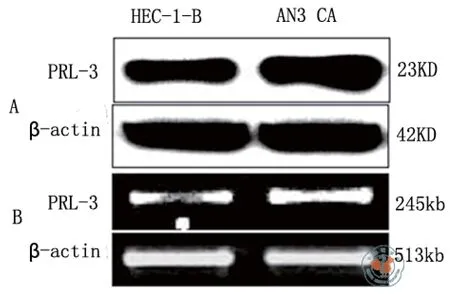
图1 PRL3在子宫内膜腺癌细胞中的表达
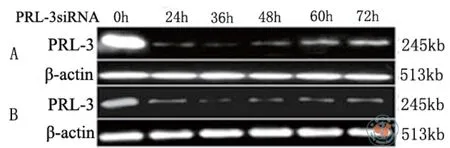
图2 子宫内膜腺癌细胞中转染siRNA PRL-3的时效
为了进一步了解PRL-3在子宫内膜腺癌细胞中的作用,在HEC-1-B和AN3 CA细胞转染PRL-3 siRNA 36 h后,用transwell小室的方法观察HEC-1-B和AN3 CA细胞迁移和侵袭能力的变化。
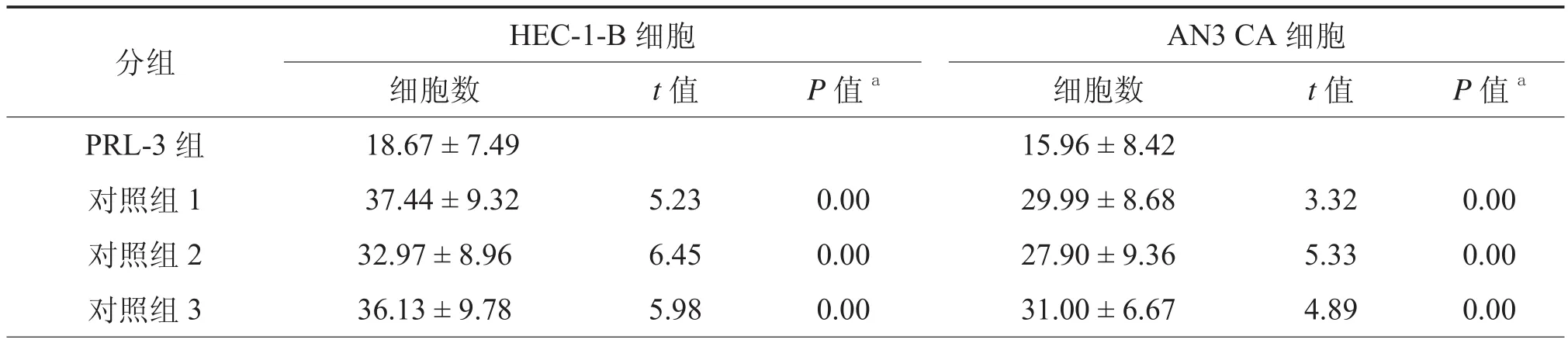
表1 PRL-3对子宫内膜腺癌细胞迁移能力的影响(个,x± s)
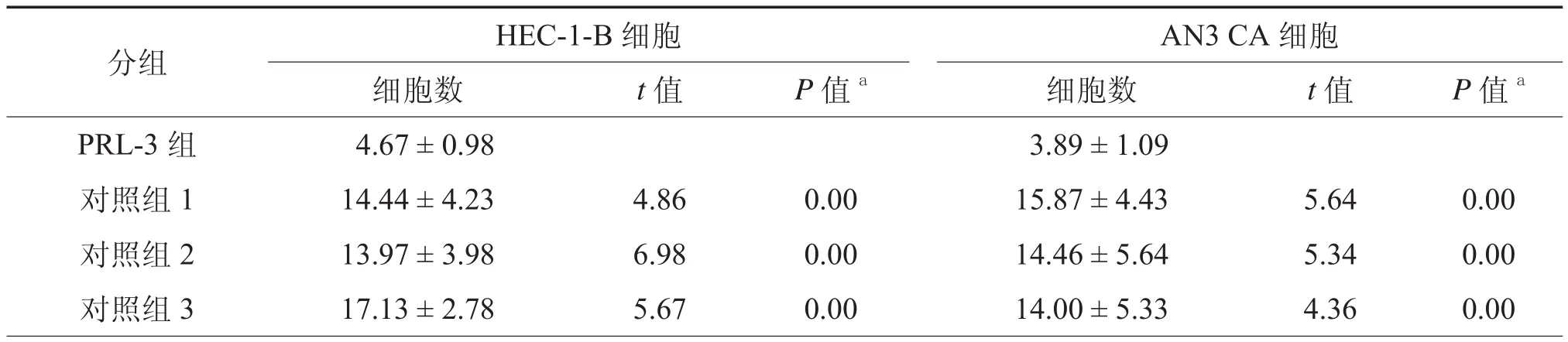
表2 PRL-3对子宫内膜腺癌细胞侵袭能力的影响(个,x± s)
细胞迁移能力测定实验结果显示,转染PRL-3 siRNA的HEC-1-B细胞穿透数目,与对照组untreated、empty和scramble相比明显减少,差异有统计学意义(表1,图3a);转染PRL-3 siRNA的AN3 CA细胞穿透数目,与3个对照组相比明显减少,差异有统计学意义(P均< 0.001,表1,图3b)。
基质胶侵袭实验结果显示,转染PRL-3 siRNA的HEC-1-B细胞穿透数目,与3个对照组相比明显减少,差异有统计学意义(表2,图3c);转染PRL-3 siRNA的AN3 CA细胞穿透数目,与3个对照组相比明显减少,差异有统计学意义(P均< 0.001,表2,图3d)。
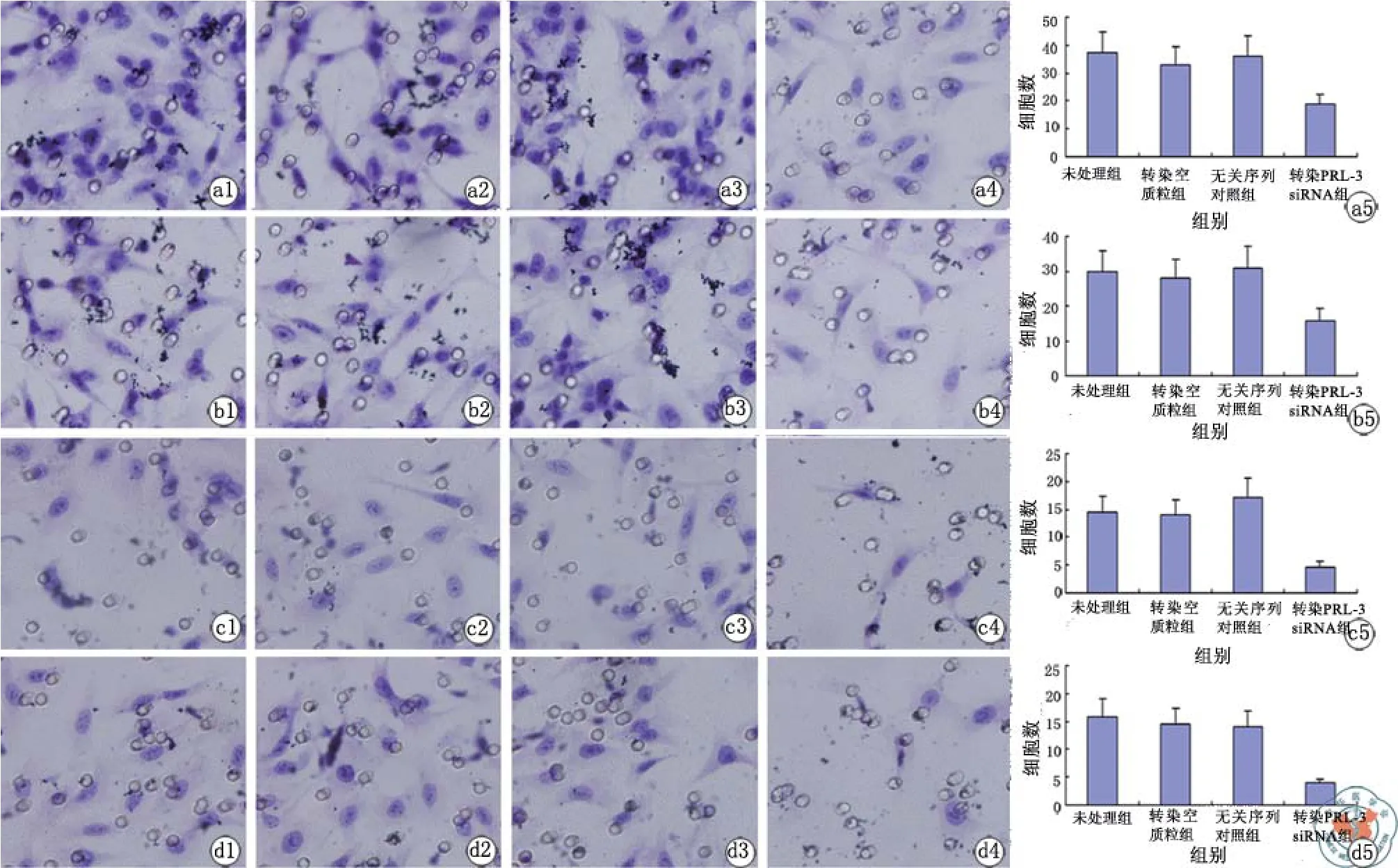
图3 PRL-3对子宫内膜腺癌细胞迁移和侵袭能力的影响
讨 论
核磁共振分析发现,PRL-3是以单体形式存在,其二级结构由1个5片β折叠和6个α螺旋组成,该排列和整体折叠方式为特异性磷酸酶所特有。但是围绕PRL-3活性中心的疏水性氨基酸使得其有别于其他特异磷酸酶[8-9]。在正常组织中的表达具有高度特异性,它主要在骨骼肌和心肌中表达,其次是胰腺,而在脑、肺、肝、肾和胎盘等组织中未能检测到其表达[10-11]。PRL-3的生理功能是调控血管紧张素-Ⅱ,以影响细胞间Ca2+的传递。后来发现,PRL-3在乳腺癌、卵巢癌、肠癌、肺癌和胃癌等肿瘤中呈高表达[1-7,12],并与肿瘤转移明显相关。本研究用RT-PCR和Western方法检测2种子宫内膜腺癌细胞HEC-1-B和AN3 CA中PRL-3的表达情况。结果发现,在子宫内膜腺癌细胞中PRL-3表达水平较高。
在关于PRL-3生物学功能方面的研究中发现,PRL-3能促进人宫颈癌细胞的迁移和侵袭[13]。另外,小鼠黑色素瘤细胞B16高表达PRL-3后,其迁移和侵袭能力及伸展速度也明显提高[14]。为了明确PRL-3在子宫内膜腺癌细胞中与迁移和侵袭能力的关系,用这两株细胞HEC-1-B和AN3 CA细胞进一步研究,在这两株细胞中转染siRNA PRL-3 24、36、48、60、72 h,结果发现,转染36 h后PRL-3表达最低。然后,进一步用transwell小室观察了转染36 h后,HEC-1-B细胞迁移和侵袭能力的变化。结果显示,转染siRNA PRL-3的HEC-1-B细胞的迁移和侵袭能力降低。为了验证PRL-3与子宫内膜腺癌细胞侵袭能力的关系,用同样的方法观察了AN3 CA细胞侵袭能力的改变。与HEC-1-B细胞侵袭能力改变相一致,转染siRNA PRL-3的AN3 CA细胞的迁移和侵袭能力也降低。因此,PRL-3可能促进子宫内膜腺癌细胞迁移和侵袭。
综上所述,PRL-3在子宫内膜腺癌细胞中高表达,且抑制其表达后能够抑制子宫内膜腺癌细胞迁移和侵袭。然而,PRL-3是通过什么途径来影响子宫内膜腺癌细胞迁移和侵袭的,它的靶基因及其靶位点又在哪里呢,这些还需要做更深层的研讨,而研究将会为子宫内膜腺癌的治疗提供一个新的视点。
1 Saha S, Bardelli A, Buckhaults P, et al. A phosphatase associated with metastasis of colorectal cancer[J]. Science, 2001, 294(5545):1343-1346.
2 Wang Y, Li ZF, He J, et al. Expression of the human phosphatases of regenerating liver (PRLs) in colonic adenocarcinoma and its correlation with lymph node metastasis[J]. Int J Colorectal Dis, 2007, 22(10):1179-11784.
3 Pryczynicz A, Guzińska-Ustymowicz K, Chang XJ, et al. PTP4A3 (PRL-3) expression correlate with lymphatic metastases in gastric cancer[J]. Folia Histochem Cytobiol, 2010, 48(4):632-636.
4 Wang L, Peng L, Dong B, et al. Overexpression of phosphatase of regenerating liver-3 in breast cancer: association with a poor clinical outcome[J]. Ann Oncol, 2006, 17(10):1517-1522.
5 Polato F, Codegoni A, Fruscio R, et al. PRL-3 phosphatase is implicated in ovarian cancer growth[J]. Clin Cancer Res, 2005, 11(19 Pt 1):6835-6839.
6 Kato H, Semba S, Miskad UA, et al. High expression of PRL-3 promotes cancer cell motility and liver metastasis in human colorectal cancer: a predictive molecular marker of metachronous liver and lung metastases[J]. Clin Cancer Res, 2004, 10(21):7318-7328.
7 Ming J, Liu N, Gu Y, et al. PRL-3 facilitates angiogenesis and metastasis by increasing ERK phosphorylation and up-regulating the levels and activities of Rho-A/C in lung cancer[J]. Pathology, 2009, 41(2):118-126.
8 Guzińska-Ustymowicz K, Pryczynicz A. PRL-3, an emerging marker of carcinogenesis, is strongly associated with poor prognosis[J]. Anticancer Agents Med Chem, 2011, 11(1):99-108.
9 Al-Aidaroos AQ, Zeng Q. PRL-3 phosphatase and cancer metastasis[J]. J Cell Biochem, 2010, 111(5):1087-1098.
10 Zeng Q, Hong W, Tan YH. Mouse PRL-2 and PRL-3, two potentially prenylated protein tyrosine phosphatases homologous to PRL-1[J]. Biochem Biophys Res Commun, 1998, 244(2):421-427.
11 Matter WF, Estridge T, Zhang C, et al. Role of PRL-3, a human muscle-specific tyrosine phosphatase, in angiotensin-Ⅱsignaling[J]. Biochem Biophys Res Commun, 2001, 283(5):1061-1068.
12 Miskad UA, Semba S, Kato H, et al. Expression of PRL-3 phosphatase in human gastric carcinomas:close correlation with invasion and metastasis[J]. Pathobiology, 2004, 71(4):176-184.
13 Bessette DC, Qiu D, Pallen CJ. PRL PTPs: mediators and markers of cancer progression[J]. Cancer Metastasis Rev, 2008, 27(2):231-252.
14 Wu X, Zeng H, Zhang X, et al. Phosphatase of regenerating liver-3 promotes motility and metastasis of mouse melanoma cells[J]. Am J Pathol, 2004, 164(6):2039-2054.
PRL-3 inhibits migration and invasion of endometrial adenocar cinoma cell lines
JIANG Guo-cheng, MING Jian, JIANG Yan-duo. Department of Information and Department of Pathology, No.202 Hospital of People Liberation Army of China, Shenyang 110000, China
JIANG Yan-duo, Email:ydjiang202@yahoo.com.cn
Objective To investigate the expression of PRL-3 in endometrial adenocarcinoma cell lines HEC-1-B and AN3 CA and the relationship between PRL-3 and the migration and invasion of endometrial adenocarcinoma cells.MethodsThe expression of PRL-3 in the endometrial adenocarcinoma cells after transfection were examined by RTPCR and Western Blot after a given period time (24 , 36 , 48 , 60 and 72 h after transfection with PRL-3 siRNA) was investigated. Meanwhile, we investigated the effect of PRL-3 on cell migration and invasion ability in endometrial adenocarcinoma cells by transwell. The t- test was used to compare the PRL-3 effect between control group and experimental group.ResultsThe results showed that PRL-3 was highly-expressed in endometrial adenocarcinoma cell lines. The lowest expression of PRL-3 occurred in the cells transfected with PRL-3 siRNA after 36h. Furthermore, downregulating PRL-3 in endometrial adenocarcinoma cells inhibited their their migration ability (the number of cells are 18.67 ± 7.49 and 15.96 ± 8.42 for HEC-1-B and AN3 CA respevtively, t = 5.23 ~ 6.45 and t = 3.32 ~ 5.33, P = 0.000 compare with control group) and invasion ability (the number of cells are 4.67 ± 0.98 and 3.89 ± 1.09 respectively,t = 4.86 ~ 6.98 and t = 4.36 ~ 5.64,P = 0.000, compare with control group,) .ConclusionsPRL-3 was highly-expressed in endometrial adenocarcinoma cells and down-regulating PRL-3 could inhibit cell migration and invasion.
2012-12-17)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2013.02.002
辽宁省科学基金博士启动基金(20111122)
110000 沈阳,解放军202医院信息科(姜国成),病理科(明健、姜彦多)
姜彦多,Email:ydjiang202@yahoo.com.cn
姜国成,明 健,姜彦多. PRL-3促进子宫内膜腺癌细胞侵袭能力[J/CD].中华细胞与干细胞杂志:电子版, 2013, 3(2):61-65.
