猪链球菌的分离与鉴定
2013-04-29庄晓薇
庄晓薇

摘要:对16份猪场病猪病料进行病原菌分离、血清学鉴定、致病力试验、保护力试验、细菌回收试验、药敏试验,结果表明,该病原菌为II 型猪链球菌,引起关节炎的猪链球菌较引起败血症的猪链球菌致病力弱;该菌对头孢菌素、青霉素高度敏感。
关键词:猪链球菌;分离;鉴定
中图分类号:S852.61+1 文献标识码:A 文章编号:1007-273X(2013)08-0013-03
猪链球菌 (Streptococcosis suis) 是引起猪的多种疾病的病原菌之一,该病原菌在养猪业发达国家如美、英、荷兰及爱尔兰等国常有发生。我国于 1958 年就有猪链球菌病的报道,1976 年我国南方几省曾一度广泛流行,给我国养猪业带来了很大危害[1]。
目前发现的猪链球菌荚膜型已超过 30 种。该病一年四季均可发生,但以 4~10 月份发生较多。常为地方性流行,多呈败血性,短期波及全群,如不进行防治,则发病率、病死率很高,慢性常为地方性散发性传染[2]。
1 猪场发病情况
2012 年 4 月,山东省临朐县某生猪繁育场仔猪流行关节炎及败血症,发病猪多为 2~6 周龄仔猪。无菌采取病猪的关节液、肝、脾、肺及肠系膜淋巴结,经实验室分离鉴定,证实为II 型猪链球菌。
2 材料与方法
2.1 材料
2.1.1 病料 无菌采取该生猪繁育场患关节炎病猪的关节液 8 份,分别编号为 1-8 号;无菌采取患败血症猪的肝、肺、脾及肠系膜淋巴结 8 份,分别编号为 9~16 号。
2.1.2 试剂 试验所用的各种糖均购自上海化学试剂二厂,批号为 2010~2012 年不等。
2.1.3 培养基 绵羊鲜血平板、匹克氏增菌液、10 ml/L猪血清肉汤及各种糖培养基按常规方法制备。
2.1.4 试验抗原 猪链球菌诊断血清与平板凝集抗原均购自中国兽药鉴察所,批号为 990725。
2.1.5 药敏纸片 购自广东省某军区后勤部,批号 20000312。
2.1.6 试验动物 健康小白鼠 (30~35 g) 50 只,购自青岛农业大学动物科技学院。
2.2 方法
2.2.1 病原分离 将所采病料分别涂片,革兰氏染色镜检,然后分别接种于鲜血琼脂平板。37 ℃ 需氧培养 24 h 后,挑取可疑菌落接种于匹克氏增菌液,37 ℃ 培养 24 h 后,革兰氏染色,显微镜检查,再接种于血清肉汤,纯化后放置 4 ℃,冷藏备用[3]。
2.2.2 分离菌株的鑒定
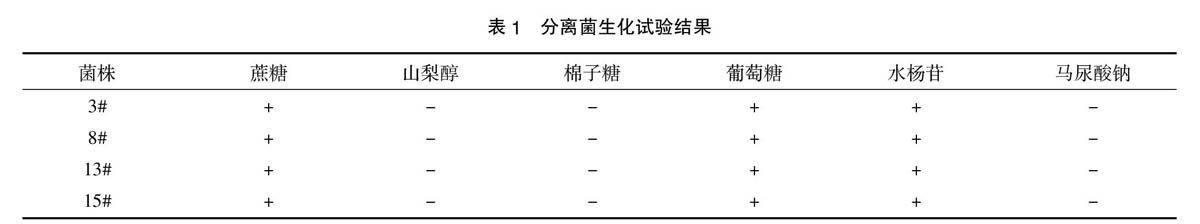
(1)生化试验。随机抽取上述分离菌血清肉汤培养物 3#、8#、13#、15#,分别接种于蔗糖、山梨醇、棉子糖、葡萄糖、水杨苷、马尿酸钠培养基,37 ℃培养24 h 后,观察其对糖的利用情况[4]。
(2)血清学鉴定。将 3#、8#、13#、15# 菌经血清肉汤培养 8 h,通过 3 000 r/min 离心 10 min,PBS 洗涤 2 次,用pH 7.2 的 0.01mol/L PBS制成 1:10~1:20倍稀释的细菌悬液。取 1 滴上述细菌悬液与适当的抗血清在洁净玻片上混匀,立即观察凝集现象。同时,设立细菌悬液对照及血清对照[5]。
2.2.3 致病力及保护力试验
(1)菌落形成单位的测定。①将已灭菌的营养琼脂培养基分别倒入已灭菌过的培养皿内,每皿约 15 mL 培养基,启开皿盖暴露于无菌室内的不同地方,10 min 后,盖好皿盖。② 将培养皿倒置于 37 ℃ 培养 24 h 后,观察菌落情况,统计菌落数。③如果每个皿内菌落不超过 4 个,则可以认为无菌程度良好,菌落数很多,则应对无菌室进一步灭菌,再重复以上步骤。
(2)致病力试验。无菌吸取上述血清肉汤培养物(含菌量5.0×108 CFU/mL) 以0.1、0.2 、0.3 、0.4 、0.5 mL/只分别腹腔注射小白鼠,观察其死亡时间和数量,测定其最小致死量。再将上述血清肉汤培养物腹腔注射小白鼠,小白鼠共 14 只,分 7 组。第一组每只小白鼠注射 3# 菌 0.2 mL,第二组每只注射 8# 菌0.2 mL,第三组每只注射 3#、8# 菌各0.1 mL,第四组每只注射 13# 菌 0.2 mL,第五组每只注射 15# 菌 0.2 mL,第六组每只注射13#、15# 菌各 0.1 mL,第七组每只注射无菌血清肉汤 1.0 mL作对照。以上各组分别饲养观察其死亡时间及数量[6]。
(3)保护力试验。将3#、8#、13#、15# 血清肉汤培养物分别接种于 18 cm 鲜血平板。37 °C 培养 24 h 后收菌。再用麦氏比浊管比浊,适当稀释,然后用 0.3% 甲醛灭活,37 ℃ 作用 24 h后做无菌检验。然后将其分别腹部皮下接种小白鼠各 2 只,剂量为 0.4 mL/只。10 d后,再分别进行人工感染,剂量为 0.2 ml/只[7]。
(4)细菌回收试验。对致病力试验出现症状及死亡小白鼠剖检,并采集病料,进行分离。
2.2.4 药敏试验 采用纸片扩散法,用无菌棉签蘸取分离菌的血清肉汤培养物,均匀涂布于 9 cm 鲜血平板;待稍微干燥后,用无菌镊子将各种药敏纸片分别平贴在培养基表面,4 ℃ 2 h使药物扩散,然后置 37 ℃培养 20~24 h,观察结果。结果按抑菌圈直径大小和各抗菌药的具体标准,评定为高度敏感、中度敏感或耐药[8]。
3 结果与分析
3.1 分离细菌的培养特性及形态特征
3.1.1 培养特性 37 ℃培养 24 h 后,所采集的12 份病料在鲜血琼脂平板上形成表面光滑、隆起的灰绿色小菌落,外层有明显的 β 溶血环。该菌在匹克氏增菌液中底部有沉淀,在血清肉汤中先均匀浑浊,后在试管底部形成沉淀,上部澄清,不形成菌膜。
3.1.2 染色特性 关节液、鲜血琼脂血清肉汤培养物涂片、革兰氏染色、显微镜检查为革兰氏阳性,在关节液、鲜血琼脂培养物中多呈单个、双球或短链状排列。
3.2 生化试验结果
表1结果表明分离的3#、8#、13#、15# 菌的生化反应结果均符合猪链球菌的生化特性,说明分离的菌均为猪链球菌。
3.3 血清学鉴定结果
将 3#、8#、13#、15# 细菌悬液与 1/2 及 II 型抗血清混合,立即可见明显的凝集现象,但不与 1 型及其他型抗血清出现凝集。直接挑取细菌菌落与血清混匀,也能得到一致结果。阴性对照均未见凝集现象。
3.4 致病力及保护力试验结果
3.4.1 致病力试验结果 第一组、第二组小白鼠注射血清肉汤培养物 48 h 内均未见死亡,第三组 48 h 内有一只死亡,第四组、第五组、第六组在注射血清肉汤培养物 18 h 内全部死亡。死亡后,小白鼠皮肤发绀,剖检肝、脾、肺、心出血,呈败血症。第七组健活。由于第一、二、三组小白鼠死亡数量较少,所以再用相同剂量分别背部皮下接种小白鼠各 2 只,48 h 后处死,剖检发现注射部位有直径 0.9~1.1 cm 的脓肿,浓汁呈黄绿色。
3.4.2 保护力试验结果 免疫的小白鼠再经攻毒后均未发病。
3.5 细菌回收试验结果
将上述死亡及发病的小白鼠剖检采集病料,进行细菌分离、生化试验及血清学鉴定,能得到原分离菌。
3.6 药敏试验结果
由表2可知,分离菌对头孢菌素、青霉素高度敏感;洁霉素和卡那霉素中度敏感;而对土霉素、链霉素、庆大霉素具有耐药性。
4 讨论
过去屡有败血型猪链球菌的报道,而关于集约化养猪场关节炎型链球菌病的报道较少。本次试验从患关节炎猪的关节液中成功分离出了猪链球菌。另外,该种猪场约有60% 的仔猪流行关节炎,严重者可发生败血症而死亡,给种猪场造成巨大的经济损失。所以,研究该病可为生产中防制该病提供理论依据。
病猪的鼻液、尿液、肌肉、内脏和关节内均带有病原体,建议首先应加强对健康猪的免疫。另一方面,在发病后对病猪和健康猪进行隔离,根据实验室药敏试验结果配合药物治疗,建议用头孢菌素、青霉素、洁霉素等药物治疗。该种猪繁育场采纳我们的建议,首先对所有的未发病仔猪用灭活疫苗免疫接种,对已发病的猪用青霉素等药物配合治疗,另外注意卫生管理。该病得到有效的控制。
5 结论
引起猪关节炎的猪链球菌的致病力较小,而引起败血症的猪链球菌的致病力较强。但通过生化试验和血清学鉴定,它们又是同种细菌且血清型也相同。同种血清型的猪链球菌的致病力之间的差异还有待于进一步研究。
参考文献:
[1] 杨本升,刘玉斌,苟仕金,等. 动物微生物学[M]. 长春:吉林科学技术出版社,1995.
[2] 黄毓茂,黄引贤.2型猪链球菌的血清学鉴定[J].中国兽医学报,1995,15(1):63-65
[3] 李健强,李大金.兽医微生物学实验实习指导[M]. 西安:陕西科学技术出刊社,1999.
[4] 张彦明,贾靖国,刘安典.动物性食品卫生检验技术[M]. 西安.西北大学出版社,1996.
[5] 蔡宝祥.家畜传染病学[M]. 北京:中国农业出版社,1998.
[6] 甘肃农业大学.兽医微生物学[M]. 北京:中国农业出版社,1982.
[7] 刘荣标.兽医微生物学(上)[M]. 台北:艺轩图书出版社,1984.
[8] 郑明球.家畜传染病学实验指导[M]. 北京:中国农业出版社,1999.