响应面法优化酶法制备猪血红蛋白抗氧化肽
2013-04-29孔卓姝刘海杰成晓瑜张顺亮潘晓倩
孔卓姝 刘海杰 成晓瑜 张顺亮 潘晓倩

摘 要:以猪血红蛋白为原料,研究蛋白酶水解制备抗氧化肽的工艺。通过研究酶解时间、酶与底物比、酶种类对制备的抗氧化肽还原力和水解度影响,筛选出最佳蛋白酶及制备抗氧化肽的最佳工艺条件。结果表明:7种酶中,胃蛋白酶的水解度和还原力最佳。胰蛋白酶和胃蛋白酶复合水解比单酶水解的水解度提高了11.83%,还原力没有显著性差异。在此基础上设计单酶响应面,得到最佳还原力酶解条件为:酶解温度37.31℃、pH1.95、酶与底物比3526.74U/g。脱色条件为活性炭用量3%、pH4.0、温度70℃、脱色时间1h,粉末状活性炭的脱色率达到85.69%,蛋白质损失率20.32%。
关键词:猪血红蛋白;抗氧化肽;蛋白酶;活性炭
Optimization of Enzymatic Preparation of Antioxidant Peptide from Porcine Hemoglobin
KONG Zhuo-shu1,2,LIU Hai-jie2,CHENG Xiao-yu1,*,ZHANG Shun-liang1,PAN Xiao-qian1
(1. China Meat Research Center, Beijing 100068, China;
2. College of Food Science and Nutritional Engineering, Agricultural University, Beijing 100083, China)
Abstract:The enzymatic preparation of antioxidant peptides from porcine hemoglobin was studied. The effects of enzymatic hydrolysis time, enzyme/substrate ratio, and different proteases on the degree of hydrolysis (DH) and reducing power (RP) of antioxidant peptides were examined. Finally, the optimum enzyme and hydrolysis conditions for preparing antioxidant peptides were established. Pepsin was the best among seven proteases tested as evaluated by both DH and RP of antioxidant peptides. The combined use of pepsin with trypsin increased the DH by 11.83% compared with its single use without leading to a significant difference in the RP. Employing response surface methodology, the optimum hydrolysis conditions using pepsin alone were determined as follows: hydrolysis temperature of 37.31 ℃, initial pH 1.95 and enzyme/substrate ratio of 3526.74 U/g. The resulting hydrolysate was decolorized by adding 0.3% of activated charcoal and incubating at 70 ℃ for 1 h. Under this condition, the decolorization efficiency was 85.69% and the protein loss was about 20.32%.
Key words:porcine hemoglobin;antioxidant peptides;protease;activated carbon
中图分类号:TS251.93 文献标志码:A 文章编号:1001-8123(2013)09-0001-06
2012年,我国猪肉产量持续增长达到5335万t,与上年相比增长5.6%。年末生猪存栏47492万头,增长1.6%;生猪出栏69628万头,增长5.2%[1]。在猪肉产量迅速增加的同时,作为生猪屠宰加工的重要副产品——猪血也大量产生。在生产中,大量猪血的排放不仅浪费资源,而且对环境造成了污染。我国对猪血的利用极少,除了做一些血豆腐、血肠等,大多用在动物饲料中,有效利用猪血的产品比较单一。而在国外,猪血大多被用来开发肽类试剂、药物以及功能性食品添加剂等。
近年来,从动物和植物中得到的生物活性肽受到广泛关注。由于这些蛋白资源十分丰富和廉价,而且通过水解蛋白得到的生物活性肽价格便宜、安全性高、工艺简单、便于工业化生产,因此也受到越来越多科学家和各国政府的关注。水解得到的生物活性肽具有低黏度、起泡性和溶解度高等特点。生物活性肽主要分为内源性生物活性肽和外源性生物活性肽两种。内源性生物活性肽天然存在于机体或组织的内部,含量很低,而外源性生物活性肽一般都以无活性的形式存在于蛋白质氨基酸序列中,可以通过水解蛋白质的方法进行大量制备,具有很大的工业化应用潜力。实验证明,要想从大豆中获得大量的功能性肽,需要严格控制酶解的反应条件[2]。目前抗氧化肽的研究不仅仅局限在植物抗氧化肽的提取,例如核桃[3],在动物中提取抗氧化肽也得到了广泛关注,例如鸡胸肉[4]、鲨鱼[5]、牛奶[6]等。而猪血中含有大量的血红蛋白,血红蛋白生物活性肽具有许多重要的功能活性[7],可被开发为功能食品、医药及化妆品等具有高附加值的生物制品。
最近几年,蛋白质酶解的研究很多,不仅是单酶酶解,为了提高水解的效率,很多人开始研究复合酶解。何莉萍等[8]在中性蛋白酶和碱性蛋白酶水解玉米蛋白中已经发现采用中性蛋白酶和碱性蛋白酶复合水解玉米蛋白比单一酶水解的效果好。李磊等[9]也在微波复合酶水解植物蛋白制取小分子多肽研究中发现微波加热和复合酶水解是将蛋白分解成多肽的高效方法。本实验首先研究了猪血中提取生物活性肽最佳酶的筛选,其次对单酶水解和双酶复合水解进行比较,最后通过响应面优化单酶酶解工艺并研究了猪血血红蛋白酶解液的活性炭脱色效果。
1 材料与方法
1.1 材料与试剂
新鲜猪血,采自北京资源集团。
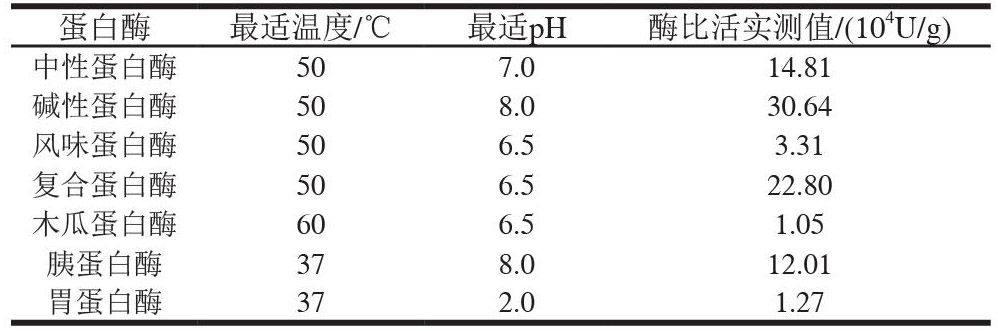
氢氧化钠、盐酸、三氯化铁、铁氰化钾、三氯乙酸(均为分析纯) 北京化工厂;酪氨酸 北京奥博星生物技术责任有限公司;Folin-酚 美国Sigma公司;甲醛溶液(分析纯,含量37.0%~40.0%) 西陇化工股份有限公司;中性蛋白酶(枯草芽孢杆菌)、碱性蛋白酶(枯草杆菌)、风味蛋白酶、复合蛋白酶(米曲霉) 诺维信(中国)投资有限公司;木瓜蛋白酶(木瓜)、胰蛋白酶(胰脏)、胃蛋白酶(猪胃) 国药集团化学试剂有限公司。
1.2 仪器与设备
PB-10型数显酸度计 赛多利斯科学仪器有限公司;KDY-9820凯氏定氮仪 北京市通润源机电技术有限责任公司;GL-20G-II型台式高速离心机 上海安亭科学仪器厂;SHZ-88型水浴恒温振荡器 金坛市医疗仪器厂;PR203型电子天平 梅特勒-托利多仪器有限公司;GZX-9240 MBE型电热鼓风干燥箱 上海博讯实业有限公司医疗设备厂;SCIENTZ-IID型超声波细胞破碎机 北京久润天诚科技发展有限公司;KQ-600DE型数控超声波清洗器 昆山市超生仪器有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 猪血红蛋白制备
在屠宰过程中采集血液,并迅速加入柠檬酸钠(5g/L)抗凝,4℃保存。将新鲜猪血在4℃、8000×g条件下高速冷冻离心10min,获得红血球及血浆;收集红血球加入同等体积的蒸馏水,超声波细胞破碎辅助溶血20min,然后在4000×g、4℃条件下冷冻离心10min,得到血红蛋白溶液4℃保存,备用。
1.3.2 血红蛋白含量测定
采用凯氏定氮法[10]。
1.3.3 酶活力测定
采用Folin-酚法[11]。
1.3.4 猪血红蛋白酶解物的制备
取血红蛋白溶液90℃加热10min后,均质10min,在各酶最适温度及pH值条件下(表1)加入酶制剂,并根据各自实验条件进行酶解反应,酶解过程不断搅拌,并且通过添加1mol/L NaOH溶液或HCl溶液保持pH值不变。按照要求取一定量的酶解液,沸水浴10min,冷却,调节pH值至7.0左右,8000×g离心15min得到酶解液,上清液备用。
1.3.5 水解度的测定
采用双指示剂甲醛滴定法[12]。每隔1h取出血红蛋白水解物。取1mL酶解物2份,分别置于三角瓶中,加50mL水溶解充分。其中1份加中性红指示剂,用NaOH标准溶液滴定至琥珀色为终点;另1份加百里酚酞及中性甲醛,摇匀、静置,用NaOH标准溶液滴定至淡蓝色为终点。记录2次消耗的碱液体积。按式(1)计算。
(1)
式中:V1为用百里酚酞作指示剂时标准碱溶液的滴定体积/mL;V2为用中性红作为指示剂时标准碱溶液的滴定体积/mL;V3为酶解液过滤的体积/mL;N为标准碱液浓度/(mol/L);m为样品质量/g;0.014为氮的毫克当量;V为取样测量体积/mL。
1.3.6 还原力的测定[13]
取待测液1mL,加入2.5mL 0.2mol/L磷酸缓冲液(pH6.6)和2.5mL质量分数1%的铁氰化钾溶液混匀,50℃水浴20min后急速冷却,加入2.5mL质量分数10%三氯乙酸(TCA)溶液,充分混匀后3000×g离心10min。取上清液2.5mL,加入2.5mL蒸馏水及0.5mL质量分数1%的三氯化铁充分混匀,室温反应10min后于波长700nm处测定吸光度(A700nm)。吸光度越大,说明还原力越强,比较酶解物、猪血红蛋白溶液的还原力。
1.3.7 色素含量的测定[14]
用722S分光光度计在色素的最大吸收波长处(388nm)测其吸光度,对于浓度太高的溶液,因其色素含量太高,可以采取示差法[15]进行测定。
式中:OD1和OD2分别为脱色前溶液和脱色溶液后在波长388nm的光密度值。
1.3.8 蛋白质损失率的测定[16]
蛋白质含量的损失趋势可以反映出氨基酸和多肽含量损失的趋势,用紫外分光光度计分别测波长280、260nm处的吸光度。
式中:F为校正因子,由OD280nm/OD260nm查表得F值;D为石英比色皿的厚度/cm;N为稀释倍数;OD280nm为样品液在波长280nm的光密度值。
1.3.9 酶法制备猪血红蛋白抗氧化肽的工艺优化
1.3.9.1 蛋白酶的筛选
(1)蛋白酶的初选
选取中性蛋白酶、碱性蛋白酶、风味蛋白酶、复合蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶,在各酶最佳水解温度、pH值和统一酶和底物比(800U/g)条件下进行猪血红蛋白水解实验,水解8h,研究不同酶作用下猪血红蛋白酶解液的水解度和还原力的变化规律。
(2)蛋白酶的复选
根据上述结论,选择3种酶,在其最适温度及pH值条件下加入酶制剂启动酶解反应,酶与底物比分别为1000、1500、2000、2500、3000U/g,反应时间6h。选取最佳酶解酶和底物比。
(3)双酶酶解与单酶酶解比较
采用胰蛋白酶,在其最适温度和pH值条件下,加酶量1500U/g,酶解3h;然后调节至胃蛋白酶的最适水解温度和pH值,加入胃蛋白酶1500U/g,酶解3h,得到酶解液。比较胰蛋白酶和胃蛋白酶复合酶解与上述得到的最佳蛋白酶在3000U/g条件下单酶酶解所得酶解液,以选取最佳水解方式。
1.3.9.2 酶解条件响应面优化试验
根据前期实验研究结果,固定水解酶为胃蛋白酶,酶解反应时间6h,选取温度、pH值、酶与底物比(E/S)进行3因素3水平响应面试验,因素水平编码见表2。
以还原力作为提取抗氧化肽效果好坏的主要评价指标。将上述酶解方法及条件下得到的酶解上清液作为样品测定其还原力。
1.3.9.3 活性炭脱色工艺对酶解血红蛋白多肽还原力的影响
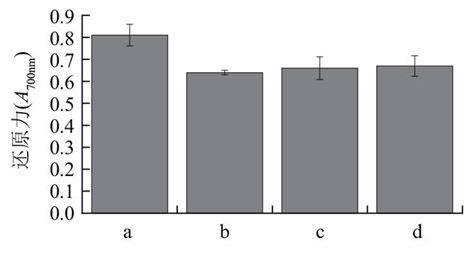
由于血红蛋白酶解液具有不易接受的红褐色,将其直接应用于食品及药物领域受到一定限制,因此一般进行脱色工艺改变其色泽。将具有最佳还原力的酶解液冷冻干燥保存、备用。陈文辉等[17]研究发现:当活性炭用量3%、pH 4.0、温度70℃、脱色时间1h时,猪血酶解液的脱色效果明显。在此条件下,分别取酶解物1g溶于100mL水中,标号a、b、c、d。调节酶解物溶液的pH值至4.0。b、c、d分别加入0.03g的粉末状、无定形粒状、片状的活性炭。b、c、d在70℃条件下水浴1h。
1.4 统计分析
本实验所有结果均重复3次,取平均值。采用Duncan多重比较检验法进行显著性检验,在P<0.05水平上差异显著。采用Origin软件进行统计分析。
2 结果与分析
2.1 蛋白酶的筛选
2.1.1 初选
由于酶自身特异性导致对蛋白质底物的作用位点有较大区别,使得各自水解得到的短肽在数量及生物活性方面都存在较大不同,如胰蛋白酶是1种丝氨酸内切酶,其仅能水解R1为Arg或Lys残基侧链的肽键;风味蛋白酶是1种内切酶与外切酶的混合酶,其内切作用位点多为芳香族氨基酸。因此,随着血红蛋白酶解时间的延长,酶解产物的活性肽序列不断变化,导致具有生物活性的肽段在不同时间段总体含量不同。7种蛋白酶酶解过程水解度和还原力的变化如图1所示。
由图1B可知,血红蛋白经7种蛋白酶酶解所得的水解液与血红蛋白溶液相比,还原力都有所增加,在360min时,血红蛋白酶解液的水解度为:胃蛋白酶>胰蛋白酶>木瓜蛋白酶>中性蛋白酶>碱性蛋白酶>复合蛋白酶>风味蛋白酶。各酶的最高还原力为:胃蛋白酶>胰蛋白酶>中性蛋白酶>木瓜蛋白酶>碱性蛋白酶>复合蛋白酶>风味蛋白酶。图1A、图1B比较可以发现,一定的水解可以提高血红蛋白溶液的还原力,但是还原力并不是与水解度的大小成正相关,血红蛋白酶解液还原力的大小还受其他因素的影响,例如不同酶的特异性水解位点的不同等。有研究表明,蛋白质水解的抗氧化性与自身氨基酸的组成有关[18]。
因为本实验主要研究抗氧化肽的酶法提取,根据水解度的变化以及还原力的不同,最终选胃蛋白酶、胰蛋白酶、中性蛋白酶做下1步实验。
2.1.2 复选
胃蛋白酶、胰蛋白酶、中性蛋白酶分别在它们的最适pH值和温度以及不同的酶与底物比的条件下反应,反应时间6h。
由图2可知,随着酶与底物比的增加,水解度逐渐上升最终趋于平稳,还原力也有所上升。并且虽然胰蛋白酶的水解度与胃蛋白酶相比,相差不大,但是其还原力明显低于胃蛋白酶。这可能与胃蛋白酶的结构,以及水解的特异性位点有关,胃蛋白酶水解的肽端大多是具有苯环的芳香氨基酸、带支链的疏水性氨基酸等,可能会对提高酶解液的还原力有一定帮助。胃蛋白酶的还原力明显高于其他两种酶。
2.1.3 双酶酶解与单酶酶解比较
由表3可知,在反应温度、pH值、时间等相同的条件下,胰蛋白酶和胃蛋白酶复合水解能有效提高水解度,但是酶解液的还原力并没有明显的下降。其原因可能是:胰蛋白酶是1种丝氨酸内切酶,而胃蛋白酶主要作用于具有苯环的芳香族氨基酸、带支链的疏水性氨基酸等的肽端。因此这两种酶复合水解比单一酶水解效果好,水解度高。复合水解比单酶水解的水解度提高了11.83%,酶解液还原力下降了0.08%,无明显变化。
由2.1节可知,酶解液的水解度与还原力之间没有直接的相关性,因此水解度并不适合作为抗氧化肽制备中的主要评价指标。其原因可能是酶解液的还原力的大小与酶解过程中产生不同活性肽的序列不断变化,在不同时间段抗氧化活性肽的含量不同[19]。所以,在后续的试验中,将把还原力作为抗氧化肽工艺优化中的主要指标。
2.2 响应面分析试验
2.2.1 响应面试验结果
响应面试验设计见表4,方差分析见表5。由表5可知,影响酶解液还原力的因素依次是E/S 2.2.2 响应面优化 a. 酶解pH值与E/S b. 酶解温度与E/S c. 酶解温度与pH值 图 3 温度、pH值和E/S对还原力影响的响应面 Fig.3 Response surface plots for the effect of three hydrolysis conditions on RP 图3表明,温度对酶解液的还原力影响较为明显,这可能主要因为温度低时,蛋白酶的活性较差,不能完全酶解血红蛋白,所以还原力较低,而当温度过高时,不仅蛋白酶可能变性,而且所产生的抗氧化肽也可能发生变性,而失去还原力。
通过Design Expert软件分析,血红蛋白通过胃蛋白酶酶解所得酶解液还原力最好的工艺条件为:酶解温度37.31℃、pH1.95、酶与底物比3526.74U/g,此时所得酶解液的还原力为2.665。
2.3 脱色活性炭的选择
a.对照;b.粉末型活性炭;c.粒状活性炭;d.片状活性炭。
图 4 不同活性炭脱色对还原力的影响
Fig.4 Effect of different forms of activated carbon on RP
由表6可知,粉末状活性炭脱色率最好达到85.69%,蛋白质损失率达到20.32%,略高于粒状活性炭的蛋白质损失率。其原因可能是:活性炭具有较大的表面积,而且炭粒中还有更细小的孔——毛细管,有很强的吸附性能。酶解液中含有大量的大分子蛋白质,因此随着活性炭表面积的增加,不仅对色素的吸附增加而且对蛋白质的吸附也增加。由图4可知,通过粉末状活性炭处理的酶解液的还原力略低于其他两种活性炭,与脱色前相比降低了21.02%。这是由于随着活性炭粒径的增加,蛋白质、肽类等物质损失增加,使得酶解液的还原力下降。由表6和图4可以看出粉末状活性炭的脱色效果较好,且与其他两种相比对酶解液的还原力影响差别不大,因此选择选择粉末状活性碳作为酶解液脱色剂。
3 结 论
筛选试验结果表明,7种蛋白酶中,胃蛋白酶为最佳的酶解血红蛋白制备抗氧化肽的蛋白酶。复合水解实验发现,胰蛋白酶和胃蛋白酶复合水解比单酶水解所得酶解液的水解度提高了11.83%,而酶解液的还原力无明显变化。在酶解时间360min条件下,经响应面优化所得酶解最佳条件为:酶解温度37.31℃、pH1.95、酶与底物比3526.74U/g,此时酶解液的还原力为2.665。脱色试验表明,粉末状活性炭的脱色率达到85.69%,高于其他两种活性炭,而蛋白质损失率20.32%,低于其他两种活性炭,通过粉末活性炭脱色所的酶解液的还原力较原酶解液降低了21.02%。
虽然猪血成分复杂特殊,但是近年来越来越多的研究表明猪血对提高机体免疫力、抗癌、健体等方面具有重要作用,另外猪血中还含有人体所必需的无机盐,特别是铁的含量极其丰富。血红蛋白酶解液中除了抗氧化肽,还含有许多功能性肽(如抗菌肽、ACE等)及其他杂质,如何高效率提纯净化抗氧化肽有待进一步研究。
参考文献:
[1] 新华社. 2012年国民经济和社会发展统计公报[EB/OL]. (2013-2-23) [2013-8-23]. http://news.xinhuanet.com/politics/2013-02/23/c_114772758_4.htm.
[2] Adler-Nissen J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256-1262.
[3] Chen Ning, Yang Hongmei, Sun Yi, et al. Purification and identification of antioxidant peptides from walnut (Juglans regia L.) protein hydrolysates[J]. Peptides, 2012, 38(2): 344-349.
[4] Sun Yangying, Pan Daodong, Guo Yuxing, et al. Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50(10): 3397-3404.
[5] Bougatef A, Hajji M, Balti R, et al. Antioxidant and free radical-scavenging activity of smooth hound (Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J]. Food Chemistry, 2009, 114(4): 1198-1205.
[6] Pihlanto A. Antioxidative peptides derived from milk proteins[J]. International Dairy Journal , 2006, 16(11): 1306-1314.
[7] Sarmadi B H, Ismail A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956.
[8] 何莉萍, 刘良忠. 中性蛋白酶和碱性蛋白酶对玉米蛋白水解作用的研究[J]. 食品科学, 2008, 29(3): 152-157.
[9] 李磊, 陈均平, 张海平. 微波复合酶水解植物蛋白制取小分子多肽的研究[J]. 安徽农业科学, 2007, 35(19): 5655-5660.
[10] 许安邦, 林维宣, 张水华, 等. 食品分析[M]. 北京: 中国轻工业出版社, 2009.
[11] 国家标准化管理委员会. GB/T 23527—2009 蛋白酶酶制剂[S]. 北京: 中国标准出版社, 2009.
[12] 黄焕, 王欣, 刘宝林. 鱼鳞胶原蛋白水解度两种测定方法的比较[J]. 食品工业科技, 2010, 31(3): 354-356.
[13] 孙骞, 胡鑫, 罗永康, 等. 猪血红蛋白抗氧化肽的酶法制备及其体外抗氧化活力观察[J]. 中国农业大学学报, 2008, 13(4): 77-81.
[14] 马美湖, 于美娟. 畜禽血液的脱色技术研究进展[J]. 肉类工业, 2004(10): 25-26.
[15] 贾之慎. 无机及分析化学[M]. 北京: 中国农业出版社, 2009.
[16] 于长青, 任泊晓, 修峰. 鹅血酶解液活性炭脱色效果的研究[J]. 中国食品添加剂, 2007(1): 66-69.
[17] 陈文辉, 杨万根, 马美湖, 等. 猪血酶解液活性炭脱色方法研究[C]//第五届中国肉类科技大会论文集. 北京: 中国畜产品研究会, 2009: 338-340.
[18] Thiansilakul Y, Benjakul S, Shahidi F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry, 2007, 103(4): 1385-1394.
[19] Thiansilakul Y, Benjakul S, Shahidi F. Antioxidative activity of protein hydrolysate from round scad muscle using alcalase and flavourzyme[J]. Journal of Food Biochemistry, 2007, 31(2): 266-287.
