糖原合酶激酶3β与肾脏病变的关系
2013-04-26何大锋,李世军
糖原合酶激酶3(GSK-3)有GSK-3α与GSK-3β两种亚型,GSK-3β是真核生物细胞重要信号通路的关键酶,广泛参与机体的多种重要生命活动[1-4]。GSK-3β的活性在真核生物体内受到严密调控,锂可抑制GSK-3β的活性,部分长期应用锂制剂者会出现尿崩症,提示其在肾脏浓缩功能或水平衡调节中发挥重要作用。雷帕霉素可抑制GSK-3β的活性,长期应用可引起足细胞损伤产生蛋白尿。本文主要简述GSK-3β的调控机制,重点探讨其参与尿液浓缩功能及足细胞损伤的机制。
GSK-3β的功能与调节机制
编码GSK-3α与GSK-3β的基因分别位于19q13.2和3q13.3[5],两个基因序列具有85%的同源性,在催化结构域的同源性则高达98%[2]。MacAulay等[6]报道,肾脏可同时表达GSK-3α与GSK-3β,在大鼠、小鼠及人集合管上皮细胞上均可检出GSK-3β。Kjaersgaard等[7]观察到,随生长发育进程,GSK-3β在肾脏皮质的表达量逐渐减低,而其在髓质的表达量则保持不变。
GSK-3β是多条重要信号通路的关键酶,广泛参与真核生物重要生命活动,包括胚胎发育、真核生物细胞有丝分裂、细胞分化、细胞骨架组装、上皮细胞的正常功能维持与存活等。GSK-3β的活性在真核生物体内受到严密调控,主要包括三种调节方式:磷酸化与去磷酸化,形成蛋白复合体,亚细胞隔离[8]。磷酸化与去磷酸化是最主要的调节方式。多种蛋白激酶(如PKB或Akt、PKC、PKA)可磷酸GSK-3β的9位丝氨酸,使其不能与底物结合而失去活性,在去磷酸酶的作用下磷酸化的GSK-3β可恢复活性[9]。
在Wnt信号通路中,GSK-3β与息肉病蛋白(APC)、轴蛋白及酪蛋白酶Ⅰ(CK-Ⅰ)等构成蛋白复合体,称为β连环蛋白降解复合物[10]。如果细胞外无Wnt信号,GSK-3β以活性形式与APC、轴蛋白、CK-Ⅰ等形成蛋白复合物,导致β连环蛋白泛素化沿蛋白酶体途径降解。当有Wnt信号与细胞表面受体(FZD与LRP5/6)结合,引起CK-Ⅰ磷酸化获得激酶活性,催化GSK-3β发生磷酸化,失去与APC、轴蛋白等的结合能力,β连环蛋白降解减少并转移至细胞核内发挥转录因子的作用(图1)[11]。
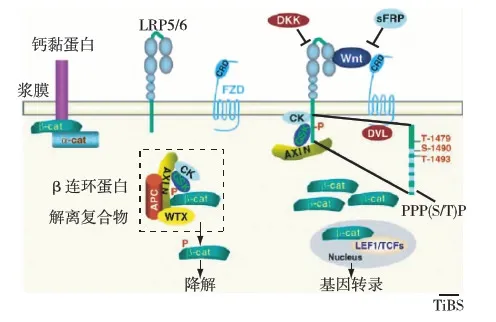
图1 Wnt信号与糖原合酶激酶3(GSK-3)的关系
GSK-3β的活性可能受到miRNA的调控。Tsukigi等[12]的研究发现,59%的肾脏肿瘤患者瘤组织内miRNA-199a表达量减低,并且GSK-3β主要聚集在细胞核内,两者具有良好的相关性。利用基因重组的方法进一步证实,在miRNA-199a过表达肿瘤体系,明显下调了细胞内GSK-3β的表达,肿瘤细胞的增生与存活能力则明显下降。提示miRNA-199a依某种方式影响GSK-3β的活性,并降低肿瘤细胞的增生与存活能力 。
GSK-3β参与尿液浓缩的分子机制
肾脏主要依赖抗利尿激素(AVP)调节集合管上皮细胞水通道蛋白2(AQP2)的表达及分布调节水平衡。AVP与集合管表面受体结合激活腺苷酸环化酶,增加细胞内环磷酸腺苷(cAMP)含量,增加AQP2在集合管的表达及正确分布[13,14]。Rao等[2]研究证实,GSK-3β可影响AVP信号转导通路的关键环节,参与调节肾脏浓缩功能。
锂是GSK-3β的强效抑制剂,可引起肾性尿崩症(NDI),提示GSK-3β可能参与了肾脏尿液浓缩。Rao等[15]成功构建了集合管特异性 GSK-3β基因敲除小鼠发现,其在严格限水或精氨酸加压素(dAVP,AVP类似物)刺激条件下,与正常组比较,尿量明显增加而尿渗量明显减低(即类似于尿崩症的表现)。提示GSK-3β在肾脏浓缩功能中发挥了重要作用。该作者进一步研究发现,GSK-3β基因敲除小鼠或利用SB216763抑制GSK-3β活性后,集合管上皮细胞腺苷酸环化酶的活性明显下降,致使细胞内cAMP的水平减低,影响AQP2的表达甚至细胞分布,肾脏调节水平衡的能力下降,出现上述类似尿崩症的表现。
GSK-3β可下调环氧化酶2(COX2)的表达[16],锂抑制GSK-3β活性,细胞内COX2水平上升,前列腺素E2(PGE2)产生增加,促进AQP2在溶酶体降解。Rao等[17]利用锂制作NDI模型,检出肾髓质间质细胞(RMICs)COX2表达上升,尿液中PGE2排泄增加,使用COX2抑制剂可缓解NDI小鼠尿崩症症状;锂处理NDI小鼠,检测RMICs中GSK-3β活性下降,此现象与COX2升高处于同一时期。Kortenoeven等[18]通过体外实验证实,PGE2促进AQP2在溶酶体的降解,而不会影响细胞内AQP2基因表达。提示RMICs中GSK-3β活性下降提高了COX2表达,产生更多的PGE2,可能通过旁分泌形式作用于集合管上皮细胞,拮抗AVP的作用。
GSK-3β可能参与维持组织正常结构与功能。首先, GSK-3β敲除小鼠,胚胎发育过程中心肌细胞过度增生造成肥厚性心肌病[19]。Kjaersg-aard等[7]发现,小鼠出生后第7天开始饲喂含柠檬酸锂的食物(50 mmol 锂/kg食物)至第28天,小鼠集合管形成异常微囊泡结构,并证实其为主细胞及闰细胞增生所致。长期服用锂的患者,肾穿刺组织切片上可见异常类似的微囊泡结构,沿微囊泡分布的邻近上皮细胞内可检出高水平磷酸化的GSK-3β[2]。Rao等[15]构建的集合管特异性GSK-3β基因敲除小鼠中并未观察到细胞增生与囊泡结构的形成。Nielsen等[20]提出,短期锂处理可能主要通过相关信号通路最终影响AQP2的表达丰度及细胞分布,长期锂的处理才会引起细胞异常增生,改变集合管正常形态结构。
GSK-3β参与调节肾脏尿液浓缩功能可能主要通过以下两种机制:(1)GSK-3β影响COX2-PGE或腺苷酸环化酶-cAMP的生成,调节AQP2的表达及细胞分布;(2)GSK-3β参与维持肾脏集合管的正常形态,长期使用GSK-3β抑制剂可使集合管发生微囊泡,这种异常改变削弱了集合管上皮细胞对血管加压素的反应性[2]。GSK-3β通过COX-PGE2或腺苷酸环化酶-cAMP调节AVP尿液浓缩功能的作用。首先,锂抑制肾RMICs中GSK-3活性后,细胞内COX2及PGE2的水平升高,可能通过旁分泌的方式作用于集合管上皮细胞相应受体(EP1/EP3),拮抗AVP诱导的cAMP水平的上调。其次,GSK-3可直接正性调节集合管上皮细胞内COX2的活性,促进cAMP的生成及AQP2的生成和AQP2翻转到顶端膜侧。因此,GSK-3活性被抑制后,cAMP及AQP2的生成减少或分布异常,导致肾脏尿液浓缩能力下降(图2)。
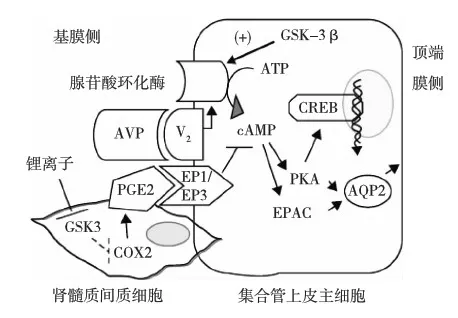
图2 糖原合酶激酶3(GSK-3)通过两种方式参与调节肾脏尿液浓缩功能[2]
GSK-3β与足细胞损伤
Nephrin与Nck接头蛋白、白细胞分化抗原2相关蛋白(CD2AP)、闭合小环蛋白1等构成蛋白复合体,维持足细胞足突裂孔膜(SD)正常结构与功能。一方面,Nephrin是参与构成SD的分子之一,另外,Nephrin还可转导细胞外信号至足细胞内,引起足细胞骨架行为变化或相关基因的表达[21]。Zhou等[22]与Yook等[23]的研究发现,在Wnt通路中GSK-3β可使细胞转录因子(Snail)发生磷酸化,促进后者发生泛素化而后沿蛋白酶复合体降解。Matsui等[24]对嘌呤霉素氨基核苷肾病PAN(小鼠模型)的研究发现,PAN小鼠Wnt2表达上调,激活 GSK-3β发生磷酸化失活, Snail泛素化受阻得以在足细胞内积累。Snail可与neph基因(表达nephrin蛋白)E-box序列结合,抑制nephrin的表达,可引起足细胞损伤、产生蛋白尿。
器官移植受者长期应用雷帕霉素可引起足细胞损伤或肾小球局灶节段硬化性病变,发生蛋白尿。Vollenbröker等[25]利用雷帕霉素处理人源足细胞株,mTOR表达表达水平减低及其磷酸化水平均减低,导致SD蛋白成分或细胞骨架蛋白(如nephrin,TRPC6,和 Nck)表达减少,并使骨架蛋白actin形成异常斑点状结构,足细胞迁移、黏附能力也明显下降。足细胞长期接受雷帕霉素刺激,细胞内GSK-3β磷酸化水平增高而失活,提示GSK-3β可能参与足细胞损伤。Vollenbroker等[25]利用GSK-3β抑制剂(锂及SB-216763)处理足细胞,观察到足细胞SD蛋白成分及细胞骨架蛋白表达减少且分布异常,伴随足细胞迁移能力的减弱,足细胞损伤形式与雷帕霉素处理后大致相同。GSK-3β抑制剂导致足细胞损伤的同时,mTOR通路下游分子p70S6K磷酸化水平减低,提示GSK-3β可能参与了雷帕霉素诱导蛋白尿的发生机制[26]。
因此,在PAN足细胞损伤模型中, Wnt通路激活使GSK-3β磷酸化失活,Snail泛素化受阻降解减少而在细胞质内聚集,转移至细胞核抑制nephrin表达。雷帕霉素抑制足细胞mTOR表达及其磷酸化,而增加GSK-3β磷酸化,引起足细胞分子表型改变及细胞骨架行为变化。综上所述,GSK-3β可能是沟通Wnt、mTOR两条重要信号通路的关节点,Vigneron等[27]在心脏缺血再灌注损伤的研究中也提出了同样的观点。
小结:GSK-3β通过直接调节集合管上皮细胞环氧合酶或cAMP的水平,或间接影响肾脏RMICs中COX2的水平及其产生PGE2的能力,继而再作用于集合管上皮细胞,影响AQP2的表达及其细胞分布,参与AVP对肾脏水平衡的调节。另外,GSK-3β还可能参与维持了集合管上皮的增生及正常形态。在PAN模型及雷帕霉素诱导蛋白尿的体外研究中,GSK-3β活性被抑制后,足细胞相关分子表达、细胞骨架结构发生改变而导致蛋白尿发生。因此, GSK-3β在肾脏生理病理过程中具有重要作用,不仅影响肾脏的尿液浓缩功能,且GSK-3β活性被抑制后可导致足细胞损伤产生蛋白尿。GSK-3β广泛参与生物细胞多种生命活动过程,在肿瘤、阿尔兹海默病等精神性疾病中也有重要作用,已成为治疗多种疾病的新靶点,同时也应关注应用GSK-3β抑制剂可能带来的负效应。
1 Kaidanovich-Beilin O,Woodgett JR.GSK-3:functional insights from cell biology and animal models.Frontiers Mol Neurosci,2011,4:40.
2 Rao R.Glycogen synthase kinase-3 regulation of urinary concentrating ability.Curr Opin Nephrol Hypertens,2012,21(5):541-546.
3 Howard C,Tao S,Yang HC,et al.Specific deletion of glycogen synthase kinase-3beta in the renal proximal tubule protects against acute nephrotoxic injury in mice.Kidney Int,2012,82(9):1000-1009.
4 Torras J,Herrero-Fresneda I,Gulias O,et al.Rapamycin has dual opposing effects on proteinuric experimental nephropathies:is it a matter of podocyte damage? Nephrol Dial Transplant,2009,24(12):3632-3640.
5 左明新,陈晓光.糖原合成酶激酶-3及其抑制剂研究进展.国际药学研究杂志,2007,34(4):259-270.
6 MacAulay K,Doble BW,Patel S,et al.Glycogen synthase kinase 3alpha-specific regulation of murine hepatic glycogen metabolism.Cell Metab,2007,6(4):329-337.
7 Kjaersgaard G,Madsen K,Marcussen N,et al.Tissue injury after lithium treatment in human and rat postnatal kidney involves glycogen synthase kinase-3beta-positive epithelium.Am J Physiol Renal Physiol,2012,302(4):F455-465.
8 李建莎,吴人亮.糖原合成酶激酶3的调节与功能.医学分子生物学杂志,2006,3(5):383-386.
9 Jope RS.Lithium and GSK-3:one inhibitor,two inhibitory actions,multiple outcomes.Trends Pharmacol Sci,2003,24(9):441-443.
10 Nakamura T,Hamada F,Ishidate T,et al.Axin,an inhibitor of the Wnt signalling pathway,interacts with beta-catenin,GSK-3eta and APC and reduces the beta-catenin level.Genes Cells,1998,3(6):395-403.
11 Wu D,Pan W.GSK3:a multifaceted kinase in Wnt signaling.Trends Biochem Sci,2010,35(3):161-168.
12 Tsukigi M,Bilim V,Yuuki K,et al.Re-expression of miR-199a suppresses renal cancer cell proliferation and survival by targeting GSK-3beta.Cancer Letters,2011,315(2):189-197.
13 Boone M,Deen PM.Physiology and pathophysiology of the vasopressin-regulated renal water reabsorption.Pflugers Arch,2008,456(6):1005-1024.
14 Moeller HB,Fenton RA.Cell biology of vasopressin-regulated aquaporin -2 trafficking.Pflugers Arch,2012,464(2):133-144.
15 Rao R,Patel S,Hao C,et al.GSK3beta mediates renal response to vasopressin by modulating adenylate cyclase activity.J Am Soc Nephrol,2010,21(3):428-437.
16 Rao R,Hao CM,Breyer MD.Hypertonic stress activates glycogen synthase kinase 3beta-mediated apoptosis of renal medullary interstitial cells,suppressing an NFkappaB-driven cyclooxygenase-2-dependent survival pathway.J Biol Chem,2004,279(6):3949-3955.
17 Rao R,Zhang MZ,Zhao M,et al.Lithium treatment inhibits renal GSK-3 activity and promotes cyclooxygenase 2-dependent polyuria.Am J Physiol Renal Physiol,2004,288(4):F642-649.
18 Kortenoeven ML,Schweer H,Cox R,et al.Lithium reduces aquaporin-2 transcription independent of prostaglandins.Am J Physiol Cell Physiol,2012,302(1):C131-140.
19 Kerkela R,Kockeritz L,Macaulay K,et al.Deletion of GSK-3beta in mice leads to hypertrophic cardiomyopathy secondary to cardiomyoblast hyperproliferation.J Clin Invest,2008,118(11):3609-3618.
20 Nielsen J,Hoffert JD,Knepper MA.Proteomic analysis of lithium-induced nephrogenic diabetes insipidus:mechanisms for aquaporin 2 down-regulation and cellular proliferation.Proc Natl Acad Sci USA,2008,105(9):3634-3639.
21 Chuang PY,He JC.Signaling in Regulation of Podocyte Phenotypes.Nephron Physiol,2009,111(2):9-15.
22 Zhou BP,Deng J,Xia W,et al.Dual regulation of snail by GSK-3β-mediated phosphorylation in control of epithelial-mesenchymal transition.Nat Cell Biol,2004,6(10):931-940.
23 Yook JI,li XY,Ota I,et al.Wnt-dependent regulation of the E-cadherin repressor snail.J Biol Chem,2005,280(12):11740-11748.
24 Matsui I,Ito T,Kurihara H,et al.Snail,a transcriptional regulator,represses nephrin expression in glomerular epithelial cells of nephrotic rats.Lab Invest,2007,87(3):273-283.
25 Vollenbröker B,George B,Wolfgart M,et al.mTOR regulates expression of slit diaphragm proteins and cytoskeleton structure in podocytes.Am J Physiol Renal Physiol,2009,296(2):F418-426.
26 George B,Vollenbröker B,Saleem MA,et al.GSK3beta inactivation in podocytes results in decreased phosphorylation of p70S6K accompanied by cytoskeletal rearrangements and inhibited motility.Am J Physiol Renal Physiol,2011,300(5):F1152-1162.
27 Vigneron F,Dos Santos P,Lemoine S,et al.GSK-3beta at the crossroads in the signalling of heart preconditioning:implication of mTOR and Wnt pathways.Cardiovasc Res,2011,90(1):49-56.
