活化蛋白C的研究进展
2013-11-26综述丁涵露审校
陈 娅 综述 丁涵露 王 莉 审校
蛋白C由PROC基因编码,位于染色体2q13-q14上,主要由肝脏合成。其功能状态为12个氨基酸组成的活性多肽——活化蛋白C(APC),属于胰岛素样丝氨酸蛋白酶家族,正常血浆含量约40 pM,半衰期约15 min[1]。目前常通过转基因或基因缺失的动物模型来研究APC的作用效应。血浆APC的含量及存在方式检测主要采用发色底物法、酶联免疫吸附法或放射免疫法等,学者们通过不断改进的检测方式,进一步完善对APC的生物学结构功能认识。现将APC的研究进展作一综述。
蛋白C/APC的结构
蛋白C由γ羧基谷氨酸域、直接连接的2个EGF域、胰岛素样丝氨酸蛋白酶区组成[2]。其丝氨酸蛋白酶域在凝血酶-血栓调节蛋白(T-TM)复合物作用下产生APC发挥生物学功能(图1)。APC活性区由丝氨酸蛋白酶区上的 His211、Asp257和Ser360组成,功能主要集中在N端的谷氨酸域和C端的丝氨酸蛋白酶域。
APC的生物学功能
APC与功能受体 蛋白C有效活化需要血栓调节蛋白(TM)和内皮细胞蛋白C受体(EPCR)。TM与凝血酶有高度亲和力,促使APC的形成,其中EPCR通过结合蛋白C并呈递TM-T复合物进一步加快APC的形成,APC与受体EPCR解离后发挥抗凝作用,而发挥细胞保护作用则需要EPCR和蛋白酶活化受体1(PAR-1)的参与。EPCR有跨膜和可溶性两种形式。炎症状态时,血浆中可溶性EPCR上调,与APC结合后抗凝活性消失,能被活化白细胞膜上表达的蛋白酶3识别、裂解及灭活,蛋白酶3的功能尚不清,可能与灭活蛋白 C途径有关[3]。Pérez-Casal等[4]用外源性 APC 处理单核细胞或内皮细胞时,发现微粒体上的EPCR与APC结合增多,阻断细胞表面EPCR后,其抗凝及细胞保护作用仍存在。脓素症患者APC治疗时,循环中微粒体上的EPCR-APC复合物含量增加,并通过激活PAR-1和上调1磷酸鞘氨醇(S1P)发挥抗凋亡及内皮保护作用[5],但其确切机制有待进一步研究。另外,PAR-1也是APC实施生物功能的重要组成部分,是一个7-跨膜结构域的 G蛋白偶联受体,EPCR和PAR-1在内皮上共区域化是调节APC保护信号的关键。
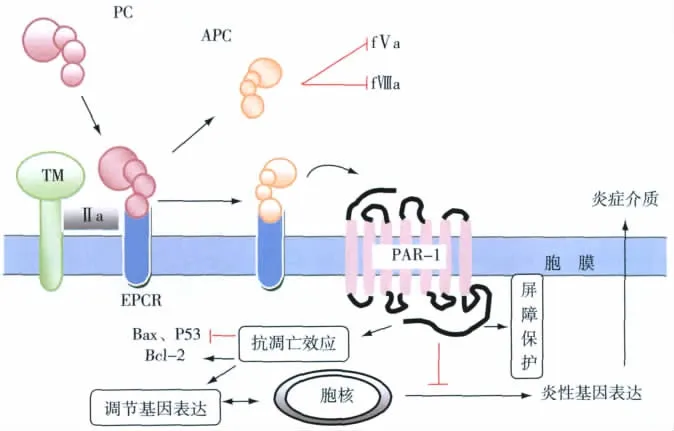
图1 APC在内皮细胞活化过程及发挥生物学功能的通路
APC的抗凝作用 APC是一个重要的抗凝因子,主要通过灭活凝血因子FVa和FⅧa的活性发挥抗凝作用,蛋白S、FV、高密度脂蛋白、阴离子磷脂和鞘糖脂协助APC的抗凝功能[6]。血浆内源性蛋白C抑制物(PCI)、α12抗胰蛋白酶和α22巨球蛋白与APC的谷氨酸域结合率高,使其血浆含量减低,抑制APC的抗凝效能。另一方面,APC促进内皮细胞释放纤溶酶原激活物,同时抑制纤溶酶原激活物抑制因子l(PAI-1)和凝血酶激活的纤溶抑制因子(TAFI),从而激活纤溶系统[2]。
APC的抗炎作用 APC除了通过抗凝发挥间接的抗炎作用外,还可干预细胞释放促炎症因子及炎症细胞的作用发挥直接的抗炎效应。炎症状态下,APC阻断核因子 κB(NF-κB)转录因子,下调炎性蛋白mRNA转录水平,从而减少炎性因子及趋化因子[7]。还能抑制脂多糖诱导的白细胞介素 6(IL-6)、IL-8、IL-1B 及肿瘤坏死因子 α(TNF-α)产生。并可通过抑制活性蛋白1(AP-1)家族c-Fos和Fos B中炎性转录因子的表达,下调趋化因子及黏附因子的表达,以缩小炎症范围[2]。人脐静脉内皮细胞实验研究显示,APC能促进环氧化酶2(COX-2)产生抗炎介质前列腺素 I2,也可通过PAR-1和p38丝裂原活化蛋白激酶(p38MAPK)途径刺激血单核细胞分泌抗炎因子IL-10,从而抵消促炎症因子[8]。体外实验也证实APC明显降低粒细胞在趋化因子作用下的移动能力,下调整联蛋白介导的粒细胞迁移,从而减少炎症区域中性粒细胞集聚[7]。
APC的抗凋亡作用 APC与EPCR结合,激活PAR-1通路实现抗凋亡作用。研究发现APC通过减低Bax/Bcl-2促凋亡比值及caspase-3的活性来限制N-甲基-D-天冬氨酸诱导的兴奋毒性损伤引起的神经凋亡的发生[2]。人类大脑内皮细胞在低氧条件下,APC通过减少P53蛋白发挥抗凋亡作用。在脓毒症鼠模型中,APC-EPCR复合物激活 PAR-1[9],缓解活性氧簇和亚硝酸盐对呼吸链复合物的破坏,抑制线粒体损伤凋亡。同时,APC能刺激人脐静脉内皮细胞表达B细胞淋巴瘤2-L1(BCL2L1)、前列腺素过氧化物合酶2(PTGS2)等抗凋亡因子,而抑制促凋亡基因的表达。Pérez-Casal[4]等也发现经外源性APC通过上调抗凋亡基因,抑制十字孢碱诱导人脐静脉内皮细胞凋亡作用。O'Brien等[9]也证实APC抑制TNF相关的凋亡诱导配体(TRAIL),导致细胞凋亡受阻。当然,APC介导的复杂凋亡信号途径尚需更多研究证实。
APC介导的内皮细胞屏障稳定作用 APC通过EPCR依赖的PAR-1激活,刺激鞘氨醇激酶1(SphK-1)形成血管内皮屏障稳定物——S1P,保护内皮屏障。S1P激活S1P受体1(S1P1),保护细胞骨架的稳定性,加强内皮细胞之间的缝隙连接,保护内皮屏障[7]。其中活化S1P1依赖于磷酸脂酰肌醇3-激酶途径。目前,APC激活PAR-1产生内皮保护功能的机制仍不清楚。多位学者发现APC在Arg46位点裂解 PAR-1 介导内皮屏障稳定信号[10,11]。Pérez-Casal等[4]在人脐静脉内皮实验中发现 S1P 信号途径可磷酸化激酶插入区受体(KDR),通过特异性阻断KDR作用时,其APC完全失去内皮保护作用。最近发现,APC激活PAR-1发挥内皮屏障保护功能是依赖β抑制蛋白,通过干预β抑制蛋白表达时,APC诱导的内皮保护信号被阻断,但不能阻断凝血酶诱导的内皮屏障破坏,研究证实了β抑制蛋白在APC信号通路中的重要性[12]。另外,APC能减少凝血酶诱导的蛋白高渗出,改善氧自由导致的内皮屏障通透性增加,同时减少炎性介质及黏附因子对血管内皮的损伤[2]。
APC相关变异体的研究
为明确APC功能与结构之间的关系,学者对其多种突变体进行了研究。Gla域残基的诱变确定了Gla域与APC抗凝活性密切相关,显示出leu8是APC结合EPCR关键的氨基酸。RR229/230AA和KKK191-193AAA不能裂解FVa减少了抗凝活性,但仍发挥的细胞保护活性,也相应说明了APC独立于抗凝的细胞保护作用[7]。将APC环上的37和70所带正电荷群抵消,可阻滞APC和FVa间的相互作用,从而消除抗凝活性。近来研究发现,APC的自溶环对FⅧa的灭活也很重要,R306、K311和R314的突变导致 FⅧa的灭活明显减少[13]。Bae等[14]研究发现,在Cys67和Cys82之间增加一个二硫键,可稳定Ca2+结合环和提高APC的抗凝活性,然而降低了APC的细胞保护作用。丙氨酸取代GLU-167和GLU-170不影响抗凝活性,而抗渗透性和抗炎效应将丢失。Mosnier等[15]发现,C末端的突变(E149A),剥夺了APC的细胞保护功能,然而增加了抗凝活性。近期Pozzi等[16]发现E160A/D167A/D172A的APC突变体能提高凝血酶激活率,且速度比野生型蛋白C快63倍。这些不同变异体的研究显示了APC的结构-功能关系的重要性,并展现出APC的多效的生物学功能。
APC与糖尿病肾病(DN)
糖尿病(DM)患病率呈逐年迅速上升趋势,其中15%~40%的DM患者发生DN。研究发现在DM患者血栓调节蛋白从内皮上丢失,导致蛋白C活化受限,至血浆 APC不同程度的下降[17]。为了解释APC与DN的关系,Isermann等[18]通过基因工程获得APC活化受阻和APC高表达的DN小鼠模型,28周后APC活化受限组出现严重的蛋白尿及肾小球细胞外基质的增生。相反,高表达APC组蛋白尿明显减少。同时,APC抑制肾皮质中高糖诱导的P53和Bax蛋白的表达及内皮细胞和足细胞的凋亡。最近研究发现APC的肾脏保护作用依赖caveolin-1的脱磷酸的PAR-3的激活,并发现APC减轻脂多糖诱导的系膜损伤和蛋白尿[19]。Gil-Bernabe等[20]给 DN 小鼠腹腔注入 APC,一月后与未处理组比较发现,血尿素氮与血清肌酐、尿总蛋白与肌酐比及尿蛋白水平明显改善。肾组织中的单核细胞趋化蛋白1(MCP-1)、血管内皮生长因子(VEGF)的浓度减少,且血小板衍生因子(PDGF)、TGF-β1和结缔组织生长因子(CTGF)的RNA表达水平明显降低,凋亡细胞百分比也相应减少。Xue等[21]研究发现,予重组APC干预的NOD小鼠,DM的发生率从70%(对照组)降至7.6%,并促进了胰岛素的表达,推测APC可能有直接的胰岛β细胞的保护作用[21]。目前关于APC在DN中作用的研究,在一定程度上说明APC减少是DM肾小球毛细血管功能紊乱的一个潜在机制。
DN患者发生心血管疾病风险增高,其机制尚不十分明确,除了传统的危险因素,目前研究发现APC在DN患者动脉粥样硬化中发挥重要作用。曾有研究报道APC抵抗与动脉粥样硬化有关。另有研究发现DM患者APC产生明显下降,且APC水平下降与动脉粥样硬化进展、颈动脉内-中膜厚度(IMT)呈负相关[22]。APC下降会削弱内皮细胞对抗凋亡、氧化应激、炎症的能力,使DM血管内皮损伤和内皮功能紊乱更加严重,导致动脉粥样硬化快速发展。但对于APC与DN动脉粥样硬化关系的研究大多来源于动物模型,其发生发展的作用尚需进一步研究明确。
小结:APC具有抗凝、抗炎、抗凋亡及保护内皮屏障的生物学功能,改善多种疾病的结局及预后。研究证实,APC能延缓DN发展,与DN常见并发症动脉粥样硬化的程度呈负相关,但目前确切的发生机制及延缓措施尚不清楚。因此,需进一步研究APC在DN患者动脉粥样硬化中的作用机制和功能,使APC成为可能的干预手段。
1 Tran S,Dahlbäck B.Novel APC-cleavage sites in FVa provide insights into mechanisms of action of APCand its cofactor protein S.JThromb Haemost,2010,8(1):129-136.
2 Neyrinck AP,Liu KD,Howard JP,et al.Protective mechanisms of activated protein C in severe inflammatory disorders.Br J Pharmacol,2009,158(4):1034-1047.
3 Villegas-Mendez A,Montes R,Ambrose LR,et al.Proteolysis of the endothelial cell protein C receptor by neutrophil proteinase 3.J Thromb Haemost,2007,5(5):980-988.
4 Pérez-Casal M,Downey C,Cutillas-Moreno B,et al.Microparticleassociated endothelial protein C receptor and the induction of cytoprotective and anti-inflammatory effects.Haematologica,2009,94(3):387-394.
5 Andriantsitohaina R.Microparticles as biological vectors of activated protein Ctreatment in sepsis.Crit Care,2011,15(5):197.
6 Griffin JH,Zlokovic BV,Mosnier LO.Protein C anticoagulant and cytoprotective pathways.Int JHematol,2012,95(4):333-345.
7 Sarangi PP,Lee HW,Kim M.Activated protein C action in inflammation.Br J Haematol,2010,148(6):817-833.
8 Galley HF,El Sakka NE,Webster NR,et al.Activated protein C inhibits chemotaxis and interleukin-6 release by human neutrophils without affecting other neutrophil functions.Br J Anaesth,2008,100(6):815-819.
9 O'Brien LA,Richardson MA,Mehrbod SF,et al.Activated protein C decreases tumor necrosis factor related apoptosis-inducing ligand by an EPCR-independent mechanism involving Egr-1/Erk-1/2 activation.Arterioscler Thromb Vasc Biol,2007,27(12):2634-2641.
10 Mosnier LO,Sinha RK,Burnier L,et al.Biased agonism of proteaseactivated receptor 1 by activated protein C caused by noncanonical cleavage at Arg46.Blood,2012,120(26):5237-5246.
11 Schuepbach RA,Madon J,Ender M,et al.Protease-activated receptor-1 cleaved at R46 mediates cytoprotective effects.J Thromb Haemost,2012,10(8):1675-1684.
12 Soh UJ,Trejo J.Activated protein C promotes protease-activated receptor-1 cytoprotective signaling throughβ-arrestin and dishevelled-2 scaffolds.Proc Natl Acad Sci U SA,2011,108(50):1372-1380.
13 Cramer TJ,Gale AJ.Function of the activated protein C(APC)autolysis loop in activated FVIII inactivation.Br J Haematol,2011,153(5):644-654.
14 Bae JS,Yang L,Manithody C,et al.Engineering a disulfide bond to stabilize the calcium-binding loop of activated protein Celiminates its anticoagulant but not its protective signaling properties.J Biol Chem,2007,282(12):9251-9259.
15 Mosnier LO,Zampolli A,Kerschen EJ,et al.Hyperantithrombotic,noncytoprotective Glu149Ala-activated protein C mutant.Blood,2009,113(23):5970-5978.
16 Pozzi N,Barranco-Medina S,Chen Z,et al.Exposure of R169 controls protein C activation and autoactivation.Blood,2012,120(3):664-670.
17 Brosius FC,Khoury CC,Buller CL,et al.Abnormalities in signaling pathways in diabetic nephropathy.Expert Rev Endocrinol Metab,2010,5(1):51-64.
18 Isermann B,Vinnikov IA,Madhusudhan T,et al.Activated protein C protects against diabetic nephropathy by inhibiting endothelial and podocyte apoptosis.Nat Med,2007,13(11):1349-1358.
19 Madhusudhan T,Wang H,Straub BK,et al.Cytoprotective signaling by activated protein C requires protease-activated receptor-3 in podocytes.Blood,2012,119(3):874-883.
20 Gil-Bernabe P,D'Alessandro-Gabazza CN,Toda M,et al.Exogenous activated protein C inhibits the progression of diabetic nephropathy.J Thromb Haemost,2012,10(3):337-346.
21 Xue M,Dervish S,Harrison LC,et al.Activated protein C inhibits pancreatic islet inflammation,stimulates t regulatory cells,and prevents diabetes in non-obese diabetic(NOD)mice.J Biol Chem,2012,287(20):16356-16364.
22 Matsumoto K,Yano Y,Gabazza EC,et al.Inverse correlation between activated protein C generation and carotid atherosclerosis in Type 2 diabetic patients.Diabet Med,2007,24(12):1322-1328.
