布鲁氏菌16MΔomp31基因缺失株的构建与鉴定
2013-04-26王慧张亚丽王远志陈创夫任晓丽
王慧,张亚丽,王远志,陈创夫,任晓丽
(1石河子大学医学院,新疆地方与民族高发病教育部重点实验室,石河子 832002;2石河子大学动物科技学院,石河子 832003)
布鲁氏菌病是由布鲁氏菌属(Brucella)成员引起的一种慢性人畜共患传染病[1-2]。人感染后表现为持续发热、多汗及肝脾肿大,家畜感染后可造成流产、空怀等[3]。目前,此病已使全世界遭受了巨大的经济损失。近年来,随着畜牧业的发展,我国和世界部分地区布鲁氏菌病的人畜疫情均出现回升势头[4]。
布鲁氏菌外膜蛋白OMP31是布鲁氏菌高度保守的特异性蛋白[5],也是一种公认的毒力因子[6],其和细菌脂多糖成分一样均能够诱导产生保护性的免疫反应[7]。目前国外许多学者对布鲁氏菌omp31基因均有研究,Gupta等[8]利用羊种布鲁氏菌16M构建出可编码外膜蛋白OMP31的DNA疫苗,证明了该疫苗具有介导小鼠细胞免疫及体液免疫的功能;Grilló等[9]利用羊种布鲁氏菌Rev.1株构建了bp26及bp26/omp31基因缺失株,为建立一种针对同时感染绵羊种及羊种布鲁氏菌的新型疫苗奠定基础。
因此,本研究将构建羊种布鲁氏菌16MΔomp31基因缺失株,并对其遗传稳定性进行检测,旨在为进一步揭示布鲁氏菌对感染细胞的抗凋亡机制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株
羊种布鲁氏菌16M国际标准株、枯草芽孢杆菌B115株、大肠杆菌E.coli DH5α克隆菌株均由新疆地方与民族高发病教育部重点实验室保存。
1.1.2 培养基、试剂、主要试剂盒
Brucella Broth培养基及Brucella Broth Agar培养基均购自美国BD公司;Taq DNA聚合酶购自北京天根生物有限公司,限制性核酸内切酶(Sph I、Xho I、BamH I、Sac I)及 T4DNA 连接酶、DNA Marker均购自Takara公司;pGEM-7Zf+自杀性质粒购自Promega公司;pMD18-T载体购自Takara公司;DNA凝胶回收试剂盒、高纯度质粒DNA小提中量试剂盒购自北京天根生物公司;其他试剂为国产分析纯产品。
1.2 方法
1.2.1 引物
所用引物均由上海生工生物技术服务有限公司合成。序列见表1。

表1 PCR引物序列Tab.1 Sequences of PCR primers
1.2.2 同源臂及SacB基因的扩增
以布鲁氏菌16M国际标准株基因组为模板,分别以引物omp31-N-F、omp31-N-R,扩增出omp31的N端同源臂。
PCR反应条件为:94℃预变性5min;94℃变性30s,66.6℃退火40s,72℃延伸1min 10s,30个循环;最后延伸72℃7min。
再以布鲁氏菌16M为模板利用引物omp31-CF、omp31-C-R,扩增出omp31的 C端同源臂,PCR反应条件为:94℃预变性5min;94℃变性30s,67.2℃退火40s,72℃延伸1min 10s,35个循环;最后延伸72℃7min。
最后以枯草芽孢杆菌B115株为模板利用引物sacB-F、sacB-R 扩增出 SacB 基因,PCR 反应条件为:95℃预变性5min;94℃变性40s,56℃退火40 s,72℃延伸2min,30个循环;最后延伸72℃10 min。
所得产物用1%琼脂糖凝胶电泳检测后回收,连接T载体,转入大肠杆菌E.coli DH5α克隆菌株,送华大基因科技股份有限公司测序。
1.2.3 pGEM-7zf+-Δomp31-sacB同源重组质粒的构建
将测序正确的菌液提质粒,利用限制性内切酶Sph I/Xho I、Xho I/BamH I、BamH I/Sac I分别酶切omp31的N端同源臂、C端同源臂、SacB质粒及自杀载体pGEM-7zf+,并利用T4DNA连接酶连与重组自杀载体上,构建成自杀性质粒pGEM-7zf+-Δomp31-sacB,转入大肠杆菌E.coli DH5α克隆菌株,送华大基因科技股份有限公司测序。
1.2.4 布鲁氏菌omp31基因缺失株的筛选及鉴定
取约2μL(250ng/μL)自杀性质粒加入到200 μL布鲁氏菌16M感受态细胞中混匀,冰上静置15 min,移入2mm电击杯中,E=2.5KV/cm电击,立即加入到37℃预热的800LBrucella Broth培养基中,37℃摇床培养24h后,8000r/min离心2min,吹打混匀,涂布于含100mg/L Ampr抗性的布鲁氏菌固体培养基进行1次同源重组,37℃培养48-72 h后,挑取单菌落做PCR鉴定。
将阳性菌落加液体培养基培养24h后,取100 μL菌液涂布于含8%蔗糖的布鲁氏菌固体培养基,进行2次同源重组,所得阳性菌命名为16MΔomp31。
1.2.5 对16MΔomp31进行遗传稳定检测
将获得的16MΔomp31基因缺失株在Brucella Broth无抗板上传至3代后,挑取单菌落灭活并做菌落PCR,将所获得条带回收后与pMD18-T载体连接后送华大基因科技股份有限公司测序,测序正确后继续在无抗板上传至15代,得到稳定的16MΔomp31基因缺失株。
2 结果与分析
2.1 omp31同源臂及SacB基因的PCR扩增鉴定
以布鲁氏菌16M国际标准株为模板,扩增出omp31的N端同源臂目的条带大小为1056bp(图1);扩增出omp31的C端同源臂目的条带大小为1046bp(图2),以枯草芽孢杆菌为模板,扩增出SacB基因目的条带大小为1477bp(图3);目的条带大小均与预期一致。
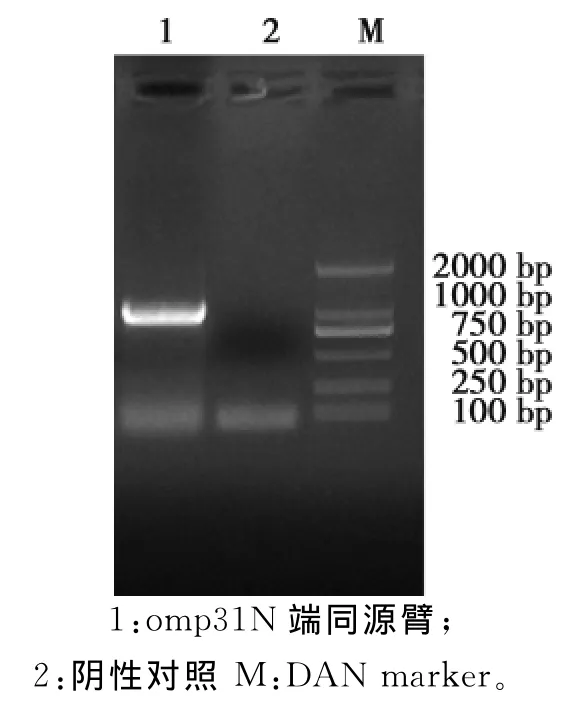
图1 omp31N端同源臂PCR扩增Fig.1 PCR amplification of omp31 N-terminal homologous arm
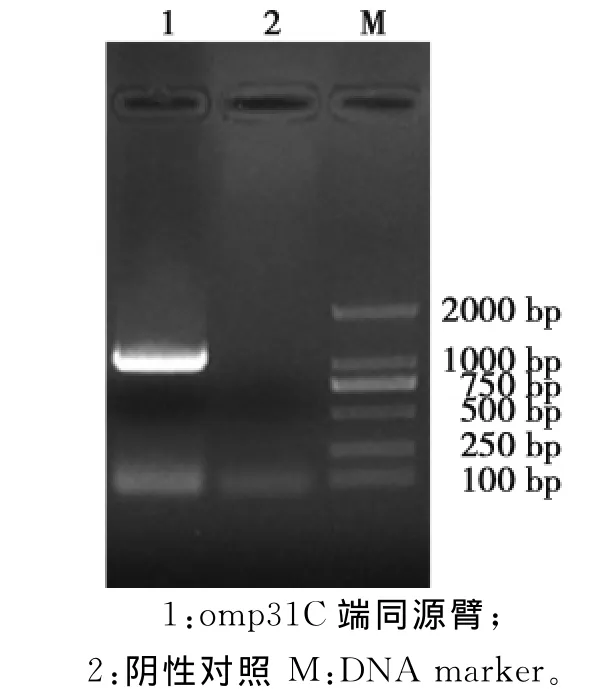
图2 omp31C端同源臂PCR扩增Fig.2 PCR amplification of omp31 C-terminal homologous arm
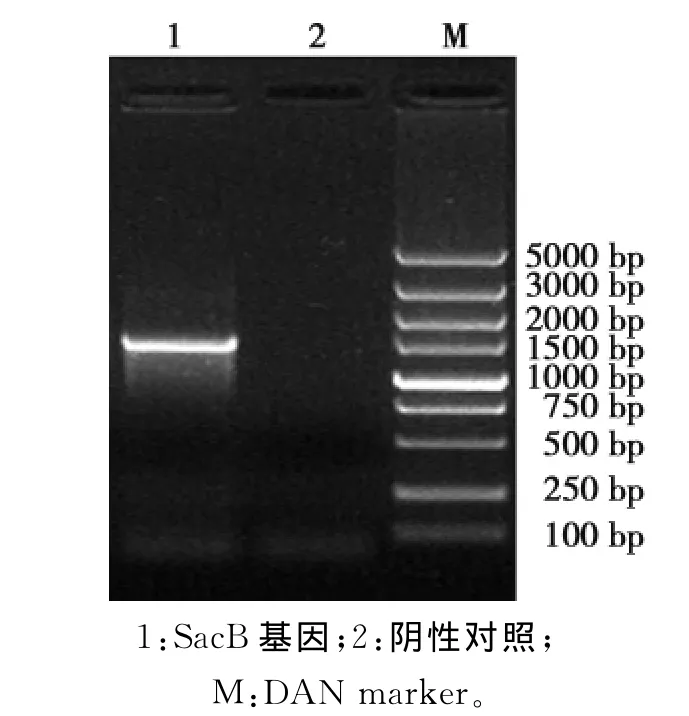
图3 SacB基因PCR扩增Fig.3 PCR amplification of SacB gene
2.2 同源重组质粒pGEM-7zf+-Δomp31-sacB酶切鉴定
结果见图4
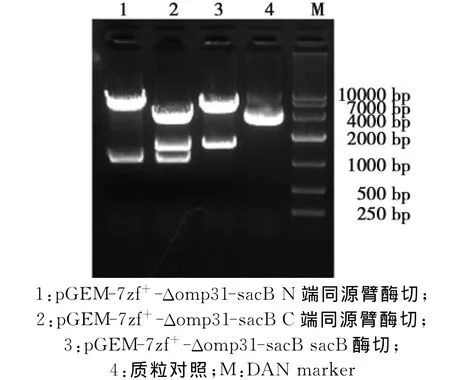
图4 同源重组质粒pGEM-7zf+-Δomp31-sacB酶切鉴定Fig.4 Homologous recombination plasmid of pGEM-7zf+ -Δomp31-sacB restriction enzyme digestion
由图4可见,利用限制性内切酶Sph I/Xho I、Xho I/BamH I、BamH I/Sac I酶切质粒 pGEM-7zf+-Δomp31-sacB,得到omp31的N端同源臂1056bp、omp 31的C端同源臂1046bp、SacB基因1477bp,结果与预期一致。
2.3 布鲁氏菌16M国际标准株omp31基因缺失株的筛选
挑取电转化后在Ampr抗性Brucella Broth培养基上生长的单菌落,用JC-F/JC-R做PCR鉴定,得到缺失后目的片段846bp,与未缺失目的片段1671bp,证明线性化的同源重组质粒已插入到16 M国际标准株的染色体上(图5)。再将阳性菌离心后涂布于含8%蔗糖的Brucella Broth Agar培养基,挑取单菌落做PCR鉴定,获得缺失后目的片段846bp,证明已成功构建布鲁氏菌16MΔomp31基因缺失株(图6)。
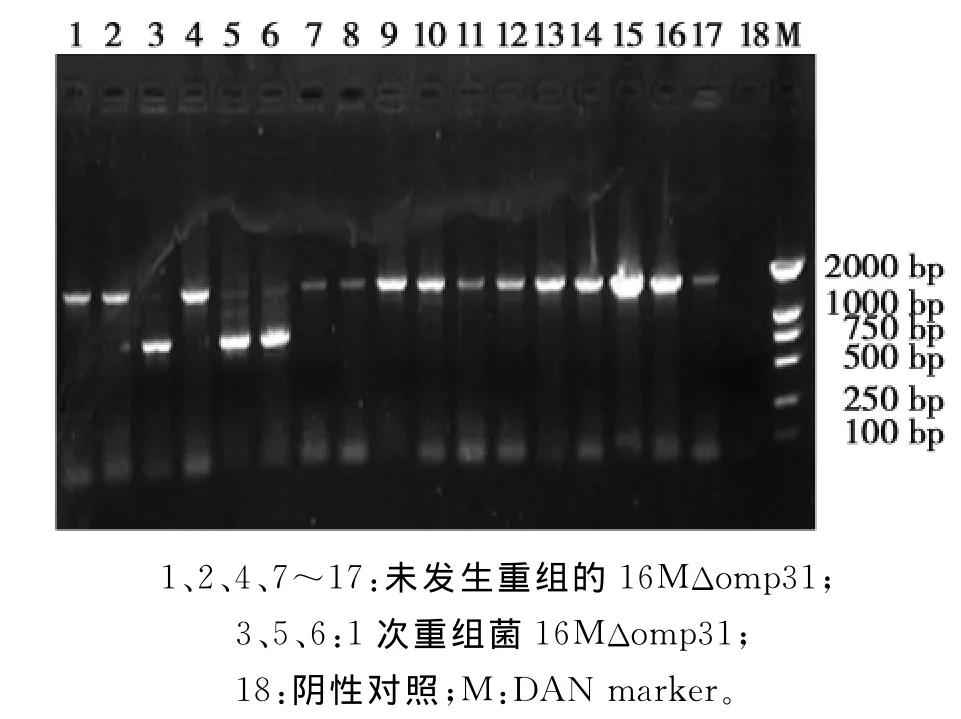
图5 1次同源重组的PCR鉴定Fig.5 Identification of the first recombinant strain of 16MΔomp31by PCR
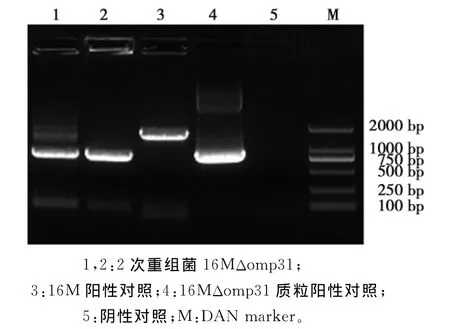
图6 2次同源重组的PCR鉴定Fig.6 Identification of the second recombinant strain of 16MΔomp31by PCR
2.4 布鲁氏菌16MΔomp31遗传稳定检测
将所获得基因缺失株送测序,所得结果与同源臂上的目的基因比对同源性达100%,继续传至15代未发生回复性突变,得到具有遗传稳定性的16MΔomp31的基因缺失株(图7)。
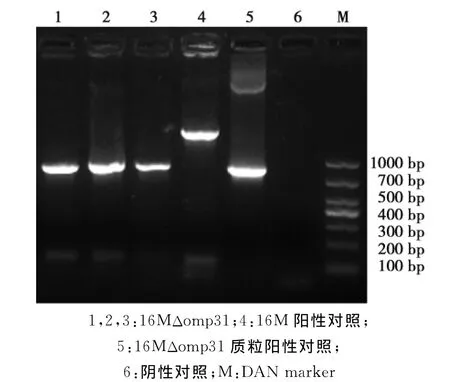
图7 16MΔomp31遗传稳定性检测Fig.7 Genetic stability test of 16MΔomp31
3 讨论
布鲁氏菌病是一种古老的人兽共患病,严重危害着人及多种动物的生命安全[10],此外还被一些西方国家列为恐怖战剂之一[11]。在我国主要以羊布鲁氏菌最为多见且其致病力最强,羊布鲁氏菌强毒株16M是典型胞内寄生菌,2002年DelVecchio[12]等人完成羊种布鲁氏菌16M株的全基因组序列测定工作,该项结果提供了羊种布鲁氏菌基因组大小、结构及生态复杂性等信息,为布鲁氏菌遗传进化关系提供分子生物学基础。
布鲁氏菌为兼性胞内寄生菌[13],人感染后常表现为慢性持续性感染,不易治愈[14]。巨噬细胞是布鲁氏菌生存和繁殖的靶细胞[15]。布鲁氏菌与巨噬细胞间胞内寄生关系对布鲁氏菌的慢性感染至关重要[16]。OMP31是布鲁氏菌一种重要的外膜蛋白,Laloux等[17]在酵母中进行了布鲁氏菌的全基因组的功能筛选,在啤酒酵母中筛选到羊种布鲁氏菌外膜蛋白OMP2b可抑制Bax诱导的细胞凋亡,因此我们推断布鲁氏菌的某些重要外膜蛋白可能会抑制细胞凋亡中蛋白的表达,从而抑制宿主细胞的凋亡。王远志等[18]运用酵母双杂交方法证明布鲁氏菌外膜蛋白OMP31与巨噬细胞的趋化因子(C-X-C)配体16有相互作用,并利用RNA干扰技术作用于巨噬细胞的趋化因子(C-X-C)配体16,布鲁氏菌感染的巨噬细胞凋亡程度加快,胞内生存能力明显减低,说明与布鲁氏菌外膜蛋白OMP31互作的宿主因子在布鲁氏菌的胞内寄生机凋亡中起关键作用。
因此,本实验利用常规分子生物学技术构建布鲁氏菌16MΔomp31基因缺失株,为进一步揭示omp31可能对布鲁氏菌胞内生存能力及参与巨噬细胞凋亡调节作用奠定了实验基础。
[1]Claire E D,Emma J S,Lorraine L P.Phenotypic and molecular characterization of Brucella isolates from marine mammals[J].BMC Microbiol,2008(8):224.
[2]Pappas G,Papadimitriou P,Akritidis N,et al.The new global map of human brucellosis[J].Lancet Infect Dis.2006,6(2):91-99.
[3]尚德秋.中国布鲁氏菌病防治科研50年[J].中华流行病学杂志,2000,21(1):55-57.
[4]王茂武,宫新生,尚德秋,等.市场经济下布鲁氏菌病防治工作的新思路[J].疾病监测,2004,19(8):306-308.
[5]胡剑飞,崔步云,关平原,等.布鲁氏菌外膜蛋白的研究进展[J].疾病监测,2010,25(5):380-389.
[6]Verstreate D R,Winter A J.Comparison of sodium dodecyl sulfate-polyacrylamide gel electrophoresis profiles and antigenic relatedness among outer membrane proteins of 49Brucella abortus strains[J].Infect Immun,1984,46(1):182-187.
[7]Cassataro J,Pasquevich K,Bruno L,at el.Antibody reactivity to OMP31from Brucella melitensis in human and animal infections by smooth and rough Brucellae[J].Clin Diagn Lab Immunol,2004,11(1):111-114.
[8]Gupta V K,Rout P K,Vihan V S.Induction of immune response in mice with a DNA vaccine encoding outer membrane protein(omp31)of Brucella melitensis 16M[J].Res Vet Sci,2007,82:305-313.
[9]GrillóJ,Marín C M,Barberán M,et al.Efficacy of bp26 and bp26/omp31B.melitensis Rev.1deletion mutants against Brucella ovis in rams[J].Vaccine,2009,27(2):187-191.
[10]张红星,陈创夫,王远志,等.羊种布鲁氏菌 M5-90 OMP31蛋白原核表达[J].石河子大学学报:自然科学版,2009,27(5):593-596.
[11]Robinson D B.The microbiology laboratory's role in response to bioterrorism[J].Arch Pathol Lab Med,2002,126(3):291-294.
[12]DelVecchio V G,Kapatral V,Elzer P,et al.The genome of Brucella melitensis[J].Vet Microbiol,2002,90:587-592.
[13]张艳,陈创夫,张辉,等.布鲁氏菌 WboA基因的原核表达与鉴定[J].石河子大学学报:自然科学版,2011,29(2):189-191.
[14]李臻,陈创夫,王远志,等.布鲁氏菌 M5-90ΔvirB2基因缺失株免疫小鼠抗体及相关细胞因子的检测研究[J].石河子大学学报:自然科学版,2011,29(4):452-455.
[15]杜军伟,王远志,陈创夫,等.实时定量PCR检测siRNA对小鼠巨噬细胞中FTH1基因表达的抑制作用[J].中国人兽共患病学报,2010,26(7):638-641.
[16]Carle A,Höppner C,Ahmed A K,et al.The Brucella suis type IV secretion system assembles in the cell envelope of the heterologous host Agrobacterium tumefaciens and increases IncQ plasmid pLS1recipient competence[J].Infect Immun,2006,74(1):108-117.
[17]Laloux G,Deghelt M,De Barsy M,et al.Identification of the essential Brucella melitensis porin Omp2bas a suppressor of Bax-Induced cell death in yeast in a genomewide Screening[J].PLoS One,2010,5(10):13274.
[18]王远志.绵羊种布鲁氏菌病的分子机制研究[D].石河子:石河子大学,2008.
