秋茄ERF抗逆转录因子的克隆及其功能分析
2013-04-25刘博欣赵杨敏庞俊峰孙占敏尉亚辉吴燕民
刘博欣,赵杨敏,庞俊峰,孙占敏,尉亚辉,吴燕民
(1.中国农业科学院生物技术研究所,北京 100081; 2.西北大学生命科学学院,陕西 西安 710069;3.深圳市农科集团有限公司,广东 深圳 518040; 4.南京理工大学无锡研究院,江苏 无锡 214192)
红树林是热带、亚热带海岸河口地区潮间带木本植物群落,是世界上生产力较高的自然群落之一[1],其重要的生理环境特征是高盐分[2]。盐度的大小对红树植物的生长、水分代谢、光合作用、呼吸作用、离子吸收、酶系活动以及超微结构等都有明显影响[3],生长在该环境下的植株在长期进化过程中,也必然形成了一套独特的适应机制。秋茄(Kandeliaobovata)是我国境内天然分布最广且分布纬度最高的红树植物,为红树科(Rhizophoraceae)秋茄属植物,有“胎生”的生育特性[4]。
转录因子在植物的胁迫应答中起着重要的调控作用[5-6]。乙烯应答因子(Ethylene-Responsive Factors,ERFs)类转录因子是植物特有的一类转录因子[7-9],主要由DNA结合域、核定位信号域(NLS)及转录调控域3个功能区组成,在植物的非生物胁迫应答中具有重要的功能,特别是表现出对盐碱的耐受作用[10]。因此,克隆KcERF基因将为植物基因工程领域增添新的抗逆基因源,在转基因生物新品种的培育方面具有重要意义。
1 试验材料和方法
1.1植物材料 从深圳红树林中采集秋茄枝条,将秋茄嫩枝在200 mmol·L-1的NaCl中浸泡处理5 h,摘取幼嫩叶片后立即进行液氮处理,保存于-80 ℃超低温冰箱。
1.2秋茄总RNA提取和cDNA第一链的合成 用Trizol试剂法提取秋茄总RNA。经Dnase I处理去除基因组DNA后用Promega公司的试剂反转录为cDNA。具体操作步骤如下:1)在RNase-free的0.5 mL离心管中加入3 μL RNA,1 μL Oligo dT,用ddH2O补足至12 μL,将混合液置于70 ℃水浴5 min,迅速放于冰上冷却2 min。2)再加入4 μL 5×Reaction buffer,2 μL dNTP,1 μL RNase inhibitor,42 ℃水浴2 min后加入1 μL M-MLV reverse transcriptase,将离心管置于42 ℃水浴反应50 min,再将反应管置于70 ℃水浴15 min后终止反应。产物保存于-20 ℃冰箱中备用。
1.3KcERF基因的克隆 利用DNAMAN对已报道的AP2亚家族的基因序列进行比较,分析其保守序列并设计简并引物,PCR扩增秋茄ERF片段。
参考Scotto-Lavino等[11]的方法进行3′RACE。以秋茄cDNA作为模板,分别用基因特异引物QEF3-1和QEF3-2与3′RACE反向引物3′-outer和3′-Inner,进行50 μL体系的两轮PCR扩增。PCR产物经2%琼脂糖凝胶电泳检测、回收纯化后连接pMD19-T克隆载体。载体转化大肠杆菌后,挑取阳性单克隆测序。测序由中国农业科学院作物基因资源与遗传改良国家重大工程开放实验室测序部完成。
参考Scotto-Lavino等[12]的方法进行5′RACE。分别用基因特异引物QER5-1和QER5-2与5′RACE正向引物5′-outer和5′-inner,进行50 μL体系的两轮PCR扩增。PCR产物经琼脂糖凝胶电泳检测、回收纯化后连接pMD19-T克隆载体。载体转化大肠杆菌后,挑取阳性单克隆测序。
将3′RACE和5′RACE扩增结果用DNAMAN拼接初步得出全序列,依照拼接结果设计全序列上、下游引物。以cDNA为模板,经PCR扩增得到基因,得到1 200 bp左右产物条带。测序结果为1 209 bp,将其命名为KcERF。
利用DNAMAN 软件进行序列比对和分析;利用在线ORF finder软件(http://www.ncbi.nlm.nih.gov/gorf/orfig.cg)分析KcERF基因的开放阅读框;利用在线SMART软件(http://smart.embl-heidelberg.de/)分析CDS区典型转录因子结构域;利用在线ExPASy Compute pI/Mw tool软件(http://www.expasy.ch/tools/pitool.html)和FeatureMap3D软件对KcERF蛋白进行物理性质、三维空间结构的预测;利用NCBI-BLAST 及DNAMAN软件进行进化树分析。
1.4KcERF的亚细胞定位 用引物GFPHK-F和GFPHK-R从连接有KcERF cDNA全长的pMD19-T载体上扩增出完整开放阅读框。扩增产物与带有GFP绿色荧光蛋白报告基因的P163-GFP载体分别经 HindIII+ BamHI双酶切,1%琼脂糖凝胶电泳并回收,用T4-DNA连接酶将KcERF连接在p163-GFP载体的相应酶切位点上,构建与GFP融合的表达载体p163-GFP-KcERF。经过鉴定后,用基因枪法转化洋葱(Aliumcepa)表皮细胞,暗培养24 h后,用激光共聚焦显微镜观察KcERF的亚细胞定位。
1.5KcERF基因转录激活功能验证 用引物对KEZ-F和KEZ-R从pMD19T-KcERF载体上扩增出KcERF完整开放阅读框。扩增产物和pbridge各自经EcoRI+SalI双酶切、1%琼脂糖凝胶电泳并回收,用T4连接酶将目标基因连接至pbridge载体,构建酵母融合效应质粒pbridge-KcERF。转化酵母感受态细胞,进行β-半乳糖苷酶活性滤纸分析及β-半乳糖苷酶活性测定。
1.6过表达KcERF转录因子耐盐功能分析 利用引物KcERF-XbaI-F和KcERF-KpnI-R从连接有全长KcERF cDNA的pMD19-T载体上扩增出完整的开放阅读框。扩增产物和载体pUCST4A进行XbaI、KpnI双酶切,用T4连接酶将KcERF与载体pUCST4A进行连接,构建中间表达载体pUCST4A-KcERF,中间载体与载体pCAMBIA2301经HindIII和EcoRI双酶切,1%琼脂糖凝胶电泳并回收,T4连接酶连接后转化大肠杆菌DH5α,构建植物表达载体pC2301-P35S-KcERF。将表达载体转入农杆菌LBA4404感受态细胞,利用叶盘转化法转化烟草(Nicotianatabacum)。并进行kan抗性筛选、GUS报告基因检测、基因组PCR与RT-PCR检测,选取结果均为阳性的烟草植株进行不同时间的NaCl梯度浓度胁迫[10],测量烟草植株耐盐形态学差异并进行生理生化指标测定。
用移栽生长2周的烟草植株进行 NaCl梯度浓度胁迫,其浓度分别为0、120、240、360 mmmol·L-1,且每个梯度设3个重复,共24株烟草(其中,转KcERF基因烟草12株,野生型烟草12株)。
胁迫处理方式:每隔 3 d,补浇一次NaCl溶液,自然条件下生长90 d,并分别在0、7、14、21 d取样,用液氮处理后,置于-80 ℃保存。
形态学测量方式:在 0、7、14、21 d分别对烟草心叶长半轴、短半轴长及株高进行测量,烟草心叶面积以近似椭圆面积(S)计算:S=0.634 5ab[13],a、b分别是烟叶的长半轴、短半轴的长,0.634 5为烟草叶面积指数。
胁迫处理后植株叶片组织含水量的测定:对不同浓度NaCl胁迫处理的转基因和野生型烟草,分别在 0、7、14、21 d 取叶片,每个处理取3个样本,并迅速测其鲜质量。
丙二醛(MDA)及可溶性糖的测定:取叶片0.5 g,液氮冷冻并用组织破碎仪破碎后,加入1 mL 0.5%TBA,涡旋震荡匀浆后,再将上述匀浆转移入洁净10 mL EP管并编号(对照加1 mL蒸馏水),然后再加入0.5%TBA溶液5 mL,混匀后在水浴中沸煮反应 15 min至反应充分后;迅速放入冰中冷却10 min,吸取上清低速离心;然后用分光光度计分别测450、532和600 nm波长处上清液的吸光度值[14]。
转基因植株叶片组织相对电导率分析:称取经胁迫处理的烟草叶片0.2 g于10 mL EP管中,加入5 mL去离子水,自然浸泡1 h,之后测定电导率J1并记录,然后放入沸水浴中煮沸10 min,冷却至室温测电导率并记录[15]。
2 结果与分析
2.1基因全长的克隆及生物信息学分析 本研究根据GenBank数据库中相关科属植物的AP2/ERF亚家族基因的cDNA序列设计简并引物,以RNA为模板经RT-PCR反应获得大小为270 bp的目的片段。在已知序列的基础上进行3′RACE和5′RACE,然后将3′RACE和5′RACE扩增结果用软件拼接得出全序列。根据序列设计上、下游引物,扩增得到cDNA序列,命名为KcERF。同时用该引物扩增基因组DNA得到DNA序列。
将KcERF转录因子的ORF进行分析,KcERF基因全cDNA序列中存在873 bp的开放阅读框,编码290个氨基酸。SMART软件对KcERF基因编码的蛋白结构域进行分析,显示KcERF转录因子在54-117位含有一个典型的AP2结构域。Inter ProScan分析表明,290个氨基酸序列编码的是AP2/EREBP家族中的ERF类转录因子。ExPASy Compute pI/Mw tool预测蛋白等电点为7.15,分子量为31.45 kDa。利用在线Protscale预测分析结果,KcERF所编码的蛋白质中疏水性最大值是1.667,最小值是-3.011,表明KcERF蛋白主要由亲水性区域组成;且存在76.55%的残基暴露在蛋白表面,23.45%的其余残基置于蛋白内部,也说明亲水性比疏水性强。在NCBI中搜索AP2/ERF家族已克隆基因mRNA序列,用DNAMAN软件进行基因序列比对并构建系统进化树。系统进化树分析表明秋茄ERF基因与拟南芥(Arabidopsisthaliana)等作物聚类在一起,系统进化亲缘关系在81%左右(图1)。利用FeatureMap3D软件对秋茄ERF蛋白进行结构预测,基因KcERF所编码的蛋白空间结构中分别具有1个α螺旋和3个β折叠,这是典型的ERF类转录因子所具有的空间结构。

图1 KcERF转录因子系统进化树分析Fig.1 Phylogenetic tree analysis of KcERF
2.2KcERF的亚细胞定位 在激光扫描共聚焦显微镜下观察KcERF基因在洋葱表皮细胞中的瞬时表达,结果(图2)显示,在转化p163-GFP-KcERF重组质粒的洋葱表皮细胞中,绿色荧光仅出现在细胞核内;而在转化空载体p163-GFP的洋葱表皮细胞对照中,绿色荧光弥散整个细胞;故KcERF转录因子为核定位蛋白。
2.3KcERF基因转录激活功能验证 为了分析KcERF是否具有转录激活的能力,把KcERF基因完整的开放阅读框连接于pbridge载体上,构建酵母效应质粒pbridge-KcERF,转化DH-5α,筛选阳性克隆。氯化锂法转化效应质粒pbridge-KcERF于酵母菌株AH109。在SD-His-Trp平板上,仅含有效应质粒pbridge-KcERF的酵母菌株才能正常生长(图3),说明效应质粒已成功转入。用灭菌的whatman滤纸,进行β-半乳糖苷酶活性的滤纸检测,其结果效应质粒pbridge-KcERF均呈现出蓝色,pbridge无颜色反应(图4)。β-半乳糖苷酶活性检测结果为185.03 U(表1),与阳性对照GAL4的36.26 U相比,表明KcERF的转录激活活性较强。

图2 KcERF-GFP 与 GFP 蛋白的亚细胞定位Fig.2 The subcellular localization of KcERF-GFP and GFP

图3 含有重组质粒的酵母菌株在SD-Trp和SD-His-Trp平板上的生长情况Fig.3 The growth of yeast containing recombinant plasmids on SD-Trp and SD-His-Trp
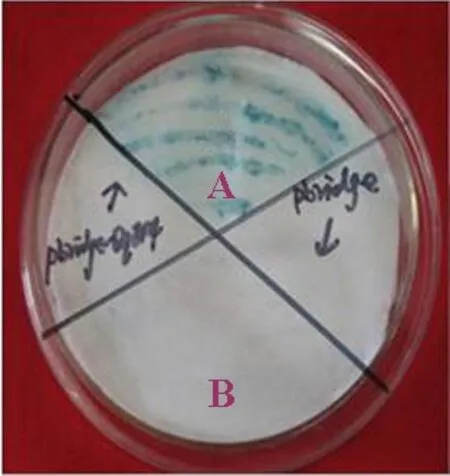
图4 KcERF蛋白在酵母系统中的转录激活功能分析Fig.4 Transcriptional activation assay of KcERF protein in yeast system
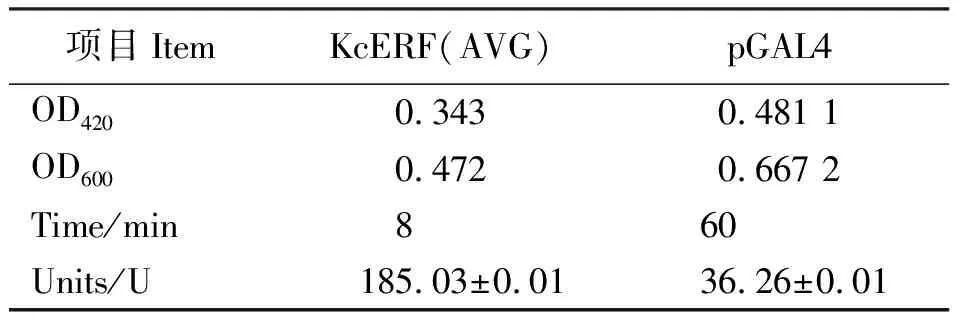
表 1 KcERF的β-半乳糖苷酶活性检测结果 Table 1 The β-galactosidase activity detection results of KcERF
2.4转KcERF基因烟草的形态学分析 比较盐胁迫下转KcERF基因和野生型烟草株高的变化可以看出,在胁迫21 d时对野生型烟草株高的胁迫效应显著,而对转基因烟草的影响不明显(图5)。
另外,从盐胁迫对转基因型和野生型烟草叶片的影响可以看出,NaCl对野生型烟草的叶片的影响从胁迫7 d开始有明显变化,而对转KcERF基因烟草的影响不明显(图6)。

图5 盐胁迫对烟草株高的影响 Fig.5 Effects of salt stress on plant height of transgenic and wild tobacco plants
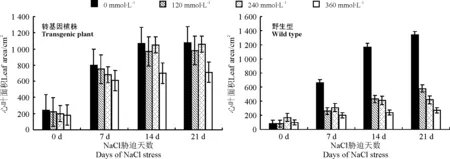
图6 盐胁迫对烟草心叶面积的影响 Fig.6 Effects of salt stress on leaf area of transgenic and wild tobacco plants
2.5转KcERF基因烟草的耐盐功能分析 植物组织含水量是植物组织内水分情况的一个生理指标。据研究发现,高盐使植物遭受渗透胁迫,细胞失水,严重可致死[16]。根据不同浓度盐胁迫下烟草叶片含水量变化趋势可以看出(图7),在高浓度的NaCl处理下,转KcERF基因的烟草含水量变化不明显,而野生型呈下降趋势,较KcERF型烟草下降约20%,结果显著。证明KcERF基因可减缓高盐对植物产生的离子毒害、渗透胁迫及生理干旱。
逆境胁迫植物时,植物发生膜脂过氧化,MDA含量可以反映植物遭受逆境伤害的程度,是膜脂过氧化的一种终产物。本研究比较了转KcERF基因烟草与野生型烟草在不同浓度盐胁迫下烟草MDA含量的差异(图8)。在高浓度的NaCl处理下,转KcERF基因烟草的MDA含量变化趋势小,而野生型表现高增长率,在240 mmol·L-1NaCl胁迫0~14 d,处于动态平衡,MDA含量维持在0.007 μmol·g-1左右,胁迫21 d之后MDA含量显著升高至0.022 μmol·g-1,是胁迫前(0.007 μmol·g-1)的3倍多;在360 mmol·L-1NaCl胁迫下,MDA含量打破了动态平衡,呈现趋于直线增长的趋势,表明植株受到高盐胁迫,膜脂过氧化作用严重,植物体已从抵御状态进入防御阶段(图8)。这表明,插入外源转录因子KcERF,缓解了高盐胁迫对烟草的毒害作用,降低了膜脂过氧化产物MDA的含量,从而保证细胞内脂膜的完整性,提高了转基因烟草在高盐逆境下的抗盐及耐盐性。

图7 盐胁迫下烟草的含水量的变化Fig.7 Variation of water content in tobacco under salt stress
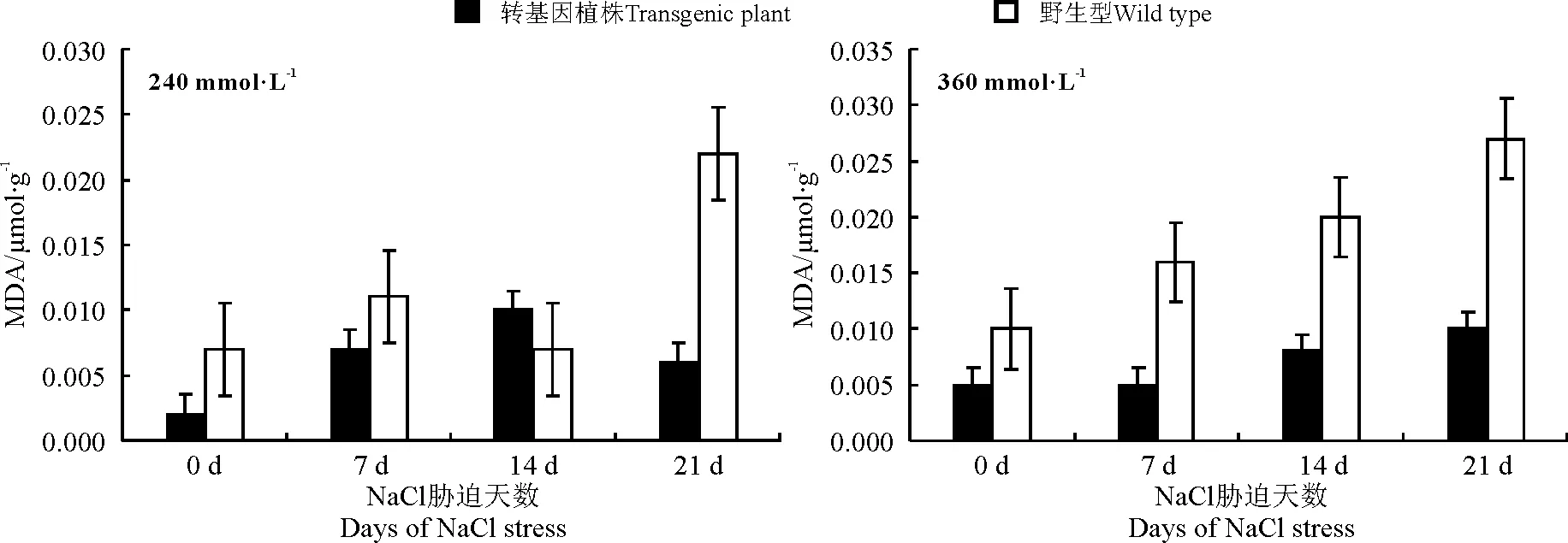
图8 盐胁迫下烟草MDA含量的变化 Fig.8 Variation of MDA content in tobacco under salt stress
可溶性糖是植物在低温、高盐或干旱条件下产生的渗透调节物质,可以维持渗透平衡、保护蛋白质分子、增加蛋白质分子的水合度并维持光合特性,还可作为活性氧的清除剂消除胁迫所造成的伤害[17-19]。在不同浓度盐胁迫下,对于野生型烟草而言,具有一致的可溶性糖含量变化趋势,即先下降后上升(图 9)。可能是由于在盐胁迫初期,其光合作用受到抑制,葡萄糖合成减少,导致可溶性糖含量降低,随着胁迫时间的积累,植物体内对盐胁迫产生了应答机制,植物自身会产生并积累一些小分子有机物来抵抗逆境,可溶性糖就是这些有机物质之一。而转KcERF基因烟草可溶性糖含量呈上升趋势。在240 mmol·L-1NaCl胁迫14 d时表现极显著差异(P=0.006);在360 mmol·L-1NaCl 胁迫14 d时表现显著差异(P=0.021),表明转KcERF基因烟草在盐胁迫下可溶性糖含量高于野生型,有利于缓解植物因高盐逆境所带来的毒害作用,通过细胞内积累的小分子碳水化合物如可溶性糖,利用渗透调节来维持较高的渗透压,从而维持细胞的正常生理代谢。
正常情况下,细胞膜对物质具有选择通透性;但逆境条件下,如干旱、低温、高盐及病害等,使质膜的结构和功能受到不同程度的伤害,从而引起质膜通透性变大,细胞内电解质外渗,以致植物细胞组织浸提液的电导率增大。因此,相对电导率可以反映植物细胞膜在各种逆境条件下透性变化和细胞膜受损伤的程度。一般认为耐盐能力强的植物在盐胁迫下,细胞膜透性变化较小,敏感植物则变化大[20]。本研究表明,野生型烟草在NaCl的胁迫下电导率处于持续增长状态;而转基因型烟草表现出先下降后上升的趋势(图10)。说明在盐胁迫条件下,野生型植物的细胞膜因高浓度盐的影响,受到不同程度的损伤,而插入KcERF转录因子的转基因植株,可以在逆境胁迫初期产生应答机制,缓解高盐对细胞膜的损伤,从而保证植株在高盐逆境中能维持正常生长发育。

图9 盐胁迫下烟草可溶性糖含量的变化 Fig.9 Variation of soluble sugar content in tobacco under salt stress
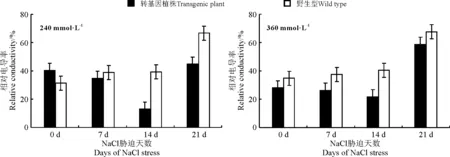
图10 盐胁迫下烟草相对电导率的变化 Fig.10 Variation of relative conductivity in tobacco under salt stress
3 讨论
秋茄对盐碱具有很强的忍耐性。近年来,诸多学者对秋茄的耐盐机制进行了一系列的研究,如根、叶中导致盐离子不易通过的三萜醇含量随着盐浓度的升高而增加,而磷脂和脂肪酸的组成没有变化[21]。在一定盐浓度范围内,随着盐浓度的增加,秋茄细胞中的质膜ATP酶活性、电化学势梯度和跨膜质子梯度增加[22]。秋茄中含量较高的多酚具有很强的自由基清除能力,还可以抑制氧化酶,络合对氧化反应起催化作用的金属离子Fe3+和Cu2+[23]。在秋茄的总渗透调节中,无机渗透调节占87.8%,最重要的是Na+和Cl-;有机渗透调节占12.2%,其中可溶性糖占主要地位[24]。
本研究从秋茄中克隆了ERF转录因子的一个基因KcERF,属于AP2/EREBP家族中的ERF类转录因子[25]。系统进化树分析其与拟南芥亲缘关系最高,在81%左右。KcERF融合表达的GFP在细胞中的亚细胞定位情况显示:KcERF定位于细胞核,据此认为KcERF是在细胞核中调控基因表达的。根据研究表明,乙烯信号转导途径中,ERF蛋白直接与ERF 上游的PERE(Previously Identified Ethylene-Response Element)组件结合,从而启动下游基因的表达[5]。因此看出,KcERF类转录因子在细胞核内发生作用,与亚细胞定位结果相符。酵母单杂交试验表明,KcERF基因具有转录激活活性,且β-半乳糖苷酶活性为185.03 U,与阳性对照GAL4的36.26相比,KcERF具有强的转录激活活性。
秋茄作为红树林的代表植物,对盐碱有良好的抗性作用[26]。为了研究KcERF转录因子对植物发挥的作用,构建了含有KcERF转录因子的转基因烟草,并与野生型烟草进行了不同浓度、不同时间的NaCl处理。对转KcERF基因的烟草植株的株高与叶片面积进行测量得出,从生物形态学上,转KcERF基因的植株对NaCl表现出显著的抗性。从生理指标上进一步分析其原因发现,含水量、MDA含量、可溶性糖含量、相对电导率均反映出转KcERF基因的烟草受到高盐逆境胁迫时,基本保持正常生长状态,而野生型烟草受到不同程度的损伤。值得一提的是,在可溶性糖含量的测定中,野生型烟草表现出先下降后上升趋势,理论推测可能是由于盐胁迫初期,光合作用受到抑制,葡萄糖合成减少,导致可溶性糖含量降低,而随着盐胁迫的积累,植物体内对胁迫产生主动的应答,植物自身释放一些小分子有机物来抵抗逆境,可溶性糖就是其中之一;转KcERF基因的植株在可溶性糖含量方面表现出持续的增长状态,说明从受到胁迫开始,转基因植株就释放可溶性糖来抵御逆境,比野生型在抗盐逆境抵御方面表现出明显的优越性。
综上所述,从秋茄中克隆出的KcERF转录因子在细胞核中发挥作用,有较强的转录激活活性并可以显著提高植株的耐盐性,有维持植株正常的生理生化功能的作用。同时,我们已将KcERF基因转到豆科牧草百脉根(Lotuscorniculatus)和棉花(Gossypiumspp.)中,以观察其大田作业下的耐盐能力。通过试验,希望能培育耐盐牧草和棉花新品种,在我国大量的盐碱地中加以利用。
[1] Larcher W.Physiological Plant Ecology[M].Berlin:Springer-Verlag,1975:150-157.
[2] 庞俊峰,于卓,张占路,等.木榄CaM基因的克隆及序列分析[J].生物技术通报,2010(12):126-131.
[3] 郑文教,林鹏,郑逢中.秋茄幼苗的抗盐特性[J].厦门大学学报(自然科学版),1993,32(4):489-493.
[4] 卢昌义,林鹤.秋茄红树林的造林技术及其生态学原理[J].厦门大学学报(自然科学版),1990,29(6):694-698.
[5] Guo H W,Ecker J R.The ethylene signaling pathway:New insights[J].Current Opinion In Plant Biology,2004,7:40-49.
[6] Yamaguchi-Shinozaki K,Shinozaki K.Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J].Annual Review Plant Biology,2006,57:781-803.
[7] 卢丞文,潘晓琪,朱本忠.ERFs转录因子及其在植物胁迫应答中的作用[J].生物技术通报,2012(3):22-27.
[8] Okamuro J K,Caster B,Villarroel R,etal.The AP2 domain of APETALA2 defines a large new family of DNA binding proteins inArabidopsis[J].Proceedings of the National Academy of Sciences USA,1997,94:7076-7081.
[9] Allen M D,Yamasaki K,Ohme-Takagi M,etal.A novel mode of DNA recognition by a β-sheet revealed by the solution structure of the GCC-box binding domain in complex with DNA[J].EMBO Journal,1998,17:5484-5496.
[10] 赵杨敏,庞俊峰,张占路,等.木榄ERF转录因子基因的克隆及功能分析初探[J].中国农业科技导报,2012,14(4):66-72.
[11] Scotto-Lavino E,Du G W,Frohman M A.3′End cDNA amplification using classic RACE[J].Nature Protocols,2006,1:2742-2745.
[12] Scotto-Lavino E,Du G W,Frohman M A.5′End cDNA amplification using classic RACE[J].Nature Protocols,2006,1:2555-2562.
[13] 刘贯山.烟草叶面积不同测定方法的比较研究[J].安徽农业科学,1996,24(2):139-141.
[14] 王关林,方宏筠.植物基因工程[M].第二版.北京:科学出版社,2002:776-777.
[15] 王文斌.植物活性氧代谢及其利用[M].北京:中国农业科学技术出版社,2011
[16] 张晓磊,聂玉哲,李玉花,等.盐胁迫下植物的细胞信号转导[J].生物技术通讯,2008,19(3):468-471.
[17] Liu J,Zhu J K.Proline accumulation and salt-stressinduced gene expression in a salt-hypersensitive mutant ofArabidopsis[J].Plant Physiology,1997,114:591-596.
[18] Gupta A K,Kaur N.Sugar signaling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants[J].Bioscience Journal,2005,30:761-776.
[19] Székely G,brahám E,Cséplõ,etal.Duplicated P5CS genes ofArabidopsisplay distinct roles in stress regulation and developmental control of proline biosynthesis[J].Plant Journal,2005,53:11-28.
[20] Mckay H M,Mason W L.Physiologically indicators of tolerance to cold storage in Sitka spruce and Douglas-fir seedings[J].Canadian Journal Forest Research,1991,21:890-901.
[21] Oku H,Baba S,Koga H,etal.Lipid composition of mangrove and its relevance to salt tolerance[J].Journal of Plant Reserch,2003,116(1):37-45.
[22] Zhao Z Q,Zheng H L,Zhu Y G.Changes of plasma membrane AT2 Pase activity,membrane potential and transmembrane proton gradient inKandeliacandelandAvicenniamarinaseedlings with various salinities[J].Journal of Environmental Sciences,2004,16(5):742-745.
[23] Hsu F L,Nonaka G I,Nishioka I.Tannins and related compounds.XXXI.Isolation and characterization of proanthocyanidins inKandeliacandel(L.) Druce[J].Chemical & Pharmaceutical Bulletin,1985,33:3142-3152.
[24] Zhao K F,Feng L T,Lu Y F,etal.The osmotica and their contributions to the osmotic adjustment forKandeliacandel(L.) druce andAvicenniamarina(Forsk) vierh growing in the Jiulongjiang river estuary[J].Oceanologia Et Limnologia Sinica,1999,30:58-61.
[25] Sakuma Y,Maruyama K,Qin F,etal.Dual function of anArabidopsistranscription factor DREB2A in waterstress-responsive and heat-stress-responsive gene expression[J].Proceedings of the National Academy of Sciences USA,2006,103:18822-18827.
[26] 黄薇,林栖凤,李冠一,等.盐分对红树植物秋茄某些生理特性的影响[J].海南大学学报(自然科学版),2002,20(4):328-331.
