草食动物影响植物种子萌发的整合分析
2013-04-25万娟娟杨洁晶任爱天马春晖于磊鲁为华
万娟娟,杨洁晶,任爱天,马春晖,于磊,鲁为华
(石河子大学动物科技学院,新疆 石河子 832003)
自Janzen[1]提出了著名的“双F假说”以来,非肉质果类植物种子被动物消化道传播得到了众多学者的认同并在此基础上进行了大量的研究工作[2-6]。目前,关于草食动物对非肉质果类植物种子消化道传播方面的研究内容主要包括以下5个方面:1)草食动物的消化道传播对植物种子二次分配以及种群时空分布状态的影响[7-8];2)植物种子形态特征与消化道传播之间的关系,包括种子大小[3,9-13]、种子形状[12,14-16]、种子的种皮特征[13]以及种子寿命长短[17]与消化道传播之间的关系;3)不同消化道类型的草食动物对植物种子消化道传播的差异[13,16,18-19];4)不同动物粪便状态对传播后种子萌发行为的影响[20-21];5)草食动物的消化道传播对退化植物种群恢复的作用[22-24]。而上述有关草食动物对植物种子消化道传播的研究要达到的最终目的是要明确基于种子消化道传播的植物群体生活史特征对草食动物采食是否具有进化适应意义。但就目前的研究结果来看,草食动物和植物之间是否存在协同进化仍然存在激烈的争论,造成争论的原因主要有两方面,一方面,不同区域草地生态系统构成千差万别,植物种子和动物种类多种多样。另一方面,草地生态系统内动植物之间网络式的分布关系使种子的消化道传播过程更为复杂。因此,这就要求人们在尽可能增加植物和动物种类研究的基础上,对区域性草地生态系统内草食动物对种子的消化道传播进行详细研究而得出一个确定性结论,然后再通过一定的分析方法将已有的各类草地生态系统的研究结果进行整合分析,才能使关于植物种子与草食动物消化道传播之间协同进化关系的确定性结论的形成成为可能。
尽管种子性状(Seed Traits)在不同科属植物种之间存在差异,但是从植物进化的角度考虑,植物多样性特征是经过漫长的自然选择和适应才形成的,因此,人们才能根据表型特征之间的差异来判断不同物种之间的亲缘关系。在植物分类学中,种子性状也是重要的分类依据,从理论上讲,种子性状在进化水平上会表现出明显的趋同性,进而会对环境选择压力产生趋同适应[25],比如荒漠地区的藜科植物会在种子形状上表现出明显的二(多)型性[26]、豆科植物种子的硬实特征[27]、菊科植物的黏液繁殖体[28]。这种在进化水平上的趋同适应表明,具有亲缘关系的植物群体在一定的同质选择压力作用下会表现出明显一致的适应性对策,进而能够保证物种在同质环境条件下的延续以及多样性特征。
已有的研究表明,草食动物对植物的采食会使植物的表型特征发生变化,例如植物的补偿性生长[29-30]、针对动物采食建立的防御性机制[31]、植株匍匐性造成采食难度增加[32]、附属结构(刺、毛)的出现[33]。而根据Janzen[1]的“双F假说”,草食动物对于植物种子的附带采食对植物尤其对种子性状也会产生选择压力,因此,植物种子性状的形成和草食动物之间是否存在协同进化的关系就自然成为生态学者关注的问题。
元分析技术的出现,为回答种子性状和动物消化道传播之间的关系提供了良好思路,该方法能够整合一系列独立的、但有相似假设的研究结果,然后通过定量分析,对各个研究的相关信息进行综合,得到更普适的结论。因此,本研究收集了近年来有关草食动物对非肉质果消化道传播的研究数据,首先利用PIC(系统发育独立比较)对植物种类进行系统分类,然后通过元分析技术对所有种子经过消化道传播后的萌发率进行整合分析,尝试回答以下两个问题:1)分类系统中亲缘关系较近的植物种对草食动物消化道传播过程是否存在趋同适应;2)不同草食动物的消化系统(盲肠发酵类、结肠发酵类、前肠或反刍发酵类[14])对种子的消化道传播是否存在差异。
1 研究方法
1.1数据收集 本文的数据主要来源于12个研究[5,13-15,34-40],包括16个科62种植物种子(表1),对照组种子直接从植物上采集,处理组种子是饲喂后经消化道作用后从动物粪便中收集。对照组和处理组的种子要来自于同一区域植物种群,同时需要收集试验中种子数量及其对照组和处理组种子的萌发率[42]。
1.2数据处理及相关计算方法 首先根据系统发育树明确各种植物之间的亲缘关系,系统发育树的建立主要依据被广泛接受的APGⅡ系统[43]。其中禾本科[44-45]、石竹科[46]、豆科[47]、半日花科[48]、唇形科[49]和菊科[50]植物种之间亲缘关系的划分还需要各科植物种之间亲缘关系的资料。表征亲缘关系的每个分支长度没有按比例绘制[51]。
收集各文献中对照组和处理组种子的萌发率,然后计算每个试验研究中二者的效应值(Odds Ratio),即处理组的种子萌发率与对照组种子萌发率的比值。根据效应值再利用CMA软件包计算出95%的置信区间CIs并将其划分为5个区间,即小于0.01,0.01~0.1、0.1~1、1~10、10~100。效应值在图中用黑色方块表示,若效应值大小位于0.01~1表示对种子萌发率起抑制作用,位于1之后的黑色方块表示对种子萌发率起促进作用。误差线为95%的置信区间。CMA具体操作步骤可参考元分析手册。
各个效应值计算完成后,由CAM软件包可直接生成效应值分布区间图,可明确反映出效应值大小以及落在哪个区间范围,然后再结合各植物种的系统发育树探讨植物亲缘关系和效应值之间的对应关系。
2 结果与分析
2.1不同亲缘关系植物种子对消化道传播的响应 16种植物种子经驴的消化道系统后种子的萌发均受到抑制(图1A)。根据亲缘关系将16种植物划分为4个类群:第1类群(莎草科、灯心草科和禾本科)、第2类群(豆科和半日花科)、第3类群(唇形科、车前科、茜草科、龙胆科和菊科),玄参科的两种婆婆纳在APGⅡ分类系统中没有明确的划分信息,所以单独列为一个类群。第1类群中有5种植物效应值都在0.01~0.1,包括沙生苔草、小灯心草、黄花茅、弱剪股颖和草地早熟禾。第2类群中有4种植物效应值在0.1~1,包括车轴草属的Trifoliumarvense和半日花属的Helianthemumnummularium;效应值小于0.01的包括红花车轴草和白花车轴草。第3类群中有6种植物效应值在0.01~0.1,包括夏枯草和长叶车前;效应值小于0.01的包括宽叶百里香、蓬子菜、百金花属的Centauriumerythraea和还阳参。
18种植物种子经马的消化道系统后种子的萌发率呈下降趋势(图1B)。根据亲缘关系将17种植物种同样划分为3个类群,第1类群中有5种植物效应值在0.01~0.1,包括弱剪股颖、沙生苔草、小灯心草、黄花茅和草地早熟禾,仅有弱剪股颖的效应值小于0.01;第2类群中有5种植物效应值在0.1~1,包括车轴草属的Trifoliumarvense、草原车轴草和半日花属的Helianthemumnummularium;效应值小于0.01的包括红花车轴草和白花车轴草。第3类群中有7种植物的效应值在0.01~0.1,包括夏枯草、长叶车前和蓬子菜。效应值小于0.01的包括宽叶百里香、拉拉藤属的Galiummollugo、百金花属的Centauriumerythraea和还阳参。

表1 本文涉及到的植物种类及数据来源Table 1 The plant species and data sources included in the experiment

续表1
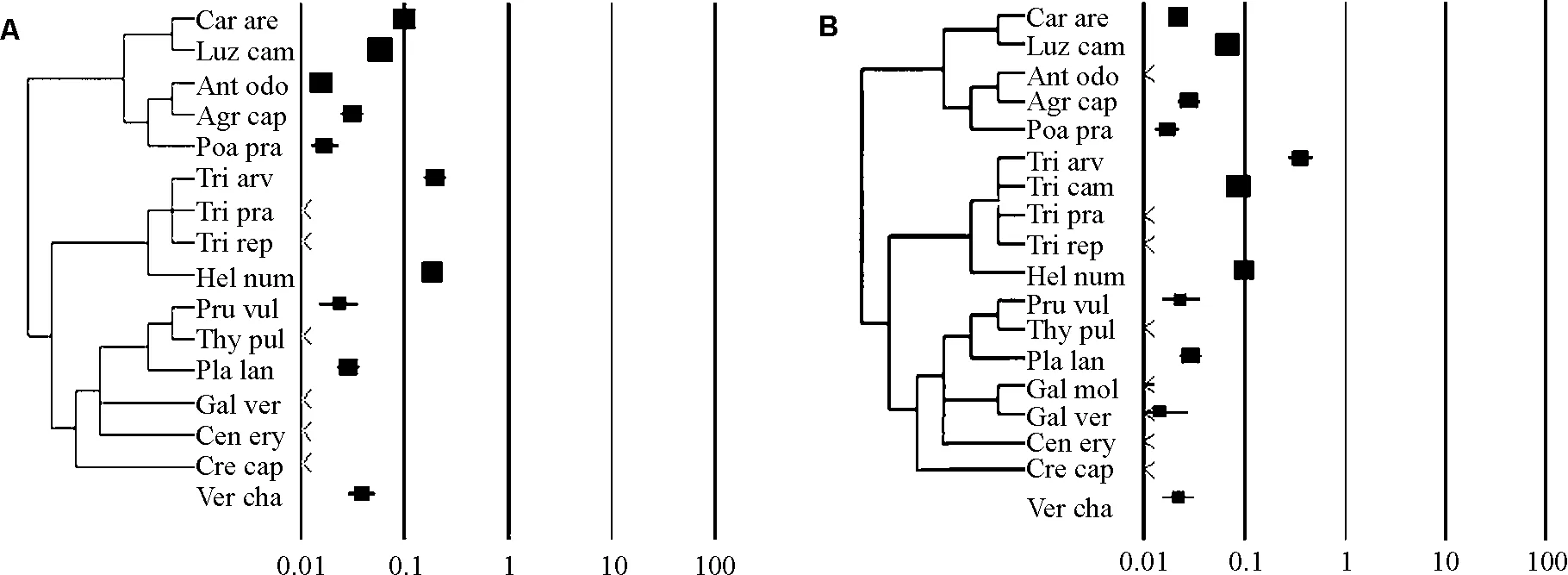
图1 不同植物种子经过驴(A)和马(B)消化道传播之后的萌发率效应值Fig.1 Odds ratio of seed passage through the digestive system of donkey(A)and equidae(B)
图2(A)是不同植物种子经过牛消化道作用后对种子萌发率的影响。根据亲缘关系将21种植物划分为4个类群,第1类群(禾本科)、第2类群(豆科、锦葵科和十字花科)、第3类群(唇形科、车前科、茜草科、龙胆科和菊科),玄参科的两种婆婆纳在APGⅡ分类系统中没有明确的划分信息,所以单独列为1个类群。第1类群中有6种植物效应值在0.01~0.1,包括弱剪股颖和黄花茅;在0.1~1的分别是偏生早熟禾、披碱草属的Elymuselymoides以及黍属的柳枝稷;只有草地早熟禾的效应值小于0.01。第2类群中雨豆树和宽叶独行菜种子的效应值在10~100;经过消化道作用后种子萌发率显著增加,球葵属的Sphaeralceagrossulariaefolia在0.01~0.1;红车轴草和白车轴草的效应值小于0.01。第3类群中仅有长叶车前的效应值在0.01~0.1;其余植物种都小于0.01。第4类群中的两种婆婆纳萌发率也同样受到抑制,其效应值在0.01~0.1。
18种植物经兔子的消化道系统后种子萌发率呈下降趋势(图2B)。根据亲缘关系将这18个植物种划分为3个类群:第1类群(莎草科、灯心草科和禾本科)、第2类群(豆科和半日花科)、第3类群(唇形科、车前科、茜草科、龙胆科和菊科)。第1类群中有5种植物效应值在0.01~0.1,包括沙生苔草、小灯心草、黄花茅、弱剪股颖和草地早熟禾。第2类群中有5种植物效应值在0.1~1,包括车轴草属的Trifoliumarvense、草原车轴草和半日花属的Helianthemumnummularium,效应值小于0.01的包括红花车轴草和白花车轴草。第3类群中有6种植物效应值在0.01~0.1,包括夏枯草、长叶车前和蓬子菜;效应值都小于0.01的包括宽叶百里香、百金花属的Centauriumerythraea、还阳参。

图2 不同植物种子经过牛(A)和兔(B)消化道传播之后的萌发率效应值Fig.2 Odds ratio of seed passage through the digestive system of cattle(A)and rabbit(B)
图3表示不同植物种子通过羊的消化道系统后对种子萌发率的影响。根据亲缘关系将48种植物划分为4个类群:第1类群(莎草科、灯心草科和禾本科)、第2类群(蓼科和石竹科)、第3类群(豆科、半日花科、十字花科和桃金娘科)、第4类群(唇形科、车前科、茜草科、龙胆科、桔梗科和菊科)。第1类群中有7种植物,仅有小灯心草的效应值在1~10;黑麦草效应值在0.1~1;效应值小于0.01的包括沙生苔草、地杨梅、弱剪股颖、黄花茅和草地早熟禾。第2类群中有4种植物效应值在0.01~0.1,包括蝇子草和拟漆姑属的Spergulariapurpurea,仅有膜萼花属的Petrorhagiananteuilii效应值小于0.01;第3类群中有22种植物效应值在0.01~1,包括车轴草属的Trifoliumarvense、草原车轴草、地三叶、半日花属的Helianthemumnummularium和桃金娘;效应值在1~100的包括金雀儿、半日花科7种;其余4种植物的效应值均小于0.01,包括红花车轴草、白花车轴草、庭芥属的Alyssumgranatense、芸薹属的Brassicabarrelieri。第4类群中有15种植物效应值在0.01~1,包括芹叶车前草、长叶车前、风铃草属的Campanularapunculus、果香菊属的Chamaemelummixtum和三齿蒿;效应值均小于0.01的包括宽叶百里香、夏枯草、熏衣草属的两个种、拉拉藤属的Galiummollugo、蓬子菜、百金花属的Centauriumerythraea、桔梗科的Jasionemontana、絮菊属的Filagolutescens和还阳参。

图3 不同植物种子经过羊消化道传播之后的萌发率效应值Fig.3 Odds ratio of seed passage through the digestive system of sheep
2.2不同草食动物的消化系统对种子萌发率的影响 18种植物种子经盲肠发酵类和结肠发酵类草食动物的消化道系统后种子的萌发率均呈现下降趋势(图4),对于总体而言,结肠发酵类草食动物对种子萌发的抑制作用要高于盲肠发酵类草食动物(表2)。
62种植物种子经反刍发酵类草食动物(主要是羊和牛)的消化道系统后种子萌发的影响既有促进也有抑制,其中种子萌发率增加的有豆科(雨豆树、金雀儿、Adenocarpusdecorticans)、半日花科(Fumanaericoides、Fumanathymifolia、半日花、两个半日花属、Cistusmonspeliensis、Cistuslaurifolius)、灯心草科(小灯心草)和十字花科(宽叶独行菜)(图5)。虽然有些植物种子经反刍发酵类草食动物的消化道系统后,种子萌发率明显增加,但是从总体来看,反刍发酵类草食动物对种子萌发的抑制作用要高于盲肠发酵类和结肠发酵类草食动物(表2)。这主要是由于反刍发酵类草食动物采食植物种子后,经过动物的反刍作用,使种子在瘤胃内经过二次消化,延长了种子在动物体内的保留时间,从而增加了种子的破碎化程度,使得种子的萌发率低于其它两种类型的草食动物。
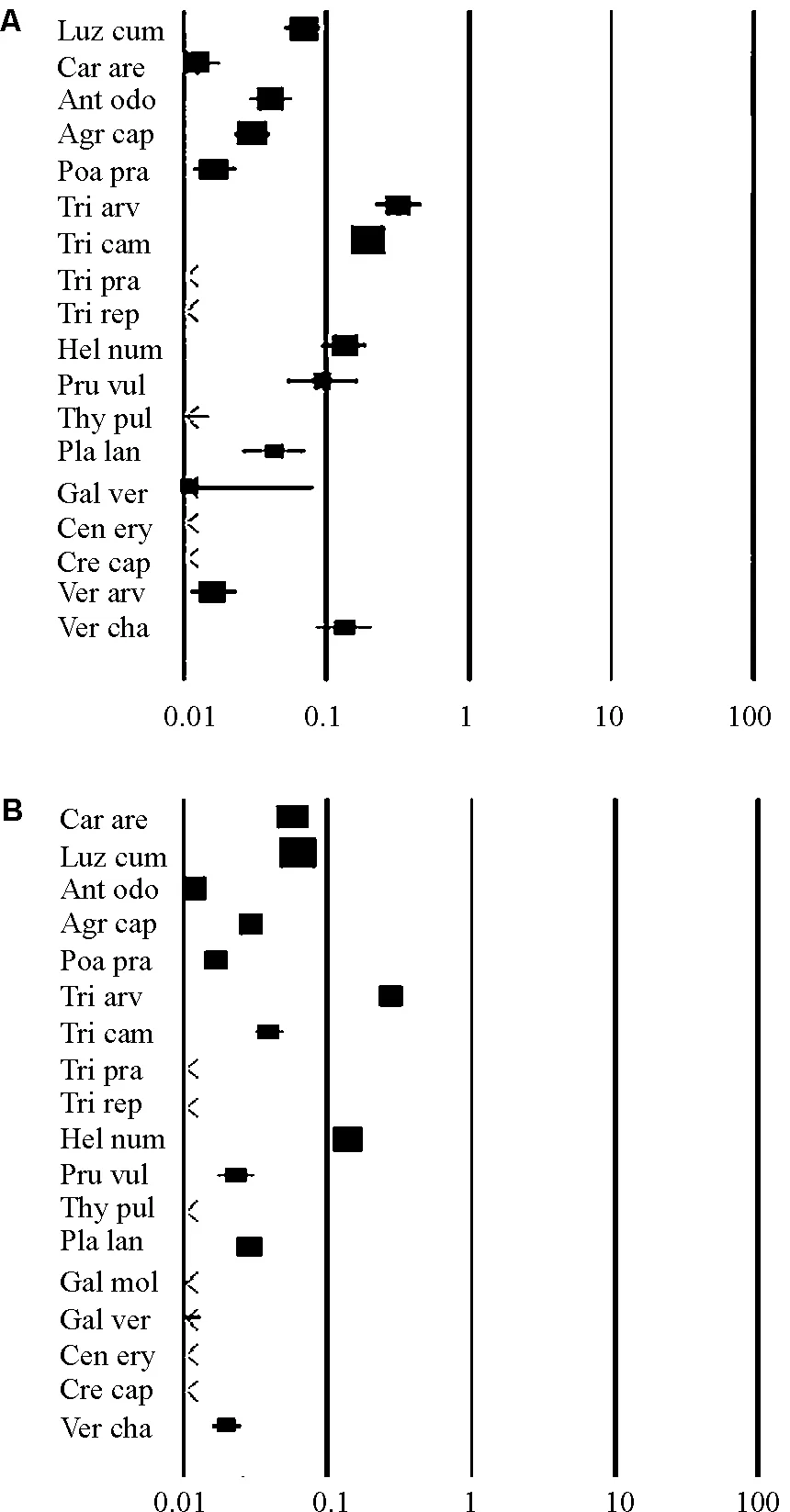
图4 种子经过盲肠发酵类草食动物(A)和结肠发酵类(B)消化道传播之后效应值Fig.4 Odds ratio of seed passage through the digestive system of caecum fermenters(A) and colon fermenters(B)

图5 不同植物种子经过反刍发酵类草食动物消化道传播之后的萌发率效应值Fig.5 Odds ratio of seed passage through the digestive system of ruminants
3 讨论与结论
元分析这种方法的思想起源于20世纪30年代,60年代用于教育、心理等社会科学领域,1976年Glass[52]首先用合并统计量对文献进行综合分析研究并将这类方法命名为Meta-Analysis,80年代末该方法被引入我国,但大部分都应用于医学、心理学等科学领域,而在草食动物对种子消化道传播方面的应用较少。2002年,Traveset和Verdú[42]运用元分析对213种植物种子经动物消化道后种子萌发率的变化进行了分析,发现与Traveset[53]得出的结论相一致,说明该方法在草食动物对种子消化道传播方面的应用具有一定科学性。

表2 不同草食动物的消化道系统对种子萌发率影响的总效应值及95%置信区间Table 2 Total odds ratio and 95% CIs of seed passage through the different digestive system
通过各植物类群对动物消化道传播的反应可以看出,植物类群内种子萌发率效应值的变化势存在一定的趋同现象,但也存在在某一类群中某种植物种子效应值的较大变异情况,造成这种状况可能的原因主要有两个方面:1)由于所收集的有关种子往往来自不同区域,而区域性环境条件的差异,使得种子生物学特性也存在差异,即使在分类学上亲缘关系较近,在环境条件的选择压力作用下其生态适应进化方向也已经与其近缘种产生了分化,因此,被动物采食后其萌发效应值与近缘种之间存在巨大差异。比如处于同一类群中的植物种子在大小上存在差别就有可能使效应值产生巨大的差异,小种子通常在动物消化道中比大种子停留时间更长,因而受摩擦程度越大且时间越长,长时间的摩擦可能破坏种子的内部结构,使得小种子的萌发率比大种子低,与Traveset和Verdú[42]的结论相一致。2)元分析技术需要以大量足够的样本去整合各个研究结果,但就目前来看,尽管有关草食动物对植物种子消化道传播的研究文献数量较多,但很多文献缺乏种子在消化前后萌发行为的详细数据,使得本研究在数据收集上相对困难,因此无法进行有效整合,样本数量有限造成分析结果不能完全代表数据应有的整体趋势。
通过对不同消化道类型对植物种子的萌发率影响分析结果表明,除了某些豆科和半日花科植物外,各类草食动物的消化系统对大部分植物种子萌发均有抑制作用且表现为反刍发酵类草食动物>结肠发酵类草食动物>盲肠发酵类草食动物。这主要取决于种子在草食动物消化道内的滞留时间。对于盲肠发酵类草食动物而言,一般体型偏小,种子在体内的停留时间较短,消化作用相对较弱,对种子萌发的抑制作用较弱。而结肠发酵类草食动物体型较大,种子通过肠道的时间长,对种皮的损伤较大,对种子萌发的抑制作用较强。反刍发酵类草食动物,种子通过肠道的时间长同时要经过瘤胃的二次消化,对种子的损伤大,增加了种子的破碎化程度,从而对种子萌发的抑制作用最强。除此之外,不同草食动物所取食食物的化学成分不同(酸度、含水量、次生物等),在反刍动物瘤胃环境中,pH值、瘤胃微生物与其他动物有所区别,这对种子也会产生剧烈的破坏作用,因此,也会使种子活力受到强烈的抑制作用,从而影响种子萌发。
通过对近年来有关草食动物对非肉质果消化道传播研究的分析,可以得出以下结论:1)元分析是一种有效的分析方法,在今后草食动物对植物种子消化道传播方面的研究中将起到重要作用;2)通过系统分类和消化前后种子的萌发效应值相结合的分析结果来看,处于同一类群的植物在对动物消化道传播的反应上存在一定的趋同现象,但需要大量的萌发行为数据使结论更为可靠。同时,由于区域性的环境差异,分类学上同类群的植物种子在进化方向上有分化现象使得种子生物学特性和其近缘种产生分异,因此也不能排除某些植物种子的反应与其近缘种存在显著差异;3)除了豆科、半日花科的某些植物种由于种子硬实率较高,消化道传播后萌发率有所提高外,其他植物通过各类动物消化系统后对种子萌发均产生抑制作用且反刍发酵类草食动物>结肠发酵类草食动物>盲肠发酵类草食动物。出现这一现象主要和消化道类型有密切关系。
参考文献:
[1] Janzen D H.Dispersal of small seeds by big herbivores:Foliage is the fruit[J].American Naturalist,1984,123:338-353.
[2] Willson M F.Dispersal mode,seed shadows,and colonization patterns[J].Vegetatio,1993,107-108:261-280.
[3] Pakeman R J,Digneffe G,Small J L.Ecological correlates of endozoochory by herbivores[J].Functional Ecology,2002,16:296-304.
[4] Myers J A,Vellend M,Gardescu S,etal.Seed dispersal by white-tailed deer:Implications for long-distance dispersal,invasion,and migration of plants[J].Oecologia,2004,139:35-44.
[5] Ramos E,Robles B,Jorge C.Effciency of endozoochorous seed dispersal in six dry-fruited species(Cistaceae):From seed ingestion to early seedling establishment[J].Plant Ecology,2006,185:97-106.
[6] D’hondt B,Hoffmann M.A reassessment of the role of simple seed traits in mortality following herbivore ingestion[J].Plant Biology,2010,84:1067-1072.
[7] Bruun H H,Lundgren R,Philipp M.Enhancement of local species richness in tundra by seed dispersal through guts of muskox and barnacle goose[J].Oecologia,2008,155:101-110.
[8] Yoshihara Y,Ohkuro T,Bayarbaatar B,etal.Effects of disturbance by Siberian marmots (Marmotasibirica) on spatial heterogeneity of vegetation at multiple spatial scales[J].Grassland Science,2009,55:89-95.
[9] Russi L,Cocks P S,Roberts E H.The fate of legume seeds eaten by sheep from a Mediterranean grassland[J].Journal of Applied Ecology,1992,29:772-778.
[10] Edward A Y,Ewing M A,Revell C K.Fate of Serradella,Medic,and Biserrula seeds in Pods Ingested by Sheep[C].Wagga Wagga,Australia:Proceedings of the 9th Australian Agronomy Conference,1998.
[11] Gökbulak F.Effect of American bison (BisonbisonL.) on the recovery and germinability of seeds of range forage species[J].Grass Forage Science,2002,57:395-400.
[12] Mouissie A M,Van Derveen E J,(Ciska) Veen G F,etal.Ecological correlates of seed survival after ingestion by fallow deer[J].Functional Ecology,2005,19:284-290.
[13] Manzano P J,Malo E,Peco B.Sheep gut passage and survival of Mediterranean shrub seeds[J].Seed Science Research,2005,15:21-28.
[14] Cosyns E,Delporte A,Lens L,etal.Germination success of temperate grassland species after passage through ungulate and rabbit guts[J].Journal of Ecology,2005,93:353-361.
[15] Gökbulak F.Recovery and germination of grass seeds ingested by cattle[J].The Journal of Biological Sciences,2006,6:23-27.
[16] 鱼小军.牦牛粪维系青藏高原高寒草地健康的作用机制[D].兰州:甘肃农业大学,2010.
[17] Doucette K M,Wittenberg K M,McCaughey W P.Seed recovery and germination of reseeded species fed to cattle[J].Journal of Range Management,2001,54:575-581.
[18] Razanamandranto S,Tigabu M,Neya S,etal.Effects of gut treatment on recovery and germinability of bovine and ovine ingested seeds of four woody species from the Sudanian savanna in West Africa[J].Flora-Morphology,Distribution,Functional Ecology of Plants,2004,199:389-397.
[19] Jolaosho A O,Olanite J A,Onifade O S,etal.Seed in the faeces of ruminant animals grazing native pastures under semi-intensive management in Nigeria[J].Tropical Grasslands,2006,40:79-83.
[20] Gökbulak F,Call C A.Grass seedling recruitment in cattle dung pats[J].Journal of Range Management,2004,57:649-655.
[21] 张学勇,杨允菲,亓娜,等.草食动物对结缕草种子散布及发芽力的影响[J].生态学杂志,2007,26(9):1491-1494.
[22] 达来,敖特根,占布拉.绵羊粪中排出的牧草种子及其发芽研究[J].中国草地,1994(5):23-27.
[23] 达来,敖特根,占布拉.利用绵羊排粪播种牧草的研究[J].中国草地,1994(6):7-11.
[24] Traba J,Levassor C,Peco B.Restoration of species richness in abandoned Mediterranean grasslands:Seeds in cattle Dung[J].Restoration Ecology,2003,11,378-384.
[25] 王葆芳,张景波,杨晓晖,等.梭梭不同种源间种子性状和幼苗生长性状与地理和气候因子的关系[J].植物资源与环境学报,2009,18(1):28-35.
[26] 姚世响,油天钰,徐栋生,等.新疆干旱区植物藜的种子异型性及其萌发机理[J].生态学报,2010,30(11):2909-2918.
[27] 郭学民,徐兴友,孟宪东,等.合欢种子硬实与萌发特性及种皮微形态与结构特征的研究[J].内蒙古农业大学学报,2006,27(3):13-18.
[28] 黄振英,Yitzchak G,胡正海,等.白沙蒿种子萌发特性的研究I.粘液瘦果的结构和功能[J].植物生态学报,2001,25(1):22-28.
[29] 马红彬,谢应忠.不同放牧强度下荒漠草原植物的补偿性生长[J].中国农业科学,2008,41(11):3645-3650.
[30] 薛睿,郑淑霞,白永飞.不同利用方式和载畜率对内蒙古典型草原群落初级生产力和植物补偿性生长的影响[J].生物多样性,2010,18 (3):300-311.
[31] Bailey D W,Gross J E,Laca E A,etal.Mechanisms that result in large herbivore grazing distribution patterns[J].Range Manage,1996,49:386-400.
[32] 王炜,梁存柱,刘钟龄,等.草原群落退化与恢复演替中的植物个体行为分析[J].植物生态学报,2000,24(3):268-274.
[33] Gomez J M,Zamora R.Thorns as induced mechanical defense in a long-lived shrub (Hormathophyllaspinosa,Cruciferae)[J].Ecology,2002,83(4):885-890.
[34] Mancilla-Leytón J M,Fernández-Alés R,Martín Vicente A.Low viability and germinability of commercial pasture seeds ingested by goats[J].Small Ruminant Research ,2012,107:12-15.
[35] Whitacre K,Call A.Recovery and germinability of native seed fed to cattle[J].Western North American Naturalist,2006,66(1):121-128.
[36] Ocumpaugh W R,Archer H,Stuth J W.Switchgrass recruitment from broadcast seedvs.seed fed to cattle[J].Journal of Range Management,1996,49:368-371.
[37] Jolaosho A O,Oduguwa B O,Onifade S O,etal.Effects of ingestion by cattle and immersion in hot water and acid on the germinability of rain tree (Albiziasaman) seeds[J].Tropical Grasslands,2006,40:244-253.
[38] Robles A B,Castro J,González-Miras E,etal.Effects of ruminal incubation and goats’ingestion on seed germination of two legume shrubs:AdenocarpusdecorticansBoiss.andRetamasphaerocarpa(L.) Boiss[J]Options Méditerranéennes,2006,67:111-115.
[39] Mancilla-Leytón J M,Fernández-Alés R,Martín Vicente A.Plant-ungulate interaction:Goat gut passage effect on survival and germination of Mediterranean shrub seeds[J].Journal of Vegetation Science,2011,22:1031-1037.
[40] Carpinelli F,Schauer S,Bobnert W,etal.Effect of ruminal incubation on perennial Pepperweed germination[J].Rangeland Ecology&Management,2005,58:632-636.
[41] Peco B,Lopez-Merino L,Alvir M.Survival and germination of Mediterranean grassland species after simulated sheep ingestion:Ecological correlates with seed traits[J].Acta Oecologica,2006,30:269-275.
[42] Traveset A,Verdú M.A meta-analysis of the effect of gut treatment on seed germination[A].Seed Dispersal and Frugivory:Ecology,Evolution and Conservation[C].Wallingford:CABE,2001:339-350.
[43] The Angiosperm Phylogeny Group.An update of the angiosperm phylogeny group classification for the orders and families of flowering plants:APG II[J].Botanical Journal of the Linnean Society,2003,141:399-436.
[44] Aliscioni S S,Giussani L M,Zuloaga F O,etal.A molecular phylogeny ofPanicum(Poaceae:Paniceae):tests of monophyly and phylogenetic placement within the Panicoideae[J].American Journal of Botany,2003,90(5):796-821.
[45] Quintanar A,Castroviejo S,Catalan P.phylogeny of the tribe Aveneae (Paniceae,Poaceae) inferred from plastid TRNT-F and nuclear ITS sequences[J].American Journal of Botany,2007,94(9):1554-1569.
[46] Fior S,Karis P O,Casazza G,etal.Molecular phylogeny of the Caryophyllaceae(Caryophyllales)inferred from chloroplast MATK and nuclear RDNA ITS sequences[J].American Journal of Botany,2006,93(3):399-411.
[47] Doyle J J,Chappill J A,Bailey D C,etal.Towards a comprehensive phylogeny of Legumes:Evidence from sequences and non-molecular data[A].Herendeen P S,Bruneau A.Advances in Legume[M].Kew:Boyal Botanic Gardens,2000:1-20.
[49] Walker J B,Sytsma K J,Treutlein J,etal.Salvia(Lamiaceae) is not monophyletic:Implications for the systematics,radiation,and ecological specializations ofSalviaand tribe Mentheae[J].American Journal of Botany,2004,91(7):1115-1125.
[50] Goertzen L R,Cannone J J,Gutell R R,etal.ITS secondary structure derived from comparative analysis:Implications for sequence alignment and phylogeny of the Asteraceae[J].Molecular Phylogenetics and Evolution,2003,29(2):216-234.
[51] D’hondt B,Hoffmann M.A reassessment of the role of simple seed traits in mortality following herbivore ingestion[J].Plant Biology,2010,26:1-7.
[52] Glass GV.Primary,secondary and meta-analysis of research[J].Education Research,1976,6(5):3.
[53] Traveset A.Effect of seed passage through vertebrate frugivores’guts on germination:a review[J].Perspectives in Plant Ecology,Evolution and Systematics,1998,1(2):151-190.
