MS-RDA的改进及在白背飞虱的应用研究*
2013-04-24周晓穗陈佳林王方海
周晓穗,陈佳林,张 梅,王方海
(中山大学有害生物控制与资源利用国家重点实验室∥昆虫学研究所, 广东 广州 510275)
甲基化敏感性代表性差异分析方法(MS-RDA)由Ushijima等[1]于1997年建立,即通过将甲基化敏感的限制性内切酶消化处理样品基因组的方法和代表性差异分析方法结合起来,优化检测子与驱赶子比例,从而检测甲基化差异区域片段的一种方法。该方法适用于特异、低丰度基因组DNA甲基化的筛查与鉴定,在疾病发生、机体发育、相关病原株系DNA甲基化差异分析以及新遗传标记的分离等方面显示出较大潜力。在高等动物[2-3]、植物[4]上已大量应用,但在昆虫上尚未发现应用该方法的报道。
DNA甲基化是表观遗传修饰的主要形式,早在果蝇、蚜虫、家蚕、甘蓝夜蛾、粉蚧等昆虫中均已发现基因组中存在DNA甲基化现象[5-6]。在蚂蚁基因组中也已发现存在DNA甲基化这种表观遗传修饰[7],Bonasio 等[8]2012年发表在Current Biology的论文进一步阐明蚂蚁不同种属间在DNA甲基化谱上存在一定的差异。最近Patalano等[9]在Current Opinion in Cell Biology上撰文指出社会性昆虫的多型现象与表观遗传修饰、特别是DNA甲基化相关。这些都说明昆虫中也存在大量甲基化现象,在调控昆虫生长发育和多型性等方面应发挥着一定的调控作用。
白背飞虱Sogatellafurcifera(Horvath)体型小,易迁飞,繁殖力强,是水稻的重要虫害之一。其成虫有长翅型、短翅型两种类型。长翅型为迁飞型,具有远距离迁飞的能力;短翅型属于定居繁殖型,产卵期长且产卵量大。长、短翅型比率发生动态是预测稻飞虱数量的一个重要参数[10-11]。研究稻飞虱性别分化和繁殖机理及翅行分化是近几年的研究热点,将有助于探索新的方法控制该种害虫的危害。
已有研究表明,白背飞虱的翅型分化在发育过程中并未牵涉到基因组的改变,而是涉及到基因表达的可遗传改变,属于典型的表观遗传现象,据此推测,在稻飞虱翅型分化过程中可能存在DNA甲基化修饰现象。我们具体测定了长、短翅型白背飞虱成虫中DNA甲基化情况,发现确实存在DNA甲基化现象。本研究重点对MS-RDA方法进行改进,并用白背飞虱为材料,对雌雄性别和长短翅型个体分别进行了DNA甲基化差异片段筛选,结果成功筛选到与雌雄性别或长短翅型相关联的特异DNA甲基化差异片段,为今后进一步从DNA甲基化的角度探讨性别分化和翅型转换的机理打下良好的基础,同时也为今后在其它昆虫中应用MS-RDA方法提供一定的借鉴和指导。
1 材料和方法
1.1 供试昆虫
稻纵卷叶螟采自广州市华南农业大学水稻试验田内。挑选部分雌雄成虫及长翅型和短翅型成虫为供试昆虫。
1.2 基因组DNA的提取
分别选取白背飞虱长翅型雄成虫、长翅型雌成虫和短翅型雌成虫各10头,分别加入适量的缓冲液后用微型玻璃匀浆器匀浆抽提DNA,具体方法参照TaKaRa公司的基因组DNA提取试剂盒的方法和步骤。
1.3 基因组DNA的酶切
选取每样品基因组DNA 2 μg,加入1.5 μL的甲基化敏感性限制性内切酶 Hpa Ⅱ(TaKaRa公司),混匀后在37 ℃下酶切 20 h,随后在66 ℃的恒温下处理 30 min 使酶灭活,未甲基化的 CCGG 位点被切割成黏性末端, 而甲基化的位点则未被切割。
1.4 接头的配制
共合成了6个单链序列(见表1),分别将这些单链序列DNA配制成浓度为 500 pmol/μL的溶液,将互补的单链序列分别取 100 μL配对混匀后于56 ℃孵育 2 min, 然后以每 2 min递降2 ℃的速度逐步冷却到10 ℃,使其自身退火形成如下3个接头:RHpaⅡ24/11、JHpaⅡ24/11、NHpaⅡ24/11,备用。

表1 MS-RDA方法中所使用的接头序列
1.5 扩增子的制备
将上述酶切产物两端加入RHpaⅡ24/11接头,在T4 DNA连接酶(TaKaRa公司)作用下, 16℃下连接 15 h,采用DNA片段纯化试剂盒(TaKaRa公司)纯化连接产物。取部分连接产物作为模板, 以接头中的RHpaⅡ24为引物,在LATaq酶(TaKaRa公司)作用下进行PCR扩增,使连接有R接头的DNA片段即扩增子得到有效富集。w=1%的琼脂糖凝胶电泳观察扩增子。PCR扩增条件为:95 ℃变性 1 min,72 ℃退火 2 min,28个循环后,72 ℃延伸 10 min。
1.6 消减杂交
将各样品的扩增子在甲基化敏感性限制性内切酶HpaⅡ酶切作用下除去R接头,酶切产物用DNA片段纯化试剂盒纯化。分别将白背飞虱长翅型雄成虫和短翅型雌成虫扩增子去R接头纯化后的产物连上JHpaⅡ24/11接头,作为检测子,采用长翅型雌成虫扩增子去R接头纯化后的产物作为驱赶子进行的杂交称为正交,反之叫做反交。检测子和驱赶子按1∶40的比例混合溶于 4 μL的杂交缓冲液,96 ℃变性 10 min,67 ℃杂交 23 h。杂交反应完成后,用杂交产物为模板,以JHpaⅡ24为引物进行PCR反应。17个循环后加入Mung Bean Nuclease(TaKaRa公司)消化单链核苷酸,消化产物经DNA片段纯化试剂盒纯化后继续PCR反应30个循环,使检测子中靶序列得到大量扩增。w=1%琼脂糖凝胶电泳检测结果。将上述第1轮正交和反交的产物分别用HpaⅡ酶消化除去J接头,经DNA片段纯化试剂盒纯化后换上N接头,随后进行第2轮杂交和扩增,根据具体情况检测子和驱赶子由第一轮的1∶40改为1∶400到1∶10 000之间。
1.7 克隆、测序及相似性分析
将最终得到的消减杂交产物用琼脂糖凝胶回收试剂盒(TaKaRa公司)回收后,与pGEM-T载体(Promega公司)在4 ℃下连接12 h,将连接产物加入JM109感受态细菌(Fermentas公司制备)进行转化复苏后,涂布于含有氨苄青霉素的LB固体培养基上,37 ℃下培养 14 h,挑取阳性克隆,培养扩增后,取部分菌液送TaKaRa公司测序,所测得的序列经BLAST比对进行相似性分析。
2 结果与分析
2.1 MS-RDA方法的改进
MS-RDA方法最早由Ushijima等[1]于1997年建立,该方法主要包括DNA提取、酶切、扩增子制备和消减杂交等几大步骤。我们参照了Ushijima等的方法,进行了适当改进,使其适用于体型很小的昆虫,并用白背飞虱具体进行了实验,取得了与性别或长短翅型相关联的甲基化差异显示DNA片段(详见后2部分的描述),结果比较理想。我们的方法主要在如下4个方面进行了改进(见表2):①样品DNA的提取,原方法采用了比较经典的苯酚一氯仿抽提法,而我们采用了Takara基因组纯化试剂盒,提取时间大为缩短,且获得的基因组DNA纯度较高;②酶切时基因组DNA用量从原方法的20 μg减少到2 μg,这样不但可以减少酶的用量,节约成本,且非常适合体形较小、难以收集大量样本材料的多数昆虫;③扩增子制备时的PCR比原先增加了3个循环,这样解决了起初模板量较低的问题;④消减杂交从原先的3轮降为2轮,若第2轮时,使用1∶400的比例,未能出现清晰条带,而是弥散条带的话,根据具体结果,再改为1∶4 000或更高的比例重新进行,这样就不需要繁琐的第3轮消减杂交过程,使整个方法变得相对简单、更易实施。

表2 MS-RDA方法被改进的4个方面
2.2 白背飞虱长翅型雄成虫和长翅型雌成虫甲基化差异DNA片段
将白背飞虱长翅型雄成虫作为检测子,长翅型雌成虫作为驱赶子,经过2轮的正交反应后得到1条 200 bp左右的清晰的差异性条带。以长翅型雌成虫作为检测子,长翅型雄成虫作为驱赶子,经过两轮的反交后则得到可见的3条清晰明亮的差异性条带,大小分别为250,400,450 bp左右(见图1)。这些甲基化差异性DNA片段经 pGEM-T载体克隆测序后,核苷酸序列分别为207、260、396、462 bp,去掉接头序列后则分别为169、212、347、414 bp(见表3)。后3个序列已被GenBank收录,登录号分别为: JX847621、JX624161、JX472453。经BLAST比对分析后,发现相对分子质量为414的片断序列与白背飞虱28S核糖体RNA基因高度相似,相似度达99%,因此推断该序列就是白背飞虱28S核糖体RNA基因的部分序列。而其余3个序列未发现相似性序列存在,应属于未发现的新基因,其具体功能等方面还有待进一步研究。

图1 两轮消减杂交后的电泳图Fig.1 Two electrophoretogram after the second cycle of competitive hybridizationM:DNA相对分子质量标准;1:雄成虫作为检测子,雌成虫作为驱赶子;2:雌成虫作为检测子,雄成虫作为驱赶子;3:短翅型雌成虫作为检测子,长翅型雌成虫作为驱赶子;4:长翅型雌成虫作为检测子,短翅型雌成虫作为驱赶子

DNA片段大小/bpGenBank登记号序列比对结果169无无相似序列212JX847621无相似序列347JX624161无相似序列414JX472453与白背飞虱28S核糖体RNA基因高度相似
2.3 白背飞虱短翅型雌成虫和长翅型雌成虫甲基化差异DNA片断
将白背飞虱短翅型雌成虫作为检测子,长翅型雌成虫作为驱赶子,经过2轮的正交反应后得到1条相对分子质量略大于500 bp 的差异性条带。以长翅型雌成虫作为检测子,短翅型雌成虫作为驱赶子,经过两轮的反交后则得到1条相对分子质量500 bp 左右的差异性条带(见图1)。分别对这2条差异性条带进行切胶纯化回收,并用pGEM-T载体进行克隆测序,测序后所得其大小分别为512、501到bp,去掉接头序列后则分别为464、453 bp(见表4)。这2个序列均已被GenBank收录,登录号分别为:JX514031、JX472454。经BLAST比对分析后,发现464 bp的片段序列与多种动物的18S核糖体高度相似,如与一种两索属动物Amphimermissp. A-2007的18S核糖体高达99%相似;与索科线虫Mermithidae sp. TB-2009 的18S核糖体相似度达97%;与食蚊罗索线虫Romanomermisculicivorax的18S核糖体相似度也达到了88%(图2)。另一片段序列则与白背飞虱28S核糖体RNA基因部分序列高度相似,相似度达99%,因此该序列应是白背飞虱28S核糖体RNA基因的部分序列。

表4 白背飞虱长、短翅型间的2个甲基化差异DNA片段Table 4 Two differentially methylated DNA sequences from long wing and brachypterism of Sogatella furcifera
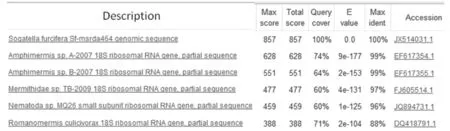
图2 长度464 bp的序列经BLAST比对进行相似性分析的部分截图Fig.2 The partial screenshot of similarity analysis of the 464 bp sequence by BLAST
3 讨 论
MS-RDA是用来检测某些生物样品间的甲基化差异区域片段的一种方法,特别适用于特异、低丰度基因组DNA甲基化的筛查与鉴定,在哺乳动物和植物研究领域已得到广泛应用。DNA甲基化是表观遗传修饰的主要形式,在哺乳动物和植物上已有大量研究和报道[2-4],然而,在昆虫中关于甲基化的研究较晚,报道相对较少,主要集中于这几年[6],目前在昆虫上尚未发现应用MS-RDA方法的报道。为将MS-RDA方法应用于体型较小的昆虫,本研究对该方法进行了如下改进:采用试剂盒提取样品DNA、降低被酶切时基因组DNA用量、增加扩增子制备时的PCR循环数、将消减杂交降为2轮(具体见前面描述)。利用改进后的方法,在白背飞虱中进行了具体实验,成功获得了与性别或长短翅型相关联的清晰的甲基化差异显示DNA片段,这为将来在其它昆虫有关甲基化研究中应用该方法提供了一定借鉴和指导价值。
本研究成功获得4条与白背飞虱雌雄性别相关联的甲基化差异显示片段,其中有3个序列未发现同源性序列,属于新基因,它们的具体功能还有待进一步研究。这为今后从DNA甲基化的角度研究白背飞虱的性别分化打下了良好的开端。
同时我们还获得了与白背飞虱长短翅型相关联的2个基因条带,1条与多种动物的18S核糖体高度相似,另一条与白背飞虱28S核糖体RNA基因序列同源,据此推测,白背飞虱的翅型分化可能与核糖体基因的某些位点的甲基化有关。
参考文献:
[1] USHIJIMA T, MORIMURA K, HOSOYA Y, et al. Establishment of methylation-sensitive-representational difference analysis and isolation of hypo-and hypermethylated genomic fragments in mouse liver tumors [J]. Proc Natl Acad Sci USA, 1997, 94: 2284-2289.
[2] SCHILLING E, REHLI M. Global, comparative analysis of tissue-specific promoter CpG methylation [J]. Genomics, 2007, 90: 314-323.
[3] ZHANG W, JI W, YANG L, et al. Comparison of global DNA methylation proles in replicative versus premature senescence [J]. Life Sciences, 2008, 83: 475-480.
[4] WANG H, FENG Q, ZHANG M, et al. Alteration of DNA methylation level and pattern in sorghum (SorghumbicolorL.) pure-lines and inter-line F1 hybrids following low-dose laser irradiation [J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 99: 150-153.
[5] XIANG H, ZHU J, CHEN Q, DAI F, et al. Single base-resolution methylome of the silkworm reveals a sparse epigenomic map [J]. Nature Biotechnology, 2010, 28: 516-520.
[6] DREWELL R A, LO N, OXLEY P R, et al. Kin conict in insect societies: a new epigenetic perspective [J]. Trends in Ecology and Evolution, 2012, 27(7): 367-373.
[7] BONASIO R, ZHANG G, YE C, et al. Genomic Comparison of the AntsCamponotusfloridanusandHarpegnathossaltator[J]. Science, 2010, 329: 1068-1071.
[8] BONASIO R, LI Q, LIAN J, et al. Genome-wide and Caste-Specic DNA Methylomes of the AntsCamponotusoridanusandHarpegnathossaltator[J]. Current Biology, 2012, 22:1-10.
[9] PATALANO S, HORE T A, REIK W. Shifting behaviour: epigenetic reprogramming in eusocial insects [J]. Current Opinion in Cell Biology, 2012, 24: 367-373.
[10] 张琼秀, 孙梓暄, 李广宏, 等. 外源激素对褐飞虱翅型分化的影响 [J]. 中山大学学报:自然科学版, 2007, 46(3): 76-78.
[11] 张琼秀, 孙梓暄, 李广宏, 等.三种外源激素对白背飞虱翅型分化的影响 [J]. 生态学报, 2008, 28(12): 5994-5998.
