谷物中伏马菌素B1残留的直接竞争ELISA检测方法研究
2013-04-23介明沙张卫民玉崧成吴拥军张洪权
介明沙,张卫民,于 斐,玉崧成,吴拥军*,张洪权
(1.郑州大学 公共卫生学院,河南 郑州 450001;2.郑州大学 化学与分子工程学院,河南 郑州 450001;3.河南天方药业有限公司,河南 驻马店 463002)
0 引言
伏马菌素(Fumonisins)是一类主要由串珠镰刀菌产生的真菌毒素[1],主要存在于玉米、小麦等谷物及其制品中.FB1是伏马菌素的主要组分,是导致Fumonisins 产生毒性的主要因素,其促癌性和致癌性已得到证实[2].国际癌症研究中心(IARC)把FB1划分到2B 组,即人类可能的致癌物[3].目前常用的检测方法主要有薄层色谱法(TLC)[4],高效液相色谱法(HPLC)[5-6]和酶联免疫吸附法(ELISA)[7-8]等;TLC 法应用较早,但其操作繁琐、灵敏度和特异性也较差;仪器检测灵敏、准确,研究与应用较多的是HPLC 法,但其成本高、需要昂贵的设备、样品前处理过程复杂、需要专业人员操作,推广使用受到一定限制;ELISA 法快速、灵敏、特异强,检测生物毒素残留安全、可靠,其规模化筛选特点使其更能满足常规化检测的需要[9].但是,目前常用的间接竞争ELISA 试验存在检测时间长、步骤繁琐等缺陷.本研究针对这一问题,通过HRP-FB1的制备和应用,建立直接竞争ELISA 检测方法,目的在于简化检测步骤、缩短检测时间、提高谷物中FB1残留的检测水平.
1 材料与方法
1.1 仪器
WELLSCAN MK3 酶标仪:Thermo;高效液相色谱仪:安捷伦;C18固相微萃取柱:Agela Technologies;UV-1606 紫外分光光度仪、Irprestige-21 型傅立叶红外分光光度仪:日本岛津;FW-100 型高速万能粉碎机:北京中兴伟业仪器有限公司;XK96-A型快速混匀器:姜堰市新康医疗机械有限公司.
1.2 材料
用于加标试验的玉米样品购自洛阳市某超市(经HPLC 检测不含FB1残留).
用于HPLC 检测的玉米样品取自河南驻马店、新乡等地区粮油公司.
辣根过氧化物酶HRP(RZ>3.0,活性>250 U/mg):ROCHE Inc,SANLAND;FB1单抗(Abcam)、FB1标准品、卵清蛋白(OVA):Sigma 公司;酶标抗原HRPFB1为自制;ELISA 显色液A、B:河南华美生物公司;其他试剂均为分析纯.
1.3 酶标抗原HRP-FB1 的制备
取2 mL 0.1 mg/mL 的HRP 溶液逐滴加入到3 mL 1.6×10-3mg/mL 的FB1溶液中,混匀后逐滴加入2.5%的戊二醛溶液1.6 mL,避光搅拌4 h 后向此溶液中加入0.8 mL 1 mol/L 的乙醇胺,室温温育15~20 min,将所得溶液装入透析袋中,用PBS 缓冲溶液(0.01 mol/L,pH7.2)透析3 d.
1.4 样品的前处理
首先将玉米样品用高速粉碎机粉碎,过300 目分子筛,然后进行四分法缩分,取5 g 样品,放入100 mL 的具塞试管中,加入75%的甲醇溶液10 mL,振荡提取30 min,5 000 r/min 条件下离心15 min,滤纸过滤,保留滤液,用PBS 进行5 倍稀释,4 ℃保存,供ELISA 检测所用.
1.5 试验方法
(1)包被:用Tris-HCl 缓冲溶液(pH 9.6,0.1 mol/L)将FB1单抗1∶8 000 稀释后包被到96 孔酶标板上,每孔200 μL,37 ℃温育2 h;(2)洗涤:每孔用洗涤液PBST 洗涤2 次,弃去洗涤液,在吸水纸上拍干;(3)封闭:用1%的OVA-PBS 缓冲液封闭,每孔300 μL,37 ℃温育2 h,洗涤3 次后拍干;(4)竞争性免疫反应:每孔加入100 μL 的FB1标准品溶液或谷物样品提取液和100 μL 的HRP-FB1溶液,37 ℃温育1 h,重复洗涤过程;(5)显色反应:各孔依次加入显色液A、B 各50 μL,37 ℃避光反应20 min;(6)终止反应:每孔加入50 μL 2 mol/L的H2SO4终止液;(7)吸光度测定:酶标仪在490 nm波长处测定各孔吸光度A(参比吸光度为630 nm).
1.6 标准曲线的绘制
配制质量浓度分别为200、300、400、500、600、800 ng/mL 的FB1标准溶液,以FB1质量浓度为横坐标,FB1标准样品各浓度孔的吸光度与FB1零标准品孔吸光度的比值(OD/OD0)为纵坐标,绘制标准曲线.
1.7 精密度及加标回收率
在处理好的空白玉米样品溶液(HPLC 鉴定)中,分别加入FB1标准品,配制质量浓度为200、400、600 ng/mL 的3 个加标样品溶液,采用本方法进行检测,每个浓度测定6 次,考察ELISA 法检测加标玉米样品的精密度和准确度,并与HPLC 法进行比较.
1.8 HPLC 确证试验
取C18固相微萃取柱净化后的阳性样品溶液适量,应用HPLC 进行确证试验[10].
1.9 特异性考察
选取真菌毒素呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、黄曲霉毒素B1(AFB1),按照ELISA 操作步骤得出相应的抑制率,计算交叉反应率.
2 结果与讨论
2.1 HRP-FB1 的制备及表征
参照文献[11],选用戊二醛法制备HRP-FB1偶联物,分别采用紫外光谱法和红外光谱法对其进行表征.利用紫外可见光谱比较FB1、HRP、FB1-HRP 的特征吸收峰:FB1在200 nm 附近有最大吸收峰,HRP 在405、265、205 nm 有特征吸收峰;而FB1-HRP 的特征吸收峰为405、265、205 nm,初步推断偶联成功.同时根据红外光谱扫描情况可知,FB1-HRP 在3 410~3 460 cm-1范围内具有较强较宽的吸收峰,包括FB1分子N—H 键伸展振动产生的3 410 cm-1吸收峰和HRP 分子内O—H 键伸展振动产生3 462 cm-1吸收峰,并且在1 612 cm-1出现FB1的特征吸收峰,确认偶联成功.
2.2 ELISA 法标准曲线、精密度及加标回收率
按照ELISA 方法测定一系列浓度的标准溶液,根据测定结果绘制标准曲线,结果见图1.得出标准曲线方程为Y=-0.000 8X+0.978 9,X 为FB1的质量浓度,Y 为FB1标准样品各浓度孔的吸光度与FB1零标准品孔吸光度的比值(OD/OD0),线性范围在200~800 ng/mL 之间,根据OD/OD0=1.2 求得检测限[12]为182.4 ng/mL.以200、400、600 ng/mL3 个加标样品平行测定6 次,分别做批间变异和批内变异试验,得到批内变异系数为6.4%~8.3%,平均批内变异系数为7.4%;批间变异系数为6.2%~9.5%,平均批间变异系数为7.7%,均小于10%;应用ELISA 法平行测定6 次,检测加标样品中FB1的回收率在85%~105%之间,平均回收率为98.5%.
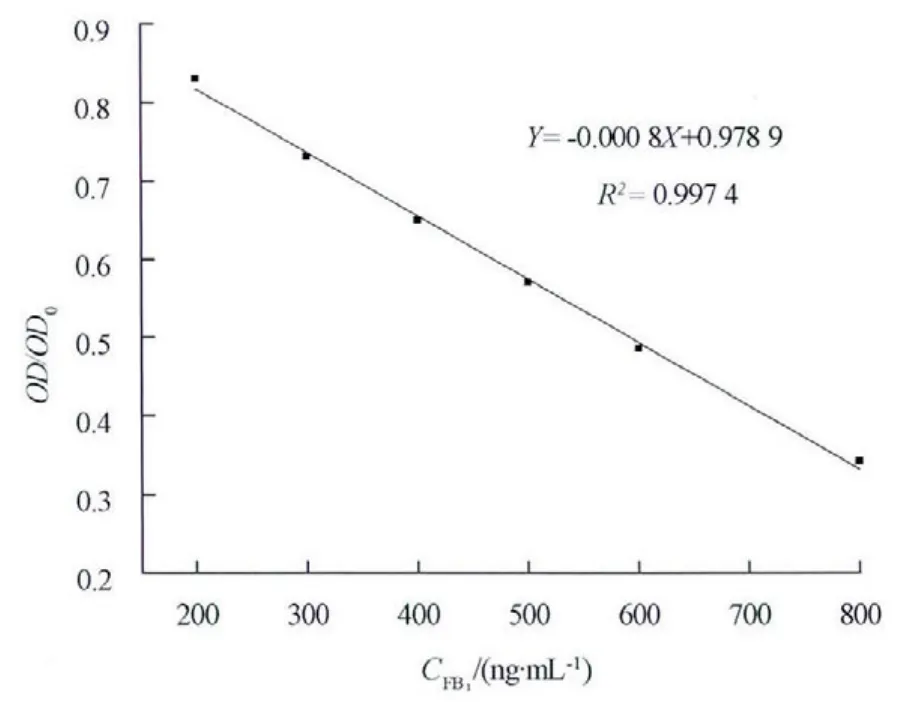
图1 ELISA 法测定FB1 的标准曲线
2.3 ELISA 法与HPLC 法的方法学比较
比较ELISA 法与HPLC 法的线性范围、精密度及回收率,结果见表1.由表1 可见,ELISA 法回收率较高,其灵敏度、精密度能满足实际需求.

表1 ELISA 与HPLC 的方法学比较(n=6)
2.4 HPLC 确证试验
同时采用ELISA 与HPLC 法检测阳性样品,相关性采用直线相关和回归分析,以HPLC 法测得的结果为横坐标,以ELISA 法测得的结果为纵坐标作线性回归分析.结果显示,二者相关性良好(r=0.999 6),ELISA 法回收率较高.
2.5 特异性考察结果
选取真菌毒素呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、黄曲霉毒素B1(AFB1),用PBS 配制一系列质量浓度的溶液,按照ELISA 标准曲线的操作步骤得到相应的抑制率,计算交叉反应率(Cross-reactivity,CR),过程如下:以不同浓度的抗原和结构类似抗原物质分别求各自IC50,按下列公式计算交叉反应率,结果见表2.
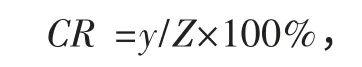
式中:CR 为交叉反应率;y 为FB1抗原的IC50;Z 为结构类似抗原的IC50.

表2 ELISA 方法检测FB1 的特异性
由表2 可知,伏马菌素FB1单抗对其他真菌毒素无特异性反应,说明建立的ELISA 方法测定FB1特异性良好.
3 结论
从ELISA 与HPLC 方法学比较数据来看,国标方法在灵敏度、精密度、线性范围上都优于ELISA,但是ELISA 方法前处理简单、省时,而HPLC 前处理极其复杂,处理过程中待测毒素有一定程度损失,造成回收率偏低.从确证试验看,二者相关性良好.ELISA 方法具有实际推广意义.
综上所述,本研究采用自制的HRP-FB1建立的dc-ELISA 方法虽在灵敏度和精密度方面较国标方法稍差,但其前处理简单、检测时间短,可实现大批量样品的检测;相比间接竞争ELISA(idc-ELISA),其检测速度较快,可以应用于检测玉米等谷物中的FB1含量,其准确、高效、成本低,适于在非实验室或半实验室条件下对大批量样品进行初筛检测.
[1]Gelderblom W C,Marasas W F,Jaskiewicz K,et al.Cancer promoting potential of different strains of Fusarium moniliforme in a short term cancer initiation promotion assay[J].Carcinogenesis,1988,9(8):1405 -1409.
[2]Gelderblom W C,Cawood M E,Snyman S D,et al.Fumonisin B1dosimetry in relation to can-cer initiation in rat liver[J].Carcinogenesis,1994,15(2):209-214.
[3]Yazdanpanah H,Shephard G S,Marasas W F O,et al.Human dietary exposure to fumonisin B1from Jranian maize harvested during 1998-2000[J].Mycopathologia,2006,161(6):395-401.
[4]Rottinghaus G E,Coatney C E,Minor H C.A rapid,sensitive thin layer chromatography procedure for the detection of fumonisin B1and B2[J].J Vet Diagn Invest,1992,4(3):326-329.
[5]Zinedine A,Brera C,Elakhdari S,et al.Natural occurrence of mycotoxins in cereals and spices commercialized in Morocco[J].Food Control,2006,17:868-874.
[6]Ghali R,Ghorbel H,Hedilli A.Fumonisin determination in tunisian foods and feeds.ELISA and HPLC methods comparison[J].J Agric Food Chem,2009,57(9):3955-3960.
[7]Ildik Barna-Vetr,Erzsbet Szab,Bla Fazekas,et al.Development of a sensitive ELISA for the determination of fumonisin B1in cereals[J].J Agric Food Chem,2000,48(7):2821-2825.
[8]Kulisek E S,Hazebroek J P.Comparison of extraction buffers for the detection of fumonisin B1in corn by immunoassay and high -perfo -mance liquid chromatography[J].J Agric Food Chem,2000,48(1):65-69.
[9]Valtonen P,Karppi J,Nyyssönen K,et al.Comparison of HPLC method and commercial ELISA assay for asymmetric dimethylarginine(ADMA)determination in human serum[J].J Chromatogr B,2005,828(1-2):97-102.
[10]GB/T 25228—2010,玉米及其制品中伏马菌素含量的测定免疫亲和柱净化高效液相色谱法和荧光光度法[S].
[11]权英,詹月华,张根华,等.谷物中伏马毒素B1化学发光酶免疫检测[J].中国公共卫生,2011,27(5):552-553.
[12]陈飞,邵景东.伏马菌素B1间接竞争ELISA检测方法的建立和应用[J].江苏农业科学,2007(6):278-281.
