脉冲磁场下储藏小麦自身呼吸CO2 变化分析研究
2013-04-23蒋华伟李战升
蒋华伟,李战升
(1.河南工业大学 信息科学与工程学院,河南 郑州 450001;2.河南邮电规划设计院,河南 郑州 450008)
0 引言
防止粮食陈化变质是安全储藏的关键,统计发现占全国粮食总量50%~60%的农户储粮的年平均损失率为8%~10%,其中5%左右是害虫造成的,剩余的是粮食自身呼吸、新陈代谢和微生物霉变所致.在粮食微生物的危害效应和机理方面,国内外已经开展了大量的研究[1-4],并提出了许多有益的建议和措施.呼吸作用也是粮食安全储藏的重要因素,粮食的呼吸是在活细胞内所进行的复杂生物化学反应过程,以消耗自身的营养物质为基础.影响粮食呼吸的因素有湿度、温度、粮食颗粒的形状、不同部位以及新陈程度等.针对粮食陈化过程的呼吸作用,特别是微生物呼吸过程中所产生的CO2这个衡量参数效应,国内外进行的研究主要集中在CO2浓度的检测和推演霉化程度等方面.如Thomas[5]和梁微[6]用检测仪器对粮堆的CO2浓度与储粮霉菌数量变化的相关性进行研究.还有在不同生理状态下,Antonio[7]根据霉菌对粮食危害程度和安全风险的差异关系,由监测储粮中CO2浓度变化来推演储粮霉菌的活动状态.文献[8]对储粮中霉菌活动的生理状态与CO2浓度变化的相关性进行研究,获得呈“S”形曲线的储粮CO2浓度变化关系,由CO2浓度变化来推断霉菌的生长状态.而文献[9]针对不同粮食水分、环境温度以及不同CO2气体浓度下储粮真菌区的变化情况,研究了较高水分、较高储藏温度下CO2浓度对粮食真菌的抑制效果.
目前对粮食陈化变质中自身呼吸和新陈代谢效应鲜有研究.实际上,该作用是不可忽略的.因为储粮自身呼吸和微生物的霉变之间是互为影响,甚至粮食的过度呼吸为微生物的代谢提供了合适的水分和温度等条件,并为霉变带来了必要的能量物质.同时,前人的研究工作还没有涉及实际环境中离子束、辐照、电磁等外界干扰因素的作用,特别是脉冲强磁场的强度和脉冲数的量化作用效应,因此,作者进行了脉冲强磁场下粮食(小麦)自身呼吸效应探索,为粮食安全储藏提供技术保证.
1 材料与方法
1.1 样品
仓储小麦:本地.
1.2 仪器与试剂
CO2浓度测试仪和脉冲强磁场装置:中科院合肥物质科学研究院;QLY-T 型钳式粮食水分快速测定仪:山东青州市巨丰粮油仪器厂.
次氯酸钠溶液(5%)和蒸馏水.
1.3 方法
1.3.1 小麦水分调节
称取10 kg 小麦,用蒸馏水喷洒拌和均匀,然后密封装入15 ℃下10 L 玻瓶中平衡10 d.在整个试验期间,调节和保持装粮玻瓶内的湿度相对平衡:低水分(12.5%)、中水分(15%)、高水分(16.5%).
1.3.2 小麦储藏温度
在试验测试过程中采用空调、加热器和保温材料等措施,把室温控制在25 ℃以内.
1.3.3 磁场强度和脉冲数
加载磁场的方式是将小麦暴露于脉冲强磁场中.脉冲磁场的强度分别为2 T、4 T、6 T、12 T 和16 T,脉冲数分别为2、4、6、8 和10;两个脉冲间的时间间隔为20 s,脉冲宽度为15 ms;处理时间为2 h.
1.3.4 CO2浓度检测
将预热后的CO2测试仪的进出气管与小麦储藏容器的管道连接,打开气管的进出阀门,开启输气泵,保持3 min 后,屏幕上显示的数字就是要检测的浓度.
2 结果与分析
2.1 常规小麦自身呼吸CO2 浓度变化
用5%的次氯酸钠溶液洗涤小麦,目的是为了获得无菌小麦真实的自身呼吸效果,并用无菌水清洗小麦,最后调节小麦的水分为12.5%、15%、16.5%,25 ℃下储藏,结果见图1.
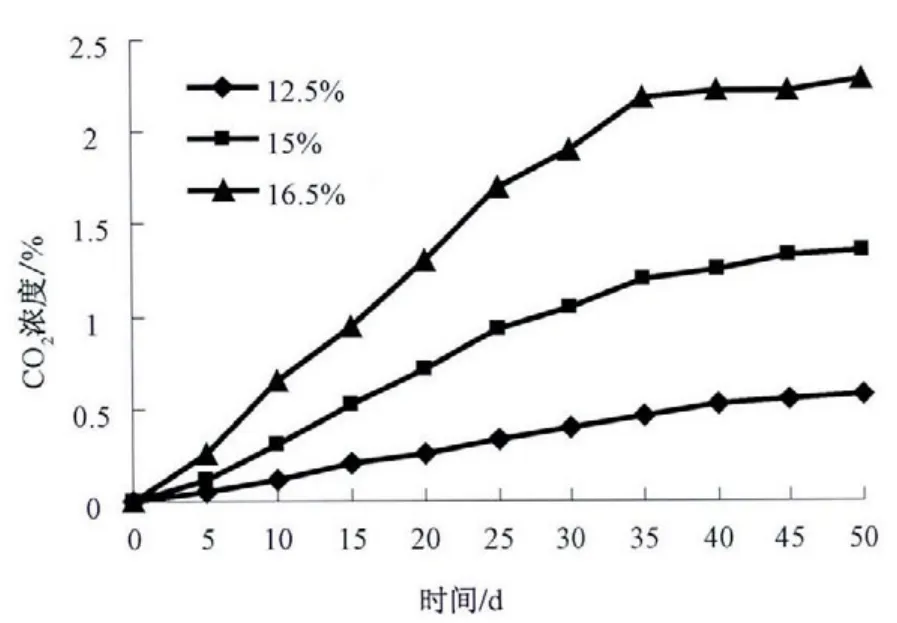
图1 25 ℃时小麦自身呼吸CO2 浓度变化
从图1 可知,在12.5%低水分情况下,小麦自身呼吸中CO2浓度呈线性变化,且变化幅度不大,在50 d 内仅升高0.58%,这说明低(安全)水分的粮食在常规储粮期间,小麦自身呼吸作用不活跃,不会对小麦的品质造成危害;在15%中等水分情况下,小麦自身呼吸CO2浓度大致呈线性变化,变化幅度较大,在50 d 内升高了1.35%;但在第15 天处出现了可区分的拐点,尽管后面CO2浓度仍在增加,但爬升比较平坦;在16.5%高水分情况下,小麦自身呼吸中CO2浓度严重偏离线性变化趋势,且变化幅度很大,在50 d 内升高2.28%;类似于中等水分情况在第15 天处也出现了拐点,非常明显,拐点之后CO2浓度仍将继续增加,但趋势缓急不定.
从图1 可知,中、高等水分下的CO2浓度远比低水分情况下增加得快,这表明在相同储藏温度(25 ℃)下,中、高等水分导致小麦自身呼吸加速,可为微生物的生存和霉变提供先期条件(水分、温度和营养);相比于低水分的先扬后抑情况,当储藏时间超过25 d 后,中、高等水分下CO2浓度仍会升高,但变化趋势难以确定,这可能与试验测试的精度或次数有关.为此,对图1 中的CO2浓度数据进行线性相关性分析,来确定小麦自身呼吸作用中CO2浓度的变化,结果如表1 所示.

表1 小麦自身呼吸CO2 浓度变化线性关系
从相关系数可以发现在试验周期内(50 d)CO2浓度变化的偏离程度,低水分比中、高水分的线性度更好,表象上为低水分CO2浓度的变化恒稳,其实这反映了中、高水分下,图1 拐点后的偏离不仅仅是偶然的测试误差所致,由此进一步推断出实际非封闭的仓库储粮环境中可能已有极少量微生物的出现,尽管数量不多,但它们的呼吸增加了小麦的CO2浓度.另外,斜率再次表明中、高水分下,小麦自身呼吸强度变大,由此导致温度和水分快速提高,进一步加快了小麦的陈化过程.
试验过程中测试前后湿度有一定变化.假设在理想密闭下,这与小麦呼吸中产生的水分有关.
2.2 脉冲磁场下小麦自身呼吸CO2 浓度的变化
25 ℃下小麦的除菌处理仍采用2.1 中的方法.
由于采用的脉冲磁场强度为2 T、4 T、6 T、12 T和16 T,磁场的脉冲数为2、4、6、8 和10,显然排列组合后有25 种形式,它们还分别对应于12.5%低水分、15%中等水分以及16.5%高水分情况,这使得数据更加复杂,处理和对比分析工作尤为烦琐.因此,在数据库中选取具有代表性的两种情况,即磁场强度为4 T 和脉冲数为6(记作4T-6)以及磁场强度为12 T 和脉冲数为8(记作12T-8)的数据(见图2),并对它们进行比较分析.
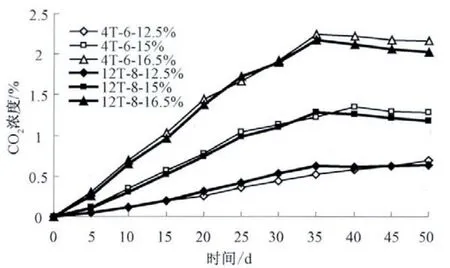
图2 25 ℃时不同磁场强度和脉冲数对小麦自身呼吸CO2 浓度的影响
在强度为4 T 和脉冲数为6 的磁场作用下,由图2 可知:低水分(12.5%)情况下,CO2浓度的增加类似于图1,脉冲磁场强度和脉冲数几乎没有对小麦起作用.但对中等水分(15%)和高水分(16.5%),小麦自身呼吸产生的CO2浓度随时间呈现先增加再平缓减小的变化趋势;在整个变化过程中,中、高水分分别存在两个不同程度的拐点,尽管出现在不同的储藏时间处(中等水分的为第15 天和第30 天;高水分的为第10 天和第25 天),但中、高水分两种情况下的曲线都呈从早期先剧增、后缓增、再减小的三段变化;同时从起始CO2浓度快速增加,后来变慢以至减小的情况来看,可以推断脉冲磁场的强度和脉冲数能促进储藏前期和中期的小麦呼吸,而在储藏后期,强度和脉冲数对小麦的呼吸起抑制作用.
强度为12 T 和脉冲数为8 的磁场作用下,由图2 可知:低水分情况下,CO2浓度变化与图1 有所不同,CO2浓度随储藏时间出现了先较快增加,后平缓变化的趋势,这说明在室温(25 ℃)储藏条件下,高强度和大脉冲数在较长时间储藏后能抑制小麦的呼吸作用,这对小麦的长期储藏是有利的,可以延缓其陈化变质;而在中、高水分情况下,小麦自身呼吸产生的CO2浓度值相应地减小,这显示高磁场强度和大脉冲数对小麦的储藏具有促进作用.
从图2 还可以发现,在储藏后期,磁场强度和脉冲数对小麦呼吸作用表现为不同程度的抑制效果,表现出脉冲磁场作用的阈值性和累积效应.这可能是因为磁场作为物理因素,对小麦呼吸作用的影响与多种因素有关,在不同湿度(水分)下,存活期内小麦自身呼吸生理作用的变化是不同的,需要特定的磁场强度和脉冲数的效应,同时还要有一定的作用时间积累,这显示了磁场作用的阈值性.
脉冲磁场对小麦呼吸作用所具有的强度窗效应(或称功率窗),在某种程度上是与能够触发小麦靶系统生物效应的电磁场阈值有一定关系,而时间窗效应很可能跟小麦自身的调节适应机制有关.由此可以假设推断:磁场作用于小麦细胞时,存在物理意义上的窗效应,即这些部位(如小麦的胚)的呼吸只对某些特征参数的磁场作用才产生特异性的应答现象.
3 结论
本文对常规条件下和在脉冲强磁场作用下,小麦自身呼吸中CO2浓度变化进行了研究,以推断不同状况下小麦陈化演变关系,为小麦的安全储藏提供理论依据.
在25 ℃的常规条件下储藏50 d 内,水分为12.5%的小麦呼吸产生的CO2浓度呈线性变化,且斜率很小,即CO2浓度变化恒稳,可以安全存储;而中(15%)、高(16.5%)水分小麦的CO2浓度变化已不再呈线性关系,特别是高湿度下产生了严重偏离,变化幅度较大,不利于小麦的安全存储.
在脉冲强磁场作用下,较小磁场强度和脉冲数对低水分作用微弱,而较大磁场强度和脉冲数导致CO2浓度前期较快和后期平缓地增加,这说明脉冲强磁场和大脉冲数能通过抑制小麦的后期呼吸来延缓小麦的陈化变质,实现小麦的安全储藏.对中、高水分的小麦,CO2浓度变化曲线出现两个拐点(阈值),前期促进小麦呼吸,后期抑制小麦呼吸,显现出脉冲强磁场在小麦呼吸作用中的窗口效应,这可能是不同磁场强度和脉冲数与小麦不同呼吸部位(靶点)作用的应答机制所致,对此还需进一步的研究和探索.
[1]蔡静平.粮油食品微生物学[M].北京:中国轻工业出版社,2002.
[2]李瑞芳,韩北忠,陈晶瑜,等.黄曲霉生长预测模型的建立及其在玉米储藏中的应用[J].中国粮油学报,2008,23(3):145-147.
[3]Audilakshmi,Stenhouse S J W,Reddy T P.Genetic analysis of grain mold resistance in white seed sorghum genotypes[J].Euphytica,2005,145(2):95-101.
[4]程树峰,唐芳,伍松陵.储粮真菌危害早期检测方法的研究[J].中国粮油学报,2011,26(4):85-88.
[5]Thomas B,Ulla S,Johan S.Volatile metabolites produced by six fungal species compared with other indicators of fungal growth on cereal grains[J].Applied and Environmental Microbiology,1992,58(8):2599-2605.
[6]梁微,蔡静平,高翔.CO2检测法监测小麦储藏微生物活动的研究[J].河南工业大学学报:自然科学版,2009,30(2):55-58.
[7]Antonio F M,Renata R C,Myrna S.Fungi that produce mycotoxins:Conditions and occurrence[J].Mycopathologia,1998,65(7):45-47.
[8]耿旭,黄淑霞,蔡静平.储粮中霉菌活动的生理状态与粮堆CO2浓度变化的相关性[J].河南工业大学学报:自然科学版,2010,31(3):12-15.
[9]罗建伟,李荣涛,陈兰,等.CO2气调储粮技术对粮食真菌的抑制效果研究[J].粮食储藏,2003,34(6):34-41.
