原人参二醇脂质立方液晶纳米粒在大鼠体内的药动学研究
2013-04-22金鑫,张振海,孙娥,刘其媛,贾晓斌
金鑫,张振海,孙娥,刘其媛,贾晓斌


[摘要] 目的: 本研究旨在建立高效液相色谱-串联质谱测定大鼠血浆中原人参二醇的方法,分析原人参二醇脂质立方液晶纳米粒、原人参二醇原料药的药代动力学特征。 方法: SD大鼠分别灌胃给予原人参二醇(PPD)、原人参二醇脂质立方液晶纳米粒后,定时眼眶取血,0.05%甲酸甲醇-0.05%甲酸水(95∶5)为流动相。采用电喷雾离子化四极杆串联质谱,以全扫描检测(SCAN)方式进行检测,用于定量分析的二级碎片离子分别为m/z 460.4/425.3(PPD)和m/z 622.9/587.4(Rh2,内标),检测血浆中的原人参二醇含量,绘制药时曲线,DAS程序计算药动学参数。 结果:PPD血浆浓度测定方法的线性范围为10~1 407 μg·L-1,定量限为2.5 μg·L-1。日内、日间精密度 (RSD) 均小于13 %,准确度(RE)在±8.5%之内。 结论:该方法专属性强,灵敏度高,血浆用量少,适用于药代动力学研究。制备成原人参二醇脂质立方液晶纳米粒可以促进原人参二醇在体内的吸收,其相对生物利用度为原料药的166%。
[关键词] 原人参二醇;立方液晶;生物利用度;高效液相色谱-串联质谱法
-原人参二醇(PPD)是原人参二醇组皂苷(包括Rb1, Rb2, Rb3, Rc, Rd, Rg3,Rh2)的苷元,具有显著的抗癌效果[1-3]。PPD具有抑制癌细胞转移,改变癌细胞膜完整性,终止癌细胞的细胞周期,诱导癌细胞细胞凋亡等作用,使其成为人参皂苷中具有最强的抗癌活性的皂苷类成分之一[4-7]。研究表明,PPD溶解性差,口服生物利用度低[8],半衰期短。因此需要采用适宜的制剂改善其口服生物利用度。
脂质立方液晶由于良好的生物降解性和促吸收效果好的特点,近年来逐渐被关注和研究[9-10]。其通常是由极性脂质在含水环境中通过吸附定量的水自发的形成具有特殊内部结构的类凝胶相立方骨架结构,具有较强的黏膜黏附性,从而促进药物跨膜吸收[11-13]。作者采用单油酸甘油酯和泊洛沙姆407制备了自组装闭合脂质双层“蜂窝状”结构的立方液晶纳米粒包裹PPD,增加其与肠道细胞的亲和性,以促进PPD口服吸收[14]。
因此,本研究旨在建立高效液相色谱-串联质谱测定大鼠血浆中原人参二醇的方法,分析原人参二醇脂质立方液晶纳米粒、原人参二醇原料药的药代动力学特征,从而为PPD脂质立方液晶制剂的开发和临床药代动力学研究提供工作基础和理论依据。
1 材料
Agilent 6410A 四级杆 LC-MS 系统 (包括G1311A 四元泵,G322A 脱气泵,G1329 自动进样器,G1216A 柱温箱,Agilent 化学工作站) (美国 Agilent 公司),氮吹仪(美国Organomation公司),KQ-100B型超声波清洗器(混山市超声仪器公司),XW-80A微型漩涡混合仪(上海沪西分析仪器厂有限公司); Millipore超纯水仪(Millipore,Bedford,MA,美国),TGL-16G台式离心机(上海安亭科学仪器厂),IKAT25高速剪切乳匀机(德国IKA集团)
原人参二醇(PPD,南京泽朗有限公司,批号111747-201107);人参皂苷Rh2对照品(上海顺勃有限公司,批号960212);单油酸甘油酯(GMO,丹麦丹尼斯克,DIMODANMO/D,纯度≥90%,批号11670,批号WPHB615B);泊洛沙姆 407 ( F127,德国 BASF);甲醇(色谱纯,美国Tedia公司)
SD大鼠,雌雄兼有,体重200~250 g ,由SLEK上海动物实验中心提供,合格证为SCXK(沪)2007-0005。
2 方法
2.1 脂质立方液晶的制备
称取单油酸甘油酯和泊洛沙姆407于恒温水浴中熔融,加入一定量的原人参二醇溶解后,再缓慢加入一定量的水,涡旋混匀,超声,室温下放置。形成透明凝胶后,加入一定量的水,用高速搅拌机搅拌制成粗分散体系,再高压匀质,制备成粒径均匀的立方晶纳米粒。
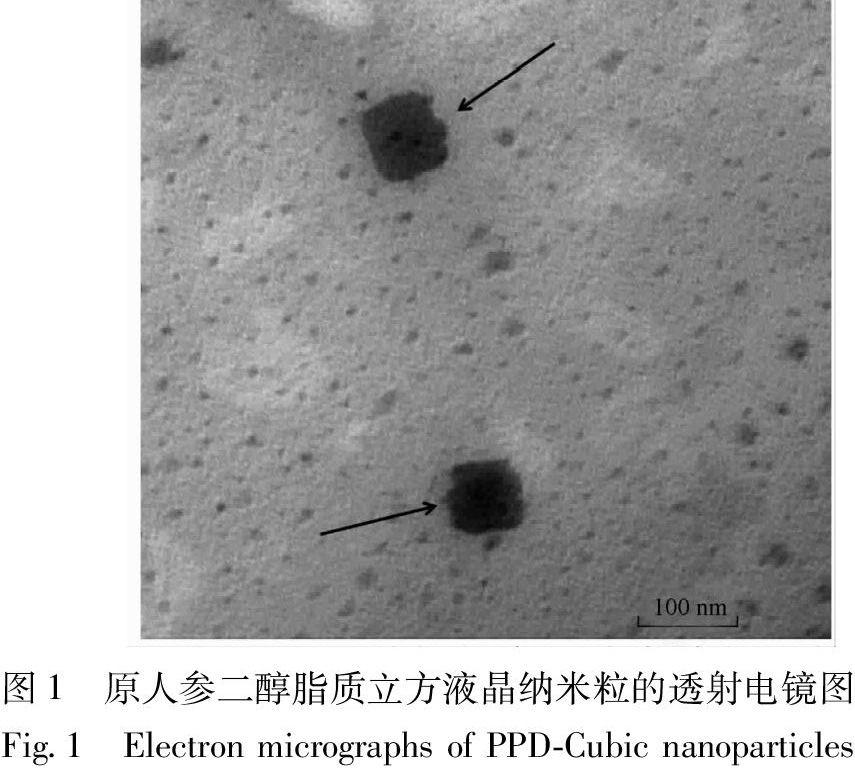
2.2 透射电镜观察原人参二醇脂质立方液晶纳米粒的形态
纯化后取待检样品加水稀释,滴至覆有支持膜的铜筛网上,静置 3 min,用滤纸从铜网的边上吸去多余的液体,以 1%醋酸双氧铀染色,自然干燥 15 min (必要时红外加热干燥),用透射电镜Jeol JEM-1400 (加速电压为80 kV)观察样品形态,并拍摄照片。
2.3 给药方案
SLEK上海动物实验中心SD大鼠12只,200~220 g,雌雄各半,给药前禁食12 h,不禁水。平均分为2组,分别灌胃给予PPD和PPD立方液晶,剂量为(2.0±0.2) mg·kg-1,分别于给药后0,0.25,0.5,1.0,1.5,2.0,3.0,4.0,6.0,8.0,12.0 h于大鼠眼眶取血0.5 mL;采血后离心5 min (3 000 r·min-1),取血浆,于-20 ℃保存待测。
2.4 对照品溶液的制备
精密称取PPD对照品10 mg,置于10 mL量瓶中,加甲醇定容至刻度,配制成1 g·L-1的储备液,于4 ℃保存。临用前,取对照品储备液适量,先用甲醇稀释成0.001 mg·L-1,再按倍数稀释法稀释至所需浓度,即得。
2.5 内标溶液制备
精密称取PPD对照品10 mg,置于10 mL 量瓶中,加甲醇定容至刻度,配制成1 g·L-1的储备液,于4 ℃保存。临用前,加甲醇稀释成1 mg·L-1,即得。
2.6 血浆样品处理
取血浆样品100 μL,加入内标溶液10 μL,加入乙酸乙酯1.1 mL,涡旋3 min,离心11 000 r·min-1,15 min,取上清液,N2下吹干,加入甲醇100 μL复溶,涡旋30 s,11 000 r·min-1离心15 min,取上清液进行HPLC-MS分析。
2.7 质控样品的制备
取血浆样品100 μL,先加入样品溶液和内标溶液,再加入乙酸乙酯1.1 mL,涡旋3 min,离心11 000 r·min-1,15 min,取上清液,N 2下吹干,加入甲醇100 μL复溶,涡旋30 s,11 000 r·min-1离心15 min,取上清液进行HPLC-MS分析。
2.8 色谱条件
ZORBAX SB C 18柱(4.6 mm×150 mm,5 μm);流动相0.05%甲酸甲醇-0.05%甲酸水(95∶5);流速1.0 mL·min -1;柱温30 ℃;进样体积为10 μL。
2.9 质谱条件
毛细管电压4.0 kV,雾化器压力275.8 kPa,干燥气流速10 L·h-1,辅助气温度350 ℃;离子检测方式全扫描检测(SCAN),离子极性正离子( positive),离子化方式气动辅助电喷雾离子化(ESI),扫描范围m/z 100~1 000。
2.10 数据处理
用 SPSS 11.0统计软件对各时间点的血药浓度进行计算,绘制血药浓度-时间曲线。各血药浓度-时间曲线用 DAS 2.0药代动力学程序进行房室模型模拟,计算主要的药动学参数, 数据以±s的形式表示。
3 结果
3.1 原人参二醇脂质立方液晶纳米粒的表征
透射电镜观察结果表明,原人参二醇脂质立方液晶纳米粒的形状为明显的方形结构,粒径约为60 nm(图1),不同于普通脂质体的内部同心圆的“指纹状”多层囊泡结构。
3.2 质谱分析
本方法用正离子方式检测,质谱图中获得内标人参皂苷Rh2的质谱图(图2A),其准分子离子[M+H]+峰m/z 622.9,生成主要碎片离子m/z 587.4,用于定量分析。PPD准分子离子峰m/z 460.4的质谱图(图2B),生成主要碎片离子m/z 425.3用于定量分析。
3.3 方法学考察
3.3.1 方法的专属性 取空白大鼠血浆200 μL,除不加标准溶液外,其余按2.6项下依法操作,进样10 μL,在1.71,3.41 min均无内源性干扰(图3A);将一定浓度的PPD标准溶液和内标标准溶液加入空白血浆中,除不加流动相外,依同法操作,PPD的保留时间为3.41 min(图3B),内标物的保留时间为1.71 min。取给药后1.5 h收集的血浆样品,按2.6项下依法操作,结果表明,空白血浆中内源性物质不干扰PPD及内标物的测定。
3.3.2 标准曲线和定量限 精密量取PPD对照品14.07 mg于10 mL量瓶中,配制成质量浓度为1 407,703,351,175,88,44,22,10 μg·L-1的PPD对照品溶液。分别加入药品使血清中PPD质量浓度为1 407,703,351,175,88,44,22,10 μg·L-1,同时加入200 μg·L-1人参皂苷Rh2 10 μL作为内标,每组平行取大鼠空白血浆3份,按2.6方法处理。吸取此溶液10 μL进样,记录峰面积。以对照品实际浓度为横坐标,以PPD与内标物峰面积比为纵坐标,进行线性回归,得标准曲线Y=0.002 9X-0.088 3(r=0.997 8),线性范围为5~1 400 μg·L-1,且线性关系良好。最低检测限为信噪比的10倍(S/N=10)为2.5 μg·L-1。
3.3.3 精密度与准确度 以空白血清配制高、中、低(1 000,100,10 μg·L-1)3个质量浓度的PPD溶液,按2.6操作,平行测定5次,分别计算其RSD,10,100,1 000 μg·L-1的PPD对照品溶液加入200 μg·L-1人参皂苷Rh 2 10 μL作为内标的RSD,日间差和日内差的计算分别1 d内样品平行5次,同样方法连续3 d进样,结果表明精密度良好(表1)。
3.3.4 回收率 以空白血浆配制高、中、低(1 000,100,10 μg·L-1)3个质量浓度的PPD溶液,所得溶液按2.6操作,进样,平行测定5次,以实际测得量与理论加入量的比值计算提取回收率,10,100 ,1 000 μg·L-1的PPD对照品溶液的提取回收率均大于68%,且RSD分别为14%,8.5%,6.7%,表明提取回收率良好。方法回收率,以实际测得量与加入到生物基质中已知量的对照品产生的响应值比值,10,100 ,1 000 μg·L-1的PPD对照品溶液的方法回收率均大于86%,且RSD分别为9.8%,8.2%,6.3%,表明方法回收率良好(表2) 。
3.3.5 稳定性考察 以空白血浆配制高、中、低(1 000,100,10 μg·L-1)3个质量浓度的PPD溶液,测定4 ℃放置24 h、冷冻1 d、冻融3次、-20 ℃存放3周对PPD的稳定性的影响。结果表明在上述条件下PPD的稳定性良好(表3)。
3.4 HPLC-MS测大鼠血浆中PPD的含量
大鼠灌胃给药原人参二醇和原人参二醇脂质立方液晶纳米粒(2 mg·kg-1 PPD),测得其血浆中PPD的浓度变化,得平均血药浓度-时间曲线(n=6)(图4)。口服给药PPD达峰浓度Cmax为73.45 μg·L-1,达峰时间Tmax约为85 min。原人参二醇脂质立方液晶纳米粒的达峰浓度Cmax为100.14 μg·L-1,达峰时间Tmax约为125 min。原人参二醇和原人参二醇脂质立方液晶纳米粒的达峰时间和达峰浓度都具有显著的差别。原人参二醇和原人参二醇脂质立方液晶纳米粒的曲线下面积分别为28.01,46.45 mg·min ·L-1(表4)。由此可见,PPD在体内的血药浓度在1.5 h内达到峰值,提示其在大鼠体内吸收较快。而PPD立方液晶使PPD的Tmax有所延后,Cmax显著提高,并且有一个缓慢释放的过程,增加了药物在体内的滞留时间,其相对生物利用度是原料药的1.66倍。
4 讨论
原人参二醇的分子结构中缺少双键共轭基团,紫外吸收较差,且最大吸收波长主要在 203 nm 处,且此处干扰较为强烈,因此常用的高效液相色谱-紫外检测方法无法完成对生物样品中低含量的原人参二醇的定量分析,因此选择灵敏度更高的质谱检测方法。但是原人参二醇质谱检测方法也存在较大难度,呈现在选择反应监测方式下反应离子对的选择,对原人参二醇对照品进行一级全扫描时发现,原人参二醇很难进行负离子化,正离子化条件下分子离子峰只有[M+Na]+,未见[M+NH4]+和[M+1]+峰,且峰度并不理想。选择[M+1] +进行二级碎片离子扫描,出现脱去2分子水的特征碎片m/z 425.3,峰度较好,因此选择其用于定量分析。
对于生物样品的预处理,曾先后尝试使用固相萃取、沉淀蛋白和液-液萃取的方法。由于原人参二醇结构中疏水性基团较多,易于用有机溶剂进行液-液萃取和固相萃取。利用乙酸乙酯溶液进行液-液萃取可获得较高提取率(约为70%)。固相萃取法很容易将原人参二醇从生物样本中分离出来,但固相萃取时需用甲醇进行洗脱,若对洗脱液不进行浓缩,达不到实验所需的灵敏度要求,若进行浓缩,则增加了实验步骤,过于繁琐,不易于应用。蛋白沉淀法虽然简单易行,但是沉淀法的高污染性不利于质谱仪的使用。因此,本实验选择了快速、灵敏度高、重复性好的的液-液萃取进行生物样本前处理。
PPD血浆浓度测定方法的线性范围为10~1 407 μg·L-1,定量限为2.5 μg·L-1。日内、日间精密度 (RSD) 均小于13%,准确度(RE)在±8.5%之内。本方法专属性强,灵敏度高,血浆用量少,适用于药代动力学研究。
[参考文献]
[1] 韩美华, 陈婧, 陈士林, 等. 20(S)-原人参二醇药质体的制备及体外评价[J]. 中国中药杂志, 2010, 35(7): 842.
[2] Bae E A, Han M J, Kim E J, et al. Transformation of ginseng saponins to ginsenoside Rh by acids and human intestinal bacteria and biological activities of their transformants[J].Arch Pharm Res,2004,27: 61.
[3] Tawab M A, Bahr U, Karas M, et al. Degradation of ginsenosides in hunmans after oral administration[J]. Drug Metab Dispos, 2003,31: 1065.
[4] Li G, Wang Z, Sun Y, et al. Ginsenoside 20(S)-protopanaxadiol inhibits the proliferation and invasion of human fibrosarcoma HT1080 cells[J]. Basic Clin Pharmacol Toxicol, 2006,98: 588.
[5] Dong H, Bai L P, Wai W V K, et al. The in vitro structure-related anti-cancer activity of ginsenosides and their derivatives[J]. Molecules, 2011,16: 10619.
[6] Liu G Y, Bu X, Yan H, et al. 20S-protopanaxadiol-induced programmed cell death in glioma cells through caspase-dependent and -independent pathways[J]. J Nat Prod, 2007,70: 259 .
[7] Zhu G Y, Li Y W, Tse A K W, et al. 20(S)-protopanaxadiol, a metabolite of ginsenosides, induced cell apoptosis through endoplasmic reticulum stress in human hepatocarcinoma HepG2 cells[J]. Eur J Pharmacol, 2011,668, 88.
[8] 韩美华,陈婧,陈士林,等. RP-HPLC法测定20(S)-原人参二醇药质体含量及包封率[J].中国中药杂志,2009,34(9):1082.
[9] 彭新生 ,杨志文, 陈美婉, 等. 辣椒碱立方液晶凝胶的制备、表征及含量测定[J]. 中国中药杂志, 2010, 35(23): 3123.
[10] Gopal G R, Shailendra S R, Swarnlata S R. Cubosomes: an overview[J]. Biol Pharm Bull, 2007,30: 350.
[11] Lee J, Kellaway I W. Buccal permeation of [D-Ala(2), D-leu(5)] enkephalin from liquid crystalline phases of glyceryl monooleate[J]. Int J Pharm, 2000,195: 35.
[12] Lee J, Kellaway I W. Combined effect of oleic acid and polyethylene glycol 200 on buccal permeation of [D-Ala(2), D-Leu(5)]enkephalin froma cubic phase of glyceryl monooleate[J]. Int J Pharm, 2000,204: 137.
[13] Sagalowicz L, Leser M E, Watzke H J, et al. Monoglyceride self-assembly structures as delivery vehicles[J]. Trends in Food Sci & Techn, 2006,17: 204.
[14] Lopes L B, Ferreira D A, de Paula D, et al. Reverse hexagonal phase nanodispersion of monoolein and oleic acid for topical delivery of peptides: in vitro and in vivo skin penetration of cyclosporin A[J]. Pharm Res, 2006,23: 1332.
Study on pharmacokinetics of 20(S)-protopanaxadiol
lipid cubic nanoparticles
JIN Xin, ZHANG Zhen-hai, SUN E, LIU Qi-yuan, JIA Xiao-bin*
(Hospital of Chinese and Western Integrated Medicine affiliated, Nanjing University of
Chinese Medicine, Nanjing 210028, China)
[Abstract] Objective: To establish a high-performance liquid chromatographic/tandem mass spectrometry (HPLC-MS/MS) method for determining 20(S)-protopanaxadiol (PPD) in rat plasma, in order to analyze pharmacokinetic characteristics of PPD and PPD cubic nanoparticles. Method: Sprague-Dawley rats were administered orally with PPD and PPD cubic nanoparticles, respectively. Their blood samples were obtained from fossa orbitalis at regular time points. The mobile phase was 0.05% formic acidac etonitrile-0.05% formic acidac water (95∶5). Electrospray ionization (ESI) was adopted for the quadrupole tandem mass spectrum. SCAN mode was used for the quantitative analysis, with m/z 460.4/425.3 and m/z 622.9/318.3 (Rh2, interior label) as secondary fragment ions. The concentration of PPD in plasma was analyzed. The concentration-time curve was mapped. The data were calculated by DAS program. Result: The linearity of the PPD plasma concentration determination method ranged between 10-1 407 μg·L-1, with the limit of quantification of 2.5 μg·L-1. Both of the inter-day and intra-day precisions (RSD) were less than 13.25%, and the accuracy (relative error) was between ±8.50%. Conclusion: The method was so highly specific and sensitive with less plasma that it is suitable for pharmacokinetic studies. The prepared 20(S)-protopanaxadiol lipid cubic nanoparticles can enhance its absorption in vivo. Its relative bioavailability is 166% of the raw material.
[Key words] PPD; cubic nanoparticles; bioavailability; HPLC-MS
doi:10.4268/cjcmm20130223
[责任编辑 陈玲]
