微囊藻毒素-LR对大鼠行为认知能力及血脑屏障通透性的影响
2013-04-19李洋周珏孙冰李雪珂李云晖
李洋,周珏,孙冰,李雪珂,李云晖
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏南京 210009)
微囊藻毒素(MCs)可以导致多器官毒性[1]。迄今已从微囊藻和其它蓝藻中分离鉴定了近80种MC同系物[2],其中在环境中存在较为普遍的有MC-LR和MC-RR,尤以MC-LR含量最多、毒性最大[3]。越来越多的实验表明,MC-LR还可能对神经系统功能产生损害作用[4]。而目前有关MC-LR神经毒性以及相关毒性作用机制的研究报道较少。
血脑屏障(blood brain barrier,BBB)保持着中枢神经系统内环境的稳定,而内皮细胞之间的紧密连接是保持内环境稳定的主要结构之一。将MCs静脉注射入大鼠体内后,在脑内可以检测到少量 MCs的蓄积[5],由此提示 MCs可能会透过 BBB而进入脑内。本研究利用水迷宫实验和旷场实验,研究MC-LR对大鼠的认知和自发行为的影响,通过观察大鼠染毒后的BBB通透性,为研究MC-LR对神经系统的损伤提供理论依据。
1 材料与方法
1.1 实验动物
雌性SD大鼠40只,体重80~100 g,由上海斯莱克实验动物中心提供,动物合格证号:SCXK(沪)2007-0005。
1.2 主要试剂与仪器
MC-LR标准品、伊文思蓝(EB,美国Sigma公司),UV-2100型紫外2可见分光光度计(中美合资UNICO),Ethovision XT行为学分析系统(荷兰Noduls公司)。
1.3 动物饲养和分组
实验动物饲养于东南大学公共卫生学院SPF级动物屏障系统,饲养环境为18~23℃,相对湿度45%~55%。适应环境1周之后按体重随机分为4组,每组10只。灌胃染毒,染毒时间3个月。3个剂量组染毒剂量依次为 0.13、0.5、20 μg·kg-1MC-LR。对照组注射相同体积0.9%生理盐水。染毒期间,大鼠自由摄食和饮水。
1.4 Morris水迷宫实验
Morris水迷宫由1个圆形水池(直径160 cm)、图像采集系统、电脑操作分析系统组成,是研究动物空间学习记忆功能常用的经典模型工具[6]。水迷宫水池分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4个象限。水温保持在22~26℃,排除环境因素对实验的干扰。Morris水迷宫实验包括定位航行实验和空间探索实验两个部分。使用Noldus公司开发的动物行为轨迹跟踪分析系统Ethovision TX 7.0软件分析结果。
1.5 旷场实验
将小鼠放入旷场的正中央格并开始计时,观察大鼠在5 min内的行为,记录大鼠在5 min内的总运动距离、在中央区域和周围区域的次数、运动行为(包括站立、修饰等行为)的持续时间。
1.6 EB测定BBB通透性变化
各组大鼠处死前股静脉注入2%EB 2 ml·kg-1,经心脏灌注生理盐水后迅速断头取脑,分离左右半球,按1 ml·(100 mg)-1脑组织加入甲酰胺溶液,60℃水浴抽提 24 h,1 000 r·min-1离心 5 min,用 Spectronic 21型紫外可见分光光度计在620 nm处测光密度值,计算各组脑组织EB含量(μg·g-1)。
1.7 统计学处理
2 结 果
2.1 MC-LR对大鼠学习能力的影响
表1实验结果显示,随着训练天数的增加,各组大鼠平均逃避潜伏期总体呈下降趋势。但各染毒剂量MC-LR组在各个时间点观察到的实验结果与对照组相比差异均无统计学意义(P>0.05)。
2.2 MC-LR对大鼠记忆能力的影响
实验结果见表2。对各组总游程和游速进行比较显示,高剂量MC-LR组在相同时间内的总游程和游速比对照组明显增加(P<0.05)。各染毒剂量MC-LR组穿越平台次数虽然比对照组有所下降,但差异无统计学意义;并且各剂量MC-LR组大鼠在平台象限停留时间和对照组相比并无变化。
2.3 MC-LR暴露3个月后大鼠旷场实验结果
表3结果显示,与对照组相比,高剂量MC-LR组大鼠5 min内在敞箱里的总运动路程和运动行为的持续时间明显增加,差异具有统计学意义(P<0.05)。高剂量MC-LR组大鼠进入中央区域的时间明显减少,在边缘区域的行为增多,与对照组相比差异具有统计 学意义(P<0.05)。
表1 各组大鼠不同时段平均逃避潜伏期比较(±s,n=10)秒Tab 1 The comparison of escape latency of different groups(±s,n=10) s
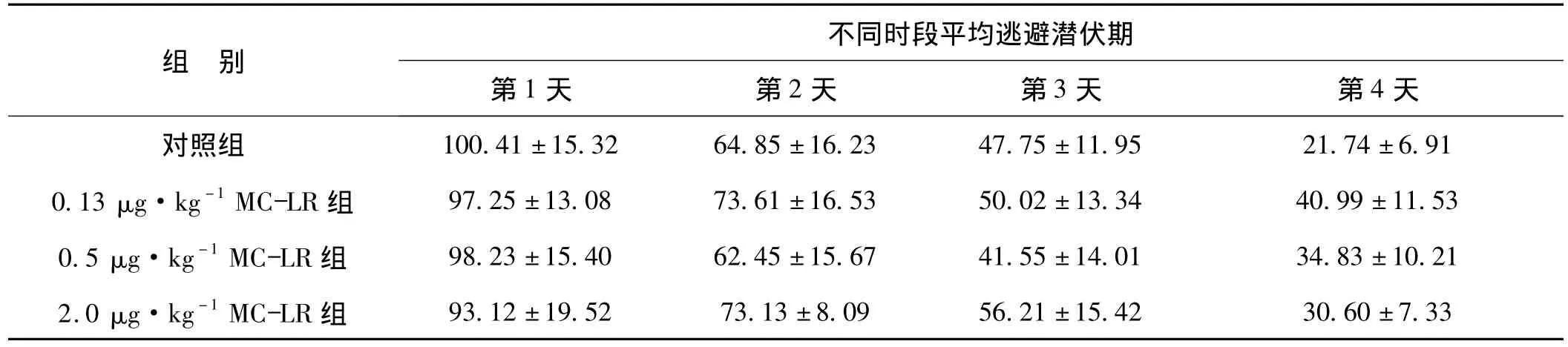
表1 各组大鼠不同时段平均逃避潜伏期比较(±s,n=10)秒Tab 1 The comparison of escape latency of different groups(±s,n=10) s
组 别不同时段平均逃避潜伏期第1天 第2天 第3天 第4天±6.91 0.13 μg·kg-1MC-LR 组 97.25±13.08 73.61±16.53 50.02±13.34 40.99±11.53 0.5 μg·kg-1MC-LR 组 98.23±15.40 62.45±15.67 41.55±14.01 34.83±10.21 2.0 μg·kg-1MC-LR 组 93.12 ±19.52 73.13 ±8.09 56.21 ±15.42 30.60 ±7.33对照组 100.41±15.32 64.85±16.23 47.75±11.95 21.74
表2 各组大鼠空间探索实验指标比较(±s,n=10)Tab 2 The comparison of spatial probe test of different groups(±s,n=10)
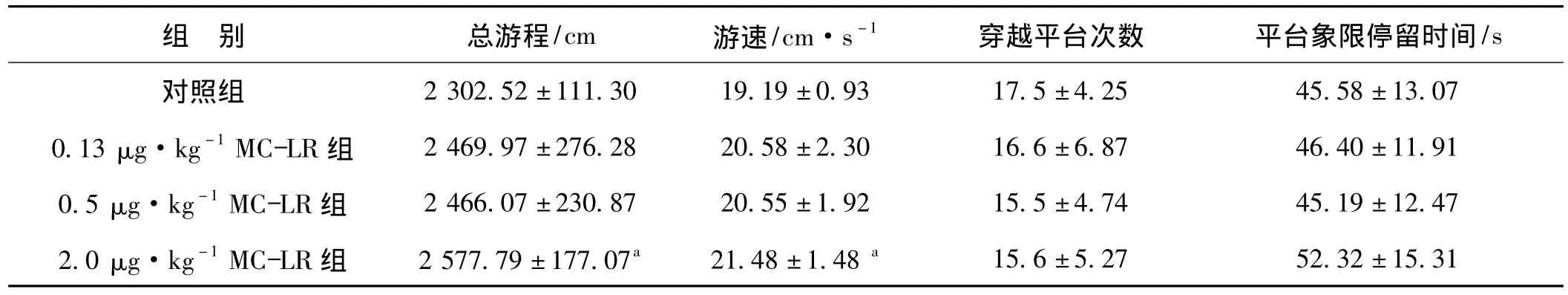
表2 各组大鼠空间探索实验指标比较(±s,n=10)Tab 2 The comparison of spatial probe test of different groups(±s,n=10)
a与对照组比较,P<0.05
组 别 总游程/cm 游速/cm·s-1 穿越平台次数 平台象限停留时间13.07 0.13 μg·kg-1MC-LR 组 2 469.97±276.28 20.58±2.30 16.6±6.87 46.40±11.91 0.5 μg·kg-1MC-LR 组 2 466.07±230.87 20.55±1.92 15.5±4.74 45.19±12.47 2.0 μg·kg-1MC-LR 组 2 577.79 ±177.07a 21.48 ±1.48a/s对照组 2 302.52±111.30 19.19±0.93 17.5±4.25 45.58±15.6±5.27 52.32±15.31
表3 各组大鼠旷场实验指标比较(±s,n=10)Tab 3 The comparison of open field test of different groups(±s,n=10)
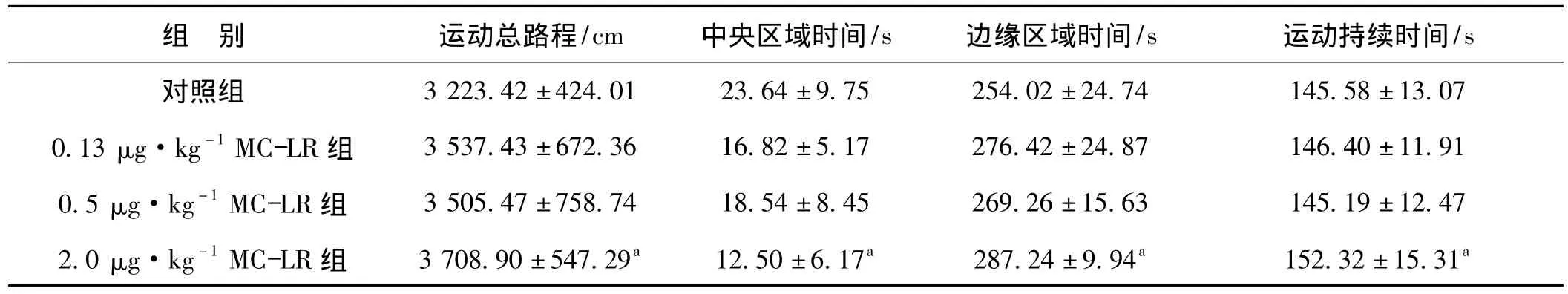
表3 各组大鼠旷场实验指标比较(±s,n=10)Tab 3 The comparison of open field test of different groups(±s,n=10)
a与对照组比较,P<0.05
组 别 运动总路程/cm 中央区域时间/s 边缘区域时间/s 运动持续时间.58±13.07 0.13 μg·kg-1MC-LR 组 3 537.43±672.36 16.82±5.17 276.42±24.87 146.40±11.91 0.5 μg·kg-1MC-LR 组 3 505.47±758.74 18.54±8.45 269.26±15.63 145.19±12.47 2.0 μg·kg-1MC-LR 组 3 708.90±547.29a 12.50±6.17a 287.24±9.94a 152.32±15.31/s对照组 3 223.42±424.01 23.64±9.75 254.02±24.74 145 a
2.4 各组大鼠BBB通透性的变化
对照组和3个剂量MC-LR组大鼠通过BBB的EB含量依次为(2.12± 0.32)、(2.88±0.87)、(3.16±0.63)、(3.40 ±1.10)μg·g-1,显示随着染毒剂量的增加,脑组织EB含量逐步增加,高剂量MC-LR组的EB含量明显高于对照组(P<0.05)。
3 讨 论
研究表明,大鼠经口腔灌注或者腹腔注射MC-LR后在其大脑中发现MC-LR的蓄积[7]。蓝藻提取物定位注射入大鼠脑内,观察到大鼠的空间学习能力有所降低[8];当暴露浓度≥10 μg·L-1时,MC-LR 可以导致秀丽线虫头部摆动频率和身体弯曲频率显著降低[9]。这些研究初步证实了MCs有可能进入大脑造成神经系统的毒性损伤。
神经毒物导致学习记忆等方面的功能障碍,是一个慢性病理过程。定向航行实验所形成的记忆属于陈述性记忆,其储存的机制涉及海马和大脑皮层有关脑区[10]。而丘脑和海马结构则在空间工作记忆中起重要作用。在水迷宫实验中,未观察到MC-LR各剂量组和对照组之间的明显差别,说明MC-LR并未对大鼠的空间学习和记忆能力造成损伤。李晓波等同样采用大鼠灌胃染毒方式,60 d后的水迷宫实验也尚未证明MC-LR对大鼠空间记忆能力产生影响[11]。
旷场实验是用于评价大鼠在新异环境下自发、探究行为与紧张度的一种方法。而对新环境的适应也可判断大鼠认知能力[12]。实验结果显示:MC-LR 20 μg·kg-1剂量组大鼠进入中央区域的时间明显减少,在边缘区域的行为增多,说明大鼠的探索行为受到抑制;大鼠的总运动路程和运动行为的持续时间明显增加。此结果与空间探索实验的结果一致,表明MC-LR可以增加大鼠在进入暗箱以及搜寻平台过程中的紧张度。
BBB由脑内毛细血管的内皮和内皮细胞之间的紧密连接、基膜以及神经胶质细胞突起构成,可以阻止一些具有神经毒性的物质进入脑内。有研究表明,MC-LR可由OATP1A2介导跨越BBB,转运至大脑[5],Feurstein等[13]的研究结果证明至少有5种mOatps参与原代全脑细胞在mRNA水平的表达。最近,Daniel等[14]进一步在小鼠神经元细胞体系中证实了有机阴离子转运肽在MC-LR透过BBB进入脑组织过程中发挥重要作用,但尚无动物实验的证据表明MC-LR可以造成BBB的损伤。EB是小分子指示剂,与血浆蛋白结合后不通过BBB,只有当BBB被破坏、通透性增加时才进入脑组织。本研究采用EB作为示踪剂,结果发现,MC-LR 20 μg·kg-1剂量组脑组织中 EB 含量明显高于对照组,说明MC-LR可以引起BBB通透性的增加,与Cazenave等[15]实验结果的推论相符。
本研究显示,MC-LR增加了大鼠的BBB通透性,并且改变了大鼠的探究行为能力和紧张度,相关的神经损伤机制有待进一步的研究。
[1]ZEGURA B,ZAJC I,LAH T T,et al.Patterns of microcystin-LR induced alteration of the expression of genes involved in response to DNA damage and apoptosis[J].Toxicon,2008,51(4):615-623.
[2]DIETRICH D,HOEGER S.Guidance values for microcystins in water and cyanobacterial supplement products(blue-green algal supplements):a reasonable or misguided approach[J].Toxicol Appl Pharmacol,2005,203:273-289.
[3]NIDHI G,PANT S C,VIJAYARAGHAVAN R,et al.Comparative toxicity evaluation of cyanobacterial peptide toxin microcystin variants(LR,RR,YR)in mice[J].Toxicology,2003,188:285-296.
[4]CARMICHAEL W W,AZEVEDO S M,AN J S,et al.Human fatalities from cyanobacteria:chemical and biological evidence for cyanotoxins[J].Environ Health Persp,2001,109(7):663-668.
[5]FISHER W J,ALTHRIMER S,CATTOR V,et al.Organic anion transporting polypeptides expressed in liver and brain mediate uptake of microcystin[J].Toxicol Appl Pharmacol,2005,203(3):257-263.
[6]BRANDEIS R,BRANDYS R,YEHUDA S.The use of the Morris water maze in the study of memory and learning[J].Neuroscience,1989,48(1-2):29-69.
[7]MERILUO J A,NYGARD S E,DAHLEM A M,et al.Synthesis,Oranotropism and hepocellular uptake of two tritium-labeled epimers of dihydromicrocystin-LR,a cyanobacterial peptide toxin analog[J].Toxicon,1990,28(12):1439-1446.
[8]MAIDANA M,CARLIS V,GALLIS M M.Effects of microcystins over short-and long-term memory and oxidative stress generation in hippocampus of rats[J].Chem Biol Interact,2006,159:223-234.
[9]LI Y H,WANG Y,YIN L H,et al.Using the nematode caenorhabditis elegans as a model animal for assessing the toxicity induced by microystin-LR[J].J Environ Sci,2009,21(3):395-401.
[10]VORHEES C V,WILLIANS M T.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848-858.
[11]李晓波,周珏,刘璐.微囊藻毒素暴露对大鼠旷场行为与认知功能的影响[J].中华行为医学与脑科学杂志,2012,21(2):120-122.
[12]WANG Q,XIE P,CHEN J.Distribution of microcystins in various organs(heart,liver,intestine,gonad,brain,kidney and lung)of Wistar rat via intravenous injection[J].Toxicon,2008,52:721-727.
[13]FEURSTEIN D,HOLST K,FISCHER A,et al.Oatp-associated uptake and toxicity of microcystins in primary murine whole brain cells[J].Toxicol Appl Pharmacol,2009,234:247-255.
[14]DANIEL F,JULIA K,ALEXANDR H H,et al.Investigation of microcystin congener-dependent uptake into primary murine neurons[J].Environ Health Persp,2010,118(10):1370-1374.
[15]CAZENAVE J,WUNDERLIN D A.Uptake,tissue distribution and accumulation of microcystin-RR in Corydoras paleatus,Jenynsia multidentata and Odontesthes bonariensis:a field and laboratory study[J].Aquat Toxicol,2005,75(2):178-190.
