前列腺导管腺癌3例诊治分析
2013-04-18袁利荣阮磊张承广鲁来兴兰建宏沈柏华
袁利荣 阮磊 张承广 鲁来兴 兰建宏 沈柏华
前列腺导管腺癌3例诊治分析
袁利荣 阮磊 张承广 鲁来兴 兰建宏 沈柏华
前列腺导管腺癌(ductal adenocarcinoma of the prostate,DAP)是前列腺癌罕见的亚型,早期常缺乏前列腺质硬结节或血清前列腺特异性抗原(PSA)升高等典型临床表现,故确诊时肿瘤常分期较晚。目前,临床上关于DAP的来源及诊治等仍存在争论。近年来,余杭第二人民医院及浙江大学医学院附属第一医院共收治3例DAP患者,现对其作一回顾性分析,报道如下。
1 临床资料
例1 患者,74岁。因“反复血尿半年,加重伴尿潴留1d”于2009年3月17日在余杭第二人民医院就诊。查体:直肠指检前列腺质韧,中央沟消失,未触及结节,无明显触痛。血清总前列腺特异性抗原(TPSA)4.31μg/ L,血清游离前列腺特异性抗原(FPSA)1.39μg/L,F/T比值0.32。B超检查:前列腺增生,切面大小5.4 cm× 4.3cm×4.8cm,包膜规整,回声欠均。膀胱镜检查:膀胱内血凝块堆积,用冲洗器冲吸后膀胱内未见明显新生物及结石,前列腺两侧叶明显突向尿道,膀胱颈口11点钟处有出血灶。盆腔CT增强扫描:膀胱右前壁增厚,前列腺增生,盆腔未及肿大淋巴结。常规术前准备后在硬膜外麻醉下行经尿道前列腺电切术,术中见膀胱颈口11点钟处前列腺质地不均,似海绵状物,色暗灰。术后病理诊断:DAP,Gleason评分4+4=8,HE染色见图1;免疫组化检查:CK630(部分+),CK14(部分+),p504(-/+),PSA(+)(图2)。术后2周给予内分泌治疗:行双侧睾丸切除术,同时口服抗雄激素比卡鲁胺片50mg,1次/d。前列腺电切术后7d拔除导尿管,排尿通畅,无尿失禁,无肉眼血尿。双侧睾丸切除术后1个月复查血清TPSA为1.10μg/L,后每2个月复查血清TPSA均<0.8μg/L,随访37个月,盆腔CT、X线胸片及B超检查未见局部复发及远处转移。
例2 患者,67岁。因“尿频伴排尿困难1年,加重1月”于2010年1月3日在余杭第二人民医院就诊。血清TPSA 5.46μg/L,血清FPSA 0.62μg/L,F/T比值0.11。查体:直肠指检前列腺增大,大小5.5cm×5.0cm,中央沟消失,左侧叶质地偏硬,未及明显结节。B超检查:双肾无积水,前列腺增生,切面大小约5.2cm×4.6cm×3.9cm。前列腺MRI提示“前列腺左侧叶近尿道一0.6cm× 0.5cm×0.5cm结节灶”。膀胱尿道镜检查:膀胱内未见明显新生物及结石,前列腺左侧叶一大小0.5cm×0.5cm结节突入前列腺尿道。B超引导下行经直肠前列腺穿刺活检术,病理诊断:前列腺腺癌,Gleason评分4+3=7。前列腺穿刺活检术后出现血尿,留置气囊导尿管并牵拉压迫止血。完善术前准备后在全麻下行开放前列腺癌根治术,术后切开前列腺标本,见前列腺左侧叶突入尿道一大小0.5cm×0.5cm病灶,呈灰暗色。术后病理HE染色及免疫组化检查:CK630(+),CK14(部分+),p504(-/+),PSA(+),确诊DAP。术后12d拔除导尿管。术后1个月复查血清TPSA为0.01μg/L,常规每3个月复查血清TPSA均≤0.01μg/L,术后随访28个月,肿瘤无复发。
例3 患者,71岁。因“反复血尿伴尿频半年”于2011年9月7日在浙江大学医学院附属第一医院就诊。血清TPSA 11.50μg/L,血清FPSA 2.72μg/L,F/T比值0.24。查体:直肠指检前列腺增生明显,大小6.0cm× 5.5cm,中央沟消失,左侧叶质地偏硬,未及明显结节。进一步行前列腺MRI检查:前列腺左侧叶一病灶,累及左侧精囊腺。盆腔CT增强扫描:前列腺占位,累及左侧精囊腺,盆腔未及肿大淋巴结。进一步行全身骨骼ECT提示:腰椎骨转移可能。行前列腺穿刺活检,病理诊断:DAP,Gleason评分5+5=10,免疫组化提示:CK630(部分+),CK14(+),p504(+),PSA(+),遂给予患者内分泌治疗:口服比卡鲁胺片50mg,1次/d,2周后加用戈舍瑞林缓释植入剂3.6mg皮下注射,1次/月。在接受内分泌治疗7个月后,因“尿潴留4h”于2012年4月9日在余杭第二人民医院就诊,给予留置导尿失败后局麻下行膀胱造漏。复查血清TPSA 36.40μg/L,血清FPSA 3.57μg/ L。盆腔CT增强扫描:前列腺肿瘤,累及双侧精囊腺及直肠前壁,伴后腹膜及盆腔淋巴结、盆壁多发转移首先考虑,左侧髂骨密度增高,转移可能。全身骨骼ECT提示:全身多处骨转移。在初次诊断8个月后死亡。
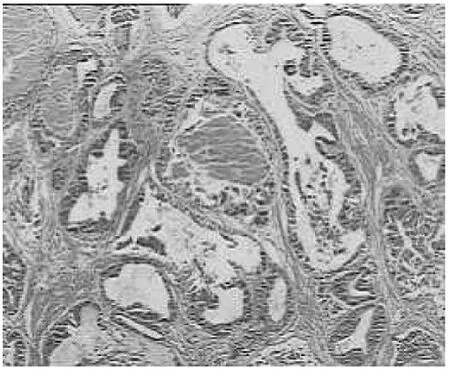
图1 术后病理组织HE染色(见异型增生的前列腺导管,部分导管腔内见粉刺状坏死组织;HE,×40)
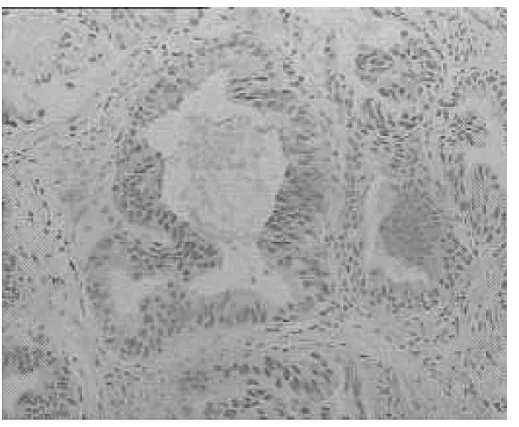
图2 术后免疫组化检查[PSA胞浆(+),证实为前列腺原发导管腺癌,而非膀胱、直肠或其他部位浸润性或转移性导管腺癌;SP法,×100]
2 讨论
DAP是起源于前列腺导管一种恶性肿瘤,最早由Melicow等[1]报道。当肿瘤组织以导管成分为主(占>50%)时,称为导管腺癌;而导管成分<50%时,则为伴有局灶的导管分化的前列腺腺癌。单纯导管腺癌约占全部前列腺恶性肿瘤的1%,与腺泡型前列腺癌混合存在约占5%[2]。主要病理特征为前列腺尿道周围肿物,向外周浸润扩张。
根据起源前列腺导管部位不同,可分为大导管腺癌和次级导管腺癌。肿瘤细胞可浸润前列腺基质形成单一腺体的同时仍保持导管腺癌的细胞学特征。当肿瘤组织不再保持正常前列腺导管形态时,即可诊断为浸润型癌。浸润型癌的常见形式是成筛孔状的腺体背靠背地聚集存在。根据生长方式不同DAP可分为2型[3]:A型为多乳生长,有明显的乳头形成,大体呈息肉状、菜花状,多侵犯前列腺尿道部或中央导管,瘤细胞呈高柱状,上皮呈单层及多层围绕纤维血管轴心,细胞核位于基底部,核仁大而明显,胞质嗜酸性,某些病例核分裂易见;B型为导管内乳头状生长伴有腺样、实性和粉刺癌样结构,肿瘤常位于前列腺深部,在完全或部分裸露的泌尿上皮之下,呈弥漫浸润性大腺泡结构(导管分化)腺癌,瘤细胞形态与A型类似。本组3例病理学形态均属于B型。
DAP好发于60岁以上老年男性患者,排尿梗阻及血尿是最为常见的临床表现,这与肿瘤主要发生在前列腺尿道和尿道周围的前列腺导管内有关。肿瘤体积较小时不易通过直肠指检发现,仅在肿瘤体积足够大甚至侵及前列腺周围组织时指诊才可发现肿瘤结节。另外,前列腺导管较腺泡细胞分泌PSA能力差,癌肿未突破前列腺包膜之前,血清PSA水平鲜有增高,易被临床漏诊。膀胱镜下可见前列腺尿道内灰白色乳头状或息肉状质脆新生物;当直肠指检触及质硬结节和PSA升高等典型临床表现已属晚期,肿瘤更倾向于转移至精囊腺、睾丸、阴茎及肺部[2]。临床上更多是在前列腺穿刺活检、前列腺电切标本或根治性切除的前列腺中发现该病。
DAP需与经典型前列腺腺癌、高级别前列腺上皮内瘤、原发性前列腺移行细胞癌、转移性腺癌等鉴别。除了光镜鉴别外,结合免疫组织检查是提高诊断的有效方法。大量的免疫组化研究发现,几乎所有的DAP细胞对PSA和前列腺特异酸性磷酸酶染色呈强烈的免疫阳性反应。基底细胞消失是诊断经典型前列腺腺癌的重要依据,但免疫组化证实约1/4的导管腺癌导管周围有连续或间断的34βE12、CK5/6、p63阳性基底细胞存在[4],这可能是因为导管腺癌常沿着正常导管或腺泡浸润,取代正常腺上皮,但保留基底细胞层所致。本组3例DAP病理存在前列腺导管壁结构,腺癌以腺样状结构为主,向腔内生长,部分区域存在HCK阳性的基底细胞外围现象,免疫组化染色PSA阳性,CK630、CK14部分阳性。Gleason评分系统同样应用于DAP,由于其独特的形态学特征及临床特性,DAP通常为Gleason4+4[5]。
由于DAP相对预后较差,5年生存率约为30%,当明确诊断时约50%患者已存在远处转移[6],故确诊后治疗应及早积极。其治疗方法包括经尿道前列腺电切术、根治性前列腺切除术、内分泌治疗、放疗及化疗。若患者预期寿命10年以上、未发现远处转移、分级<T3a,可行根治性前列腺切除术。本组例2患者67岁,Gleason评分4+3=7,行前列腺癌根治术,术后随访28个月,肿瘤无复发。Christensen等[7]认为,DAP行根治性前列腺切除术,术后复发率较经典型前列腺腺癌高。Elgamal等[8]认为,预后主要取决于临床分期、肿瘤发生部位及是否合并其他前列腺病变。相对于大导管腺癌和经典型前列腺腺癌,次级导管腺癌的预后较差。不适宜行根治性前列腺切除术的患者如血尿及梗阻症状严重,可采用经尿道前列腺电切术对症治疗。DAP对内分泌治疗较敏感[9]。本组第1例患者因血尿严重导致尿潴留,行经尿道前列腺电切术后血尿得到有效控制,在明确病理诊断后配合内分泌治疗,症状消失,疗效确切。T3以上患者可兼行放疗,Eade等[10]报道,6例DAP患者行前列腺外放射治疗后,PSA下降,局部复发及生存时间延长。故对于切缘阳性或淋巴结转移者,建议术后内分泌治疗同时行局部放疗。对于疾病发展至激素难治性前列腺癌或出现其他器官转移时,推荐使用多西他赛联合强的松全身化疗。综上所述,DAP是前列腺癌形态学上独特的亚型,其发病率低,临床早期诊断困难,确诊需依据细胞形态学特征及免疫组化检查。DAP常诊断延迟,且分级较高、预后较差,一旦确诊应按照高危前列腺癌的治疗原则进行治疗。对不能行根治性前列腺切除术的DAP,内分泌治疗仍为有效治疗方式。由于该病治疗后PSA升高常不明显,因此随访确定是否复发有一定困难。
[1]Samaratunga H,Delahunt B.Ductal adenocarcinoma of the prostate:current opinion and Controversies[J].Anal Quant Cytol Histol,2008,30(4):237-246.
[2]Hertel J D,Humphrey P A.Ductal adenocarcinoma of the prostate [J].J Urol,2011,186(1):277-278.
[3]黄盛松,吴登龙,张惠箴,等.前列腺导管腺癌临床病理和诊治特点分析[J].中华泌尿外科杂志,2009,30(6):382-385.
[4] Herawi M,Epstein J I.Immunohistochemieal antibody cocktail staining (p63/HNWCK/AMACR)of ductal adenocarcinoma and Gleason pattern 4 cribfiform and noneribriform acinar adenocarcinoma of prostate[J].Am J Surg Pathol,2007,31:889-894.
[5]Epstein J I.Prostatic ductal adenocarcinoma:a mini review[J].Med Princ Pract,2010,19(1):82-85.
[6]Tu W H,Jensen K,Freiha F,et al.A case of prostatic adenocarcinoma recurrence presenting as ductal carcinoma of the prostate [J].Nat Clin Pract Urol,2008,5(1):55-58.
[7] Christensen W N,Steinberg G,Walsh P C,et al.Prostatic duct adenocarcinoma.Findings at radical prostatectomy[J].Cancer, 1991,67(8):2118-2124.
[8]Elgamal A A,Van de Voorde W,Van Poppel H,et al.Exophytic papillary prostatic duct Adenocarcinoma with endometrioid features,occurring in prostatic urethra after TURP[J].Urology,1994,43 (5):737-742.
[9] Tu S M,Adriana L,Dan L,et al.Ductal adenocarcinoma of the prostate:clinical features and implications after local therapy[J]. Cancer,2009,115(13):2872-2880.
[10]Eade T N,Al-Saleem T,Horwitz E M,et al.Role of radiotherapy in ductal(endometrioid)carcinoma of the prostate[J].Cancer,2007, 109(10):2011-2115.
2012-05-07)
(本文编辑:欧阳卿)
杭州市科技局项目(20110833B52)
311121 余杭第二人民医院泌尿外科(袁利荣、阮磊、张承广、鲁来兴、兰建宏);浙江大学医学院附属第一医院泌尿外科(沈柏华)
