大别山7个采样地山核桃叶的POD同工酶分析
2013-04-10丁之恩孙潇辉张继刚
薛 波,丁之恩,李 茜,吕 萍,孙潇辉,张继刚,杨 松
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
山核桃Carya cathayensis属胡桃科山核桃属落叶乔木,较为耐阴,喜凉爽湿润气候和深厚肥沃土壤,是我国重要的食用干果和木本油料植物[1]。大别山山核桃主要分布于安徽省金寨县的天堂寨、关庙乡、吴家店、沙河乡、燕子河及霍山县等地方[2]。目前对大别山地区不同品种山核桃的研究,主要集中在其生态学特征方面[3-4]。随着近代育种技术的不断发展,植物研究正向着形态分类、地理分布、解剖学、细胞学、分子遗传学等研究方向发展。同工酶是基因和性状的连接物,具有明显的种属、组织和发育阶段的特异性,既是生理指标,又是可靠的遗传标志。同工酶技术,即采用凝胶电泳方法,将不同的同工酶酶带分离开来,经过染色形成酶带谱,是遗传育种、生长发育、物种起源等研究领域中的一种重要的研究工具,其分析结果也可用作鉴定生物基因型是否有差异的可靠指标[5]。舒英杰、周玉丽等人[6]在比较分析8份不结球芸薹属蔬菜种质的POD、SOD和EST同工酶的基础上对其进行了分类,分类结果与果实性状的分类结果基本一致,说明同工酶法是可利用的。叶庆生、文李等人[7]利用同工酶和SDS-PAGE技术对兰属5个种和2个变种的11个品种进行了分类研究,得出了生化水平与传统形态学的分类结果基本一致的观点。然而,采用同工酶法研究大别山山核桃品种类型的文章还较少。为了给大别山山核桃资源的保护和利用提供理论依据,文中采用聚丙烯酰胺垂直平板凝胶电泳技术,通过POD同工酶分析对大别山山核桃进行了分类鉴定,现将研究结果分析报道如下。
1 材料与方法
1.1 材 料
供试样品为采自于安徽省大别山地区7个不同采样地的不同类型的山核桃鲜叶,其采集地与种类编号详见表1。将新鲜树叶剪下后迅速放入玻璃瓶中,再将玻璃瓶放入装有医用冰袋的保温瓶中,控制低温,然后带回实验室后置于4 ℃的冰箱中短暂保存以备用。

表1 山核桃鲜叶样品的采集地及其种类编号Table 1 The collecting areas and type number of fresh leaves in C. cathayensis
1.2 仪 器
微量(µL)进样器,上海佳安分析仪器公司;高速冷冻离心机,DYCZ-28A型电泳槽,DYY-6C型电泳仪,北京市六一仪器厂;凝胶成像系统,上海欧翔科学仪器有限公司。
1.3 实验方法
酶液制备:分别称取7种不同采样地的山核桃叶样各1 g,置于预先冷却的研钵中,加入5 mL样品提取液(含6 mmol/L的巯基乙醇、5 mmol/L 的EDTA 0.05 mmol/L ,pH值为7.4的Tis-HCL缓冲液),液氮研磨至匀浆。4 ℃条件下以12 000 r/min的转速离心15 min,将其上清液置于-20 ℃的冰箱中储存以备用[8]。
制胶及电泳:制胶所用的分离胶质量分数为7.5%,浓缩胶质量分数为4%。电极缓冲液为Tris-Gly系统(pH值为8.3),指示剂为溴酚蓝,点样量为20 µL,在4 ℃的冰箱中稳压电泳,开始的电压为100 V,当溴酚蓝进入分离胶与浓缩胶界面时,加压到200 V,待溴酚蓝指示剂到达分离胶末端1 cm处时结束电泳[9-11]。
染色:采用醋酸联苯胺染色法[12]。
聚类分析:对POD同工酶酶带进行辨认,利用DPS统计软件多元分析中的0-1程序对数据进行系统聚类分析,采用jaccard聚类距离和类平均法进行聚类分析。
2 结果与分析
2.1 POD同工酶酶谱分析
大别山地区7个采样地的山核桃样叶的POD同工酶扫描图谱如图1所示。由电泳扫描图谱可见,整个酶谱共出现6条酶带,分别以P1、P2、P3、P4、P5、P6表示,其Rf值在0.310~0.550之间变化。酶带P4、P6的Rf值分别为0.380、0.550,这2条酶带在酶谱中出现的位点相同,并且条带清晰,这可能是大别山山核桃的特征谱带。
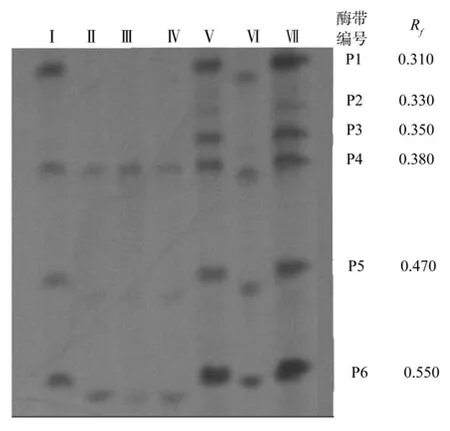
图1 大别山地区7个采样地的山核桃叶片的POD同工酶图谱Fig.1 POD isoenzyme pattern in C. cathayensis leaves from seven sample areas in Dabie Mountain
由图1可知,不同种类山核桃叶间酶带的数量、酶带的强弱和迁移距离都有一定的差异:①酶带数量不同,即Ⅰ号样叶有4条酶带,Ⅱ、Ⅳ号样叶都有3条酶带,Ⅴ、Ⅶ号样叶都有6条酶带,Ⅵ号样叶有5条酶带;②酶带的强弱不同,在P1位点上,Ⅰ、Ⅴ、Ⅶ号样叶的酶带均是强带,而Ⅵ号样叶的酶带却是弱带;在P2位点上,Ⅴ、Ⅶ号样叶的酶带均是弱带;在P3位点上,Ⅴ、Ⅶ号样叶的酶带均是强带;在P4位点上,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅵ号样叶的酶带均是弱带,而Ⅴ、Ⅶ号的酶带均是强带;在P5位点上,Ⅰ、Ⅱ、Ⅳ、Ⅵ号样叶的酶带均是弱带,而Ⅴ、Ⅶ号的酶带均为强带;在P6位点上,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅵ号样叶的酶带均为弱带,而Ⅴ、Ⅶ号的酶带均是强带;③酶带的特征性不同,在P1位点上,Ⅰ、Ⅴ、Ⅵ、Ⅶ号样叶均有酶带,而Ⅱ、Ⅲ、Ⅳ号样叶均无酶带;在P2和P3位点上,Ⅴ、Ⅶ号样叶均有酶带,而其他样叶均无酶带。
2.2 聚类分析
对大别山地区7个采样地的山核桃叶片的POD同工酶酶带的辨认结果见表2,表2 中分别用1和0记录条带的有与无,形成1/0矩阵,再应用DPS进行聚类分析,结果如图2所示。根据聚类分析结果可以明确如下两点:亲缘关系越近的种类,其遗传距离越接近0;而亲缘关系越远的种类,则遗传距离越接近1。从图2中可以看出,在遗传距离为0.4时,可将大别山地区7个采样地的山核桃分为5类:第1类为霍山县的山核桃品种;第2类为水竹坪和燕子河的山核桃品种;第3类为天堂寨和关庙乡的山核桃品种;第4类为吴家店的山核桃品种;第5类为沙河乡的山核桃品种。当遗传距离为0.6时,又可将其分为3类:第1类即霍山县、水竹坪和燕子河的山核桃品种;第2类即天堂寨、关庙乡和吴家店的山核桃品种;第3类即沙河乡的山核桃品种。

表2 大别山地区7个采样地的山核桃叶片的POD同工酶酶带Table 2 POD isoenzyme bands in C. cathayensis leaves from seven sample areas in Dabie Mountain
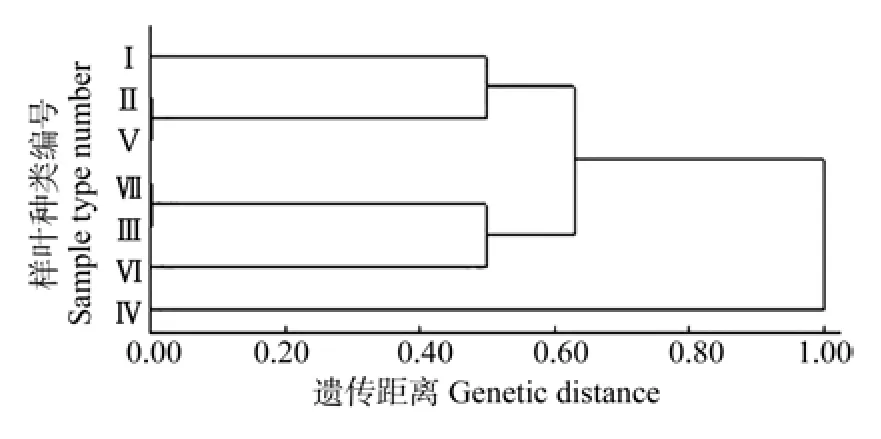
图2 大别山地区7个采样地的山核桃聚类树形图Fig.2 Cluster dendrogram of C. cathayensis from seven sample areas in Dabie Mountain
3 结论与讨论
对大别山地区7个采样地的山核桃叶片的过氧化物同工酶酶谱进行了分析,结果总共分离出28条酶带,不同采样地的山核桃叶片同工酶酶带数各为2~6条,迁移率Rf值在0.310~0.470之间变化。酶带P5、P6均为大别山山核桃的特征谱带。
聚类分析结果显示,分类标准不同对大别山地区7 个采样地的山核桃品种的分类结果则不同。分析中发现,当遗传距离为0.4时,可以将7 个采样地的山核桃品种分为5类;当遗传距离为0.6时,可以分为3 类。综合两种分类结果来看,霍山县、水竹坪和燕子河这3个采样地的山核桃品种的亲缘关系较近,天堂寨、关庙乡和吴家店3个采样地的山核桃品种的亲缘关系也很近,只有沙河乡与其他采样地的山核桃的亲缘关系较远。
同时,同工酶表现型变化较大,因为同工酶不可能在一个组织或一个种中稳定不变地表达,而要受到植物的阶段发育和系统发育的影响,从而使酶谱表现出假多型性。因此,在分析同工酶谱时,要注意植物的不同发育阶段,从而找出重演性好的酶谱带,特别是特征谱带。因此,要尽可能增加试验的重复次数,这样的试验才具有科学性。另外,酶谱分析作为一种表现除代表遗传背景外,还受生理、人为等因素的干扰,所以,只有将酶谱分析方法与形态学、细胞学等其他方法结合起来进行分析,才能更准确地揭示不同品种间的亲缘关系[14]。
参考文献:
[1]肖 斌,周根土.加快大别山山核桃发展的途径[J].经济林研究,2006,24(3):80-82.
[2]陈素传,肖 斌,肖东正.大别山山核桃调查初报[J].落叶果树,2008,(2):36-37.
[3]郭传友,黄坚钦,方炎明.山核桃研究综述及展望[J].经济林研究,2004,22(1):30-34.
[4]傅松玲,丁之恩,周根土,等.安徽山核桃适生条件及丰产栽培研究[J].经济林研究,2003,21(2):1-4.
[5]徐迎碧,周先锋,殷彪等.4种不同石榴品种同工酶分析[J].护林科技,2006,71(2):17-19.
[6]舒英杰,周玉丽,赵晓雪等.8份不结球芸薹属蔬菜种质的POD、SOD和EST同工酶比较分析[J].种子,2011,30(10):25-28.
[7]叶庆生,文 李,潘瑞炽.利用同工酶和SDS-PAGE技术对一些兰属品种的分析[J].热带亚热带植物学报,1999,7(4):337-341.
[8]李学强,李秀珍,王祥.5种樱桃属植物的POD、CAT和SOD同工酶分析[J].生物学通报,2010,45(2):46-49.
[9]胡能书,万贤国.同工酶技术及其应用[M].长沙:湖南科学技术出版社,1985:171-180.
[10]何忠效,张树政.电泳[M].第2版.北京:科学出版社,1999:286-287.
[11]郭薏君.蛋白质电泳实验技术[M].北京:科学出版社,1999.
[12]于家政,范 明.蛋向质技术手册[M].北京:科学出版社, 2000.
