ABA及其合成抑制剂对喜树幼苗喜树碱及抗氧化酶的影响
2013-04-10武应霞毕会涛李继东胡春瑞冯建灿
武应霞,毕会涛,李继东,胡春瑞,冯建灿
(1.河南农业大学,河南 郑州 450002;2.河南职业技术学院,河南 郑州 450046)
喜树Camptotheca accuminata是我国原产树种,因能生产具有抗肿瘤活性的喜树碱而受到关注。喜树碱是次生代谢的产物,已完成的研究发现,正常条件下喜树碱在喜树中的含量很低,在水分胁迫条件下喜树幼苗叶片的喜树碱含量明显升高[1],同时其它环境因子对喜树幼苗中喜树碱含量的影响也得到了关注,如水渍和遮荫[2]、光强[3]、增施氮磷钾复合肥[4-5]。激素类物质在调节植物初生长和发育的同时,对植物的次生代谢也有着重要的影响。如在黑莨菪转化根培养中NAA对根的生长没有影响,但是与没有添加生长素的对照相比,生物碱的积累提高了1倍,即外源生长素不影响生长,但是可以增加生物碱的含量[6]。相反,在长春花的细胞悬浮培养中,去除2,4-D则可以增加喜树碱的含量[7]。BA和水杨酸可以增加水培条件下喜树中喜树碱的含量,但由于生物量的降低,并没有提高喜树碱的总产量;NAA对喜树碱的含量没有影响,但是能降低喜树碱的产量[8-9]。而茉莉酸甲酯和乙烯利也能在一定程度上增强喜树碱的合成,而且因为诱导子含量不同而表现出一定的差异[10]。然而关于ABA对喜树碱积累的影响的研究尚未见报道。
在对喜树在水分胁迫下内源ABA含量和喜树碱含量的变化的研究中[11],发现在胁迫下二者均随着胁迫强度的增大和时间的延长而增高。然而,在水分胁迫下喜树中ABA与喜树碱含量变化之间是否存在某种关联尚未可知。如果二者存在一定的联系,那么就可以利用ABA来诱导和促进喜树碱的合成,从而得到满足需要的喜树碱提取材料。
因此,本试验中利用高分子渗透调节剂聚乙二醇(polyethylene,PEG)模拟干旱胁迫处理喜树幼苗,使用ABA和ABA合成抑制剂氟啶酮(Fluridone)预处理喜树幼苗,研究在此条件下喜树幼苗内ABA含量、喜树碱含量及抗氧化酶活性的变化,以探讨ABA在喜树碱生物合成中所起的作用,以及ABA对抗氧化酶的诱导作用,旨在为喜树碱的化学调控提供理论依据。
1 材料与方法
1.1 材 料
试验采用4周龄喜树实生幼苗为试验材料。
喜树种子采于河南省桐柏县。挑选饱满种子,用0.1%HgCl2消毒20 min,冷水浸种24 h,后与湿沙1∶1混合催芽,15 d后将种子与沙分离,把种子放在1个带盖容器内再催芽。再过10 d,选取健壮幼苗定植到16 cm×22 cm塑料周转箱内,用泡沫板和脱脂棉固定,加入100 mL 1/2Hoagland营养液,每2 d换1次营养液。放入LRH-250-GSⅡ微电脑控制人工气候箱中培养,光照时间为8:00~22:00,湿度70%,温度25 ℃,每天早晚各通气10 min。
1.2 方 法
1.2.1 试验设计
试验中共设置4个处理:
(1)1/2 Hoagland营养液培养(CK);
(2)1/2 Hoagland营养液中加入15% PEG 6000 处理(PEG);
(3)1/2 Hoagland营养液中加入15%PEG 6000处理+10 µmol·L-1ABA处理(PEG+ABA);
(4)10 mmol·L-1氟啶酮营养液预处理24 h后再以15%PEG6000处理(PEG+氟啶酮)。
每个处理重复3次。在处理开始0、12、24、36、48、60 h时分别取幼苗全株,分别用于超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性的分析。在60 h时取幼苗全株5 g左右用于喜树碱(CPT)含量测定。在处理开始0、24、36、60 h时取幼苗全株1 g左右用于脱落酸(ABA)含量测定。
1.2.2 指标测定
超氧化物歧化酶(SOD)活性的测定采用 NBT光照化学还原法[12];过氧化物酶(POD)活性的测定采用愈伤木酚氧化法[13];过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定[13];喜树碱含量的测定采用高效液相色谱法(HPLC法);脱落酸(ABA)含量的测定采用酶联免疫法(ELISA法)。
1.3 数据分析
所有数据使用SPSS软件进行分析处理。
2 结果与分析
2.1 对喜树幼苗过氧化物酶(POD)活性的影响
POD 在植物体内具有广泛的作用,其主要作用之一是催化H2O2降解。各处理中喜树幼苗内POD活性均呈现先上升后下降的趋势(见图1)。在PEG处理中,POD活性在12 h时达到最大值106.8 U·g-1min-1,较同期对照值高61.08%,在60 h时下降到77.5 U·g-1min-1,较对照高21.85%。在PEG+ABA处理中,POD活性在12 h时达到最大值117.7 U·g-1min-1,较对照高77.53%,较PEG处理下最大值高10.21%,在60 h时下降到90.0 U·g-1min-1,较对照高41.51%。在PEG+氟啶酮处理中,POD活性在24 h时达到最大值87.3 U·g-1min-1,较对照高37.48%,较PEG处理下最大值低22.34%,到60 h时下降到72.4 U·g-1min-1,较对照高13.84%。外源ABA可以提高POD活性[14],而ABA抑制剂使POD活性降低。
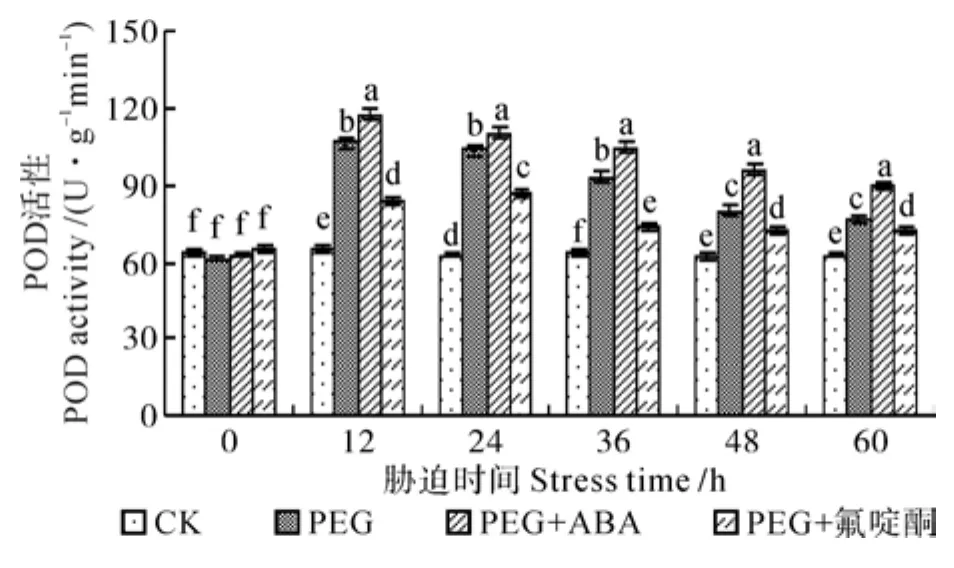
图1 渗透胁迫对喜树幼苗过氧化物酶(POD)活性的影响Fig.1 Effect of osmotic stress on POD activity in Camptotheca acuminata seedlings
2.2 对喜树幼苗超氧化物歧化酶活性(SOD)的影响
SOD的主要功能是清除氧自由基,是防止其对细胞膜系统伤害的一种很重要的抗氧化酶。各处理导致喜树幼苗内SOD活性下降(见图2)。在PEG处理中,SOD活性在12 h时已经下降到32.7 U·mg-1,比对照低35.78%,随后下降速度减缓,至60 h时SOD活性小幅上升,为29.8 U·mg-1,仍比对照低52.01%。在PEG+ABA处理中,SOD活性呈下降趋势,但下降幅度比PEG处理小,60 h时,SOD活性值为31.7 U·mg-1,较对照低42.90%,较PEG处理值高6.38%。在PEG+氟啶酮处理中,SOD活性缓慢下降,12 h时比对照低14.41%,较PEG处理高16.21%,60 h时SOD活性略有上升。在渗透胁迫下,喜树幼苗SOD活性不断下降,在ABA被抑制后,喜树幼苗内SOD活性高于单纯渗透胁迫下的水平,这说明ABA抑制剂的使用降低了SOD活性[15],说明ABA与植物抗氧化酶活性有直接关系。
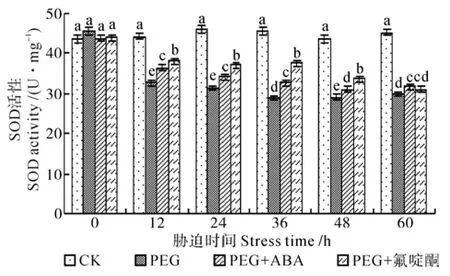
图2 渗透胁迫对喜树幼苗超氧化物歧化酶(SOD)活性的影响Fig.2 Effect of osmotic stress on SOD activity in Camptotheca acuminata seedlings
2.3 对喜树幼苗内过氧化氢酶(CAT)活性的影响
CAT可把H2O2分解为H2O和O2,以清除H2O2的毒害作用。现在普遍认为植物受到环境胁迫后,保护酶活性下降。
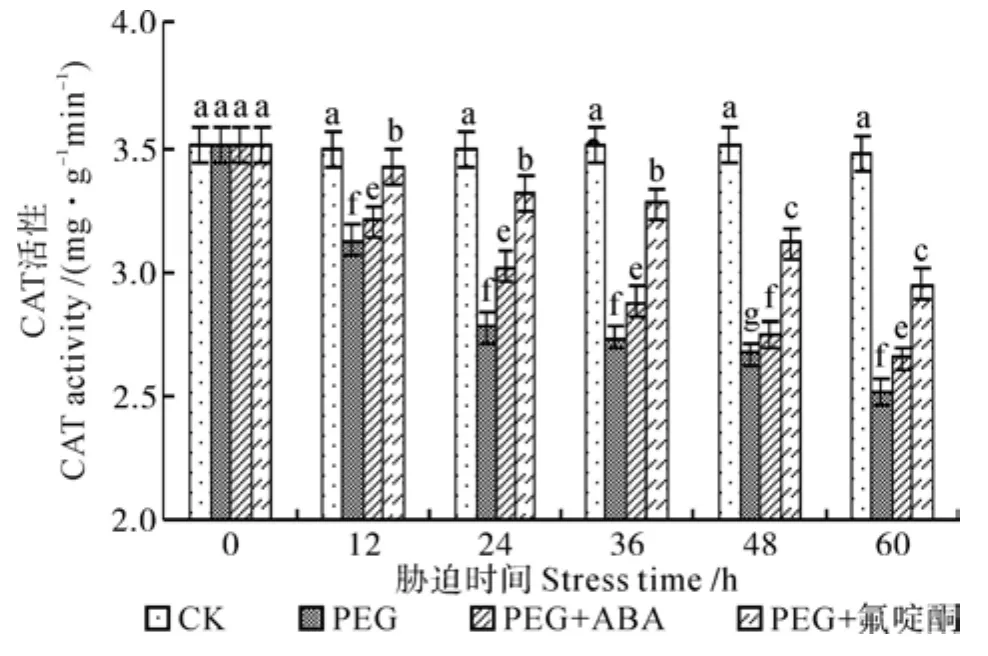
图3 渗透胁迫对喜树幼苗内过氧化氢酶(CAT)活性的影响Fig.3 Effect of osmotic stress on CAT activity in Camptotheca acuminata seedlings
各处理中喜树幼苗内CAT活性均降低(见图3)。在PEG处理中,60 h时CAT降到最小值2.512 mg·g-1min-1,比对照低38.41%;在PEG+ABA处理中,CAT活性在60 h时达到最小值2.645 mg·g-1min-1,较对照低31.46%,较PEG处理下最小值高5.29%;在PEG+氟啶酮处理中,CAT最小值2.953 mg·g-1min-1,比对照低17.74%,比PEG高17.56%。CAT活性在渗透胁迫下一直下降,ABA抑制剂可以抑制CAT活性下降。
2.4 对喜树幼苗内脱落酸(ABA)含量的影响
逆境条件可刺激ABA合成,尤其是干旱胁迫时更为显著[16]。渗透胁迫下各处理ABA含量均高于对照(见图4)。PEG处理使喜树幼苗内ABA含量大幅度上升,在12 h时,达到最大值1 832 ng·g-1,比对照高144.84%;在PEG+ABA处理中,ABA的含量在12 h已经上升到1 940 ng·g-1,在36 h时达到最大值2 319 ng·g-1,是对照的233.67%,比PEG处理同期高75.42%。在PEG+氟啶酮处理中,ABA的含量在12 h最高,比对照最大值高52.45%,较PEG处理的最大值低63.28%,较PEG+ABA处理最大值低106.68%。
2.5 对喜树幼苗内喜树碱(CPT)含量的影响
各处理的喜树碱含量变化不同(见图5)。PEG处理的喜树幼苗内喜树碱含量为0.120 9%,比对照高6.61%;在PEG+ABA处理中,喜树碱含量为0.114 4 %,略高于对照,但低于PEG处理;在PEG+氟啶酮处理中,低于其它各处理,ABA抑制剂降低了喜树碱的含量,这说明ABA对喜树碱的合成存在一定的诱导作用。

图4 渗透胁迫对喜树幼苗内脱落酸含量的影响Fig.4 Effect of osmotic stress on ABA content in Camptotheca acuminata seedlings

图5 渗透胁迫对喜树幼苗内喜树碱含量的影响Fig.5 Effect of osmotic stress on CPT content in Camptotheca acuminata seedlings
3 结论与讨论
渗透胁迫下喜树幼苗的各项抗氧化酶变化趋势与其它植物相似[17-19],渗透胁迫提高了保护性酶SOD、POD和CAT的活性,提高其抗旱性。
外源ABA及其合成抑制剂对渗透胁迫下喜树幼苗的各项指标有较大的影响。渗透胁迫下施用外源ABA致使喜树幼苗内ABA含量剧烈上升,减少了渗透调节物质的积累,减弱了渗透胁迫导致的抗氧化酶类活性的变化,减轻了渗透胁迫的作用效果。使用抑制剂氟啶酮抑制渗透胁迫下喜树幼苗内ABA生物合成后,可以降低抗氧化酶类活性的剧烈变化、减少内源ABA的积累、减少喜树碱因为渗透胁迫引起的积累。因此,ABA可以调控喜树幼苗内渗透调节物质的积累和抗氧化酶类活性变化,可以诱导喜树碱的生物合成。但是,ABA对喜树碱的生物合成具有促进作用的含量阈值范围以及ABA对喜树碱生物合成过程中关键酶的影响还需要进一步的研究。
参考文献:
[1]冯建灿,张玉洁,张秋娟. 干旱胁迫与抗蒸腾剂对喜树几项生理指标及喜树碱含量的影响[J].河南农业大学学报,2002,36(2): 138-142.
[2]Liu ZJ, Carpenter SB. Camptothecin production inCamptothecaacuminataseedlings in response to shading and ooding[J]. Can J Bot, 1997,75(2):368-373.
[3]王 洋,戴绍军,阎秀峰. 光强对喜树幼苗叶片次生代谢产物喜树碱的影响[J].生态学报,2004,24(6):1118-1122.
[4]Liu ZJ, Adams JC, Viator HP. Influence of soil fertilization,plant spacing, and coppicing on growth, stomatal conductance,abscisic acid, and camptothecin levels inCamptotheca acuminataseedlings[J]. Physiologia Plantarum, 1999,105:402-408.
[5]Li ZH, Liu ZJ. Camptothecin production inCamptotheca acuminatahydroponic culture and nitrogen enrichments[J].Canada J Plant Sci,2005,85:447-452.
[6]Vanhala L, Eava M, Lapinjoki S,et al. Effects of growth regulators on transformed root cultures ofHyoscyamus muticus[J]. J Plant Physiol,1998,153:475-481.
[7]Arvy MP, Imbault N, Naudascher F,et al.2,4-D and alkaloid accumulation in perivinkle cell suspensions[J]. Biochimie-Paris,1994, 76:410-416.
[8]Li ZH, Liu ZJ. Effects of Benzyladenine and Naphthalene acetic acid on growth and camptothecin accumulation inCamptotheca acuminataseedlings[J]. J Plant Growth Regul, 2003,22:205-216.
[9]Li ZH, Liu ZJ. Camptothecin production inCamptotheca acuminataseedlings in response to Acetylsalicylic Acid treatment[J]. Canada J Plant Sci, 2004,84:885-889.
[10]牧 文,刘文哲. 伤害及诱导子对喜树幼苗中喜树碱含量的影响[J]. 西北植物学报, 2007,27(5):0977-0982.
[11]武应霞,李继东,毕会涛,等. 外源ABA对渗透胁迫下喜树幼苗生理生化指标的影响[J].经济林研究,2011,28(2):35-41.
[12]Dhindsa R S, Plumb 2 Dhindsa P, Thorpe T A. Leaf senescence:Correlated with increased leaves of membrane permeability and lipid peroxidation and decreased levels of superoxide dismutase and catalase[J]. Exp Bot, 1981,32:93-101.
[13]李合生,孙 群,赵世杰,等. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2001.
[14]邢更生,周功克,李志孝. 水分胁迫下山黧豆中ABA 及ODAP 的积累研究[J].应用生态学报,2000,11(5):693-698.
[15]周碧燕,郭振飞. ABA及其合成抑制剂对柱花草抗冷性及抗氧化酶活性的影响[J].草业科学,2005,14(6):94-99.
[16]Giraudat J, Parcy F, Bertauche N,et al. Current advances in abscisic acid action and signalling[J]. Plant Mol Biol, 1994,26(5): 1557-1577.
[17]吴丽君,李志辉,邹 峰.水分胁迫对珍贵树种赤皮青冈幼苗生理特性的影响[J].南林业科技大学学报,2012,32(7):10-13.
[18]夏清柱,万 红,刘惠民,等.人工低温胁迫下腰果叶片生理生化指标的变化[J].经济林研究,2012, 30(2):28-32.
[19]梁文斌,蒋丽娟,马 倩,等.干旱胁迫下光皮树不同无性系苗木的生理生化变化[J].中南林业科技大学学报,2011,31(4):13-19.
