入侵植物空心莲子草对生菜和萝卜的化感效应
2013-04-10张志忠石秋香孙志浩蓝茂锋
张志忠,石秋香,孙志浩,蓝茂锋
(福建农林大学园艺学院,福建 福州350002)
空心莲子草(Alternantheraphiloxeroides),苋科莲子草属,原产南美,现已蔓延成为一种世界性的恶性杂草,适应广泛,在杂草的生存竞争中占有绝对的优势[1],入侵后对局部生态系统造成不可逆转的破坏,严重影响农业生产[2],2003年被列入国家环保总局公布的“中国第一批外来入侵生物名单”中[3]。入侵杂草会对当地的生物多样性造成严重影响,破坏原有平衡,加之大多防除困难,严重威胁农业生产。Callaway和Aschehoug[4]认为,化感作用是外来杂草成功入侵的“化学武器”,并提出“化学武器”假说。目前化感作用研究已成为应对外来植物入侵的一个重要领域[5-7],相关研究广泛的涉及到对植物的生长,呼吸、光合作用,酶的活性,水分及矿物质元素代谢等多方面的影响。但由于化感物质来源广泛,在植物中含量极微,收集和结构鉴定难度大,加之其分泌和作用过程受到外界环境影响较大,关于化感作用的机理研究还不充分。
目前国内外对空心莲子草的研究主要集中在生物学特征、对周边环境的表观影响和防除技术3个方面[8-11],关于其化感作用的研究还处于起步阶段,且大多集中在对水稻(Oryzasativa)等大田作物的影响方面。一般认为空心莲子草会降低水稻种子发芽率,显著影响水稻产量[12,13];但也有研究表明其对水稻的最终发芽率没有影响,空心莲子草释放的化感物质影响了水稻的保护酶系统[14],以蚕豆(Viciafaba)和玉米(Zeamays)为材料的研究也得出了类似的结论[15]。这些研究结果说明空心莲子草对其他植物的化感表现较复杂,其化感机理有待于进一步研究。本研究以2种化感作用研究中常用的敏感模式蔬菜类型萝卜(Raphanussativus)和生菜(Lactuca sativa)作为受体[16,17],通过测定空心莲子草水浸提液对二者种子萌发、幼苗生长和体内保护酶系统及 MDA含量的变化,探讨空心莲子草对受体植物的化感效应及其生理机制。
1 材料与方法
1.1 实验材料
空心莲子草(Alternantheraphiloxeroides)采自福建农林大学植物园,萝卜和生菜种子购于福建省种子公司。
1.2 实验方法
1.2.1 空心莲子草植株水浸提液的制备 实验于2011年3-8月在福建农林大学园艺学院基础实验室进行,将采集到的新鲜空心莲子草洗净剪成小段,置于黑暗的烘箱(60℃)中烘干、研磨。在室温的条件下,称取4g样品,加入100mL蒸馏水充分振荡浸提48h,双层纱布过滤1次后,用双层滤纸过滤2次,再用0.2μm孔径47mm直径的微孔滤膜(Supor-200)过滤,无菌双蒸水定容,制得浓度为0.04g/mL的浸提液母液。用灭菌蒸馏水依次稀释出0.01,0.02,0.03,0.04g/mL的浓度配比,灭菌蒸馏水作为对照。使用前取出室温放置一段时间,使其自然冷却至室温,以免骤冷对蔬菜种子、幼苗造成伤害。
1.2.2 萝卜和生菜的种子处理 挑选均匀、饱满的萝卜和生菜种子,先用10%H2O2对种子消毒,无菌蒸馏水冲洗后分别播种于垫有2层定性滤纸的培养皿(90mm)中,播种密度为30粒/皿,每培养皿加不同浓度浸提液4 mL,用无菌蒸馏水处理作对照,滤纸和培养皿均做无菌处理。培养皿用保鲜膜包好,防止水分蒸发和污染,在室温条件下暗培养发芽,每隔24h观察1次,3d更换1次新鲜浸提液和滤纸,以连续5d不再有新种子发芽作为实验结束的标记,计算最终发芽率(发芽种子数目/播种种子总数)。实验重复3次。
1.2.3 幼苗生长情况和保护酶系统相关指标测定 将萝卜和生菜种子25℃催芽至刚露白后每个培养皿放30粒,加入上述各浓度水浸液4mL,用无菌蒸馏水处理作对照,进行培养。培养条件为温度25℃(昼)/18℃(夜),湿度80%,光照6 000lx。每24h观察幼苗生长状况,7d后取样,用于幼苗胚轴长度、胚根长度和植株鲜重的测定。幼苗胚轴长度和胚根长度采用直尺测定,植株鲜重采用电子天平直接称重。利用无菌蒸馏水培养获得3d苗龄的萝卜和生菜幼苗,采用上述同样处理方法和培养条件,3d后用于保护酶活性相关指标测定。过氧化物酶(POD)活性测定采用愈创木酚比色法、超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法、过氧化氢酶(CAT)活性测定采用碘量滴定法、丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[18]。实验重复3次。
1.3 数据处理与分析
化感效应指数按照 Willamson和Richardson[19]的方法计算,当T≥C时,RI=1-C/T;当T<C时,RI=C/T-1。式中,C为对照值,T为处理值,RI为化感效应指数。RI>0时为促进作用,RI<0时为抑制作用,其绝对值大小反映化感作用的强弱。数据统计分析采用SPSS 16.1软件完成。
2 结果与分析
2.1 空心莲子草植株水浸提液对萝卜和生菜种子萌发的影响
空心莲子草植株水浸提液对萝卜和生菜种子的发芽率均产生抑制,随着处理浓度的增加,这种抑制作用逐步增强。高浓度浸提液处理严重抑制了种子萌发,即使能够萌发也很快腐烂或坏死(图1)。总体而言,空心莲子草植株水浸提液对生菜的化感效应强于萝卜,当浓度为0.04g/mL时,二者的化感效应指数分别为-0.429和-0.767。
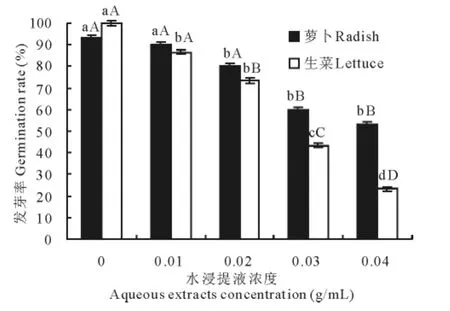
图1 不同浓度空心莲子草植株水浸提液处理下的萝卜和生菜种子发芽率Fig.1 The germination rate of radish and lettuce seed treated with different concentration of aqueous extracts fromA.philoxeroides
2.2 空心莲子草植株水浸提液对萝卜和生菜幼苗生长的影响
不同浓度空心莲子草植株水浸提液对萝卜和生菜幼苗的生长总体上表现为抑制作用,相对而言对幼苗根系的抑制作用要明显大于对地上部的抑制作用,其中对胚根长度和植株鲜重2个指标表现为持续性抑制,随着处理浓度的升高对胚根长度和植株鲜重抑制作用逐步增强(图2)。当浸提液浓度达到0.04g/mL时,根系的生长几乎停滞,此时对萝卜和生菜根系生长的化感指数分别为-0.926和-0.806;对植株鲜重而言,生菜所受到的抑制作用较萝卜严重,二者的化感指数分别为-0.452和-0.161。低浓度(0.01g/mL)浸提液对胚轴的生长表现出促进作用,随浓度升高,对生菜而言当浓度超过0.01g/mL后这种促进作用逐步减弱,达到0.03g/mL时已表现为抑制;但在萝卜中没有表现类似的规律性。当浓度达到0.04g/mL时,萝卜和生菜的胚轴生长均被抑制,其化感指数分别为-0.184和-0.182。
2.3 空心莲子草植株水浸提液对萝卜和生菜幼苗保护酶活性的影响
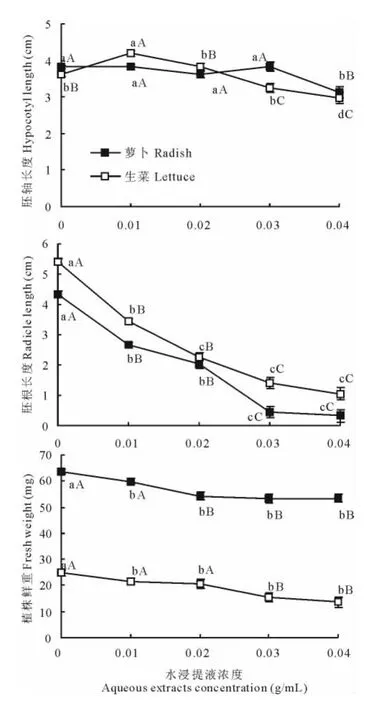
图2 不同浓度空心莲子草植株水浸提液处理下的萝卜和生菜幼苗生长相关指标Fig.2 The growth indexes of radish and lettuce seedlings treated with different concentration of aqueous extracts fromA.philoxeroides
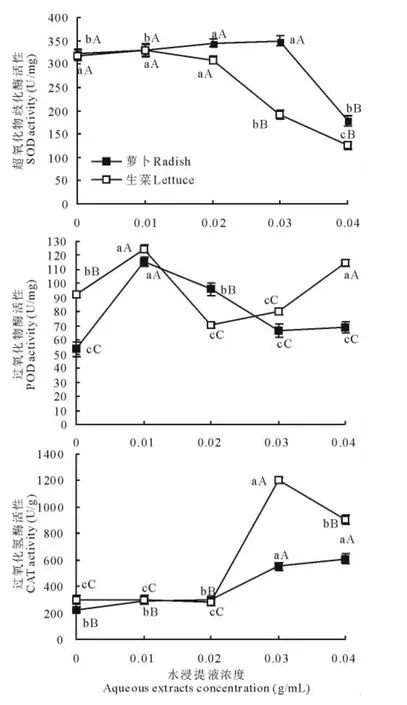
图3 不同浓度空心莲子草植株水浸提液处理下的萝卜和生菜幼苗的保护酶活性Fig.3 The protective enzyme activity of radish and lettuce seedlings treated with different concentration of aqueous extracts fromA.philoxeroides
空心莲子草植株水浸提液对萝卜和生菜幼苗各种保护酶活性的影响表现出不同的变化规律(图3)。对SOD活性而言浸提液处理对生菜的影响较明显,尤其是在0.03g/mL浓度处理下其幼苗体内的SOD活性显著下降,较对照低44.5%。对萝卜而言SOD活性最初呈上升趋势,在浓度达到0.03g/mL时出现峰值,开始下降。空心莲子草浸提液处理对POD活性的影响较为复杂,大致表现出升-降-升的规律,生菜POD活性的变化更为剧烈一些,二者均在0.01g/mL浓度处理时达到峰值,此后活性下降;当浓度进一步增加时,活性又开始上升,浓度达到0.04g/mL时萝卜的POD活性略高于对照,生菜的仍显著高于对照。低浓度(≤0.02g/mL)的空心莲子草浸提液处理对CAT活性的影响不明显,当浓度达到0.03g/mL时,萝卜和生菜的CAT活性均出现了显著上升,生菜的涨幅高达387.85%;处理浓度继续提高后萝卜体内的CAT活性继续缓慢上升,而生菜的CAT活性则显著下降,但二者的CAT活性仍显著高于对照。
2.4 空心莲子草植株水浸提液对萝卜和生菜幼苗丙二醛(MDA)含量的影响
萝卜和生菜幼苗的MDA含量均随空心莲子草植株水浸提液浓度增加而升高,其中萝卜的增幅略大于生菜,但在处理浓度为0.01~0.03g/mL,二者的MDA含量的增加均不显著(图4)。当浸提液浓度为0.04g/mL时,与对照组相比,萝卜的丙二醛含量增加了116.67%,生菜为98%。其化感指数分别为0.538和0.495。
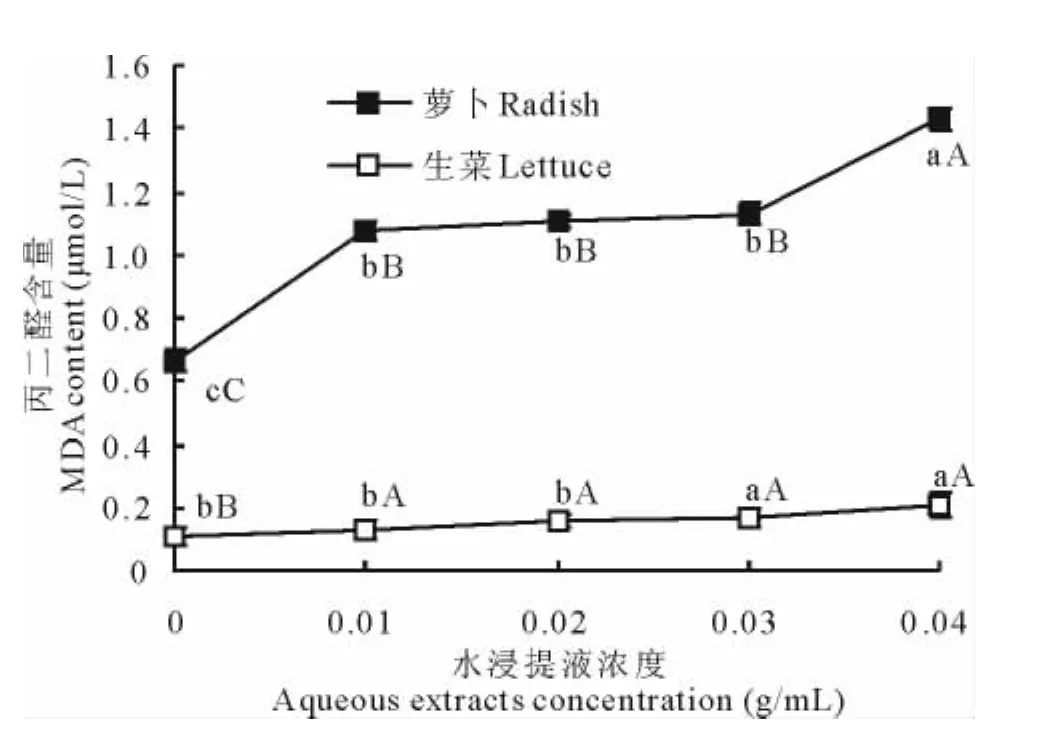
图4 不同浓度空心莲子草植株水浸提液处理下的萝卜和生菜幼苗的MDA含量Fig.4 The MDA content of radish and lettuce seedlings treated with different concentration of aqueous extracts fromA.philoxeroides
3 讨论
空心莲子草植株水浸提液对萝卜和生菜种子的发芽率均产生抑制,随着处理浓度的增加,这种抑制作用逐步增强,相对而言对幼苗根系的抑制作用要明显大于对地上部的抑制作用,这和张远兵等[13]在水稻中的研究结果一致。幼苗根系最先受到空心莲子草植株水浸提液的影响,生长受到抑制,进而影响其吸收功能,不能给幼苗提供足够养分和水分,最终对地上部的生长产生抑制。空心莲子草通过抑制其他植物种子发芽和幼苗生长,有利于入侵植物对周边空间的占领,可能是其得以迅速蔓延的原因之一,在对其他入侵植物的研究中也有类似的发现,且一般而言水浸提液的浓度越高抑制效果越强[20]。但这种抑制作用在不同受体植物间表现略有差异,如本实验中萝卜种子萌发受到的抑制作用较小,可能是较生菜而言萝卜种皮相对较厚,浸提液中的化感物质透过种皮影响种子萌发所需时间较长。
POD、SOD、CAT三者组成的保护酶系统对于维持植物细胞自由基处于较低水平有重要作用,杂草往往通过化感作用影响植物的保护酶系统,降低植物清除自由基的能力,使其抗性减弱,生长受抑[21-23]。POD活性被认为是植物对环境变化的敏感指标之一,一般在老化组织中活性较高,通常被认为是组织老化的一个重要生理指标。实验中低浓度的空心莲子草水浸提液处理后可诱导其活性增强,清除自由基的危害,此后活性逐步下降,当浓度继续升高时,组织开始衰老并迅速死亡、腐败,过氧化物酶活性再次升高;在这一过程中生菜的变化较为剧烈,这可能与其组织耐受性较差有关,即使发芽的生菜幼苗随处理浓度增加也很快褐化死亡,而萝卜幼苗抵抗力相对较强;上述POD活性的变化规律与实验中种子萌发和幼苗生长的观测结果一致。SOD的活性在低浓度处理条件下变化不大,呈小幅上升趋势,但随着处理浓度增加急剧下降。总体而言POD和SOD活性随着处理浓度由低到高表现出先上升再下降的规律,可能原因是低浓度的胁迫可以诱使二者活性上升,清除自由基的能力增强,随着处理浓度进一步增加超过了其调节范围,酶活性被抑制,植物损伤加剧,这和在对红车轴草(Trifoliumpratense)化感作用的研究中得出的结论类似[15]。CAT活性的提高会加速植株的衰老,降低植株抗性,空心莲子草植株浸提液处理后幼苗体内的过氧化氢酶活性总体表现出上升趋势。细胞膜是细胞与外界环境之间的一道屏障,逆境对植物的伤害首先是引起细胞膜结构的损伤,导致膜透性增大,丙二醛是膜脂过氧化的主要产物,其含量常用来衡量植物受活性氧的伤害程度。逆境条件下,植物体内活性氧清除能力下降是引起丙二醛大量积累的主要原因。由本实验可以看出不同浓度的空心莲子草植株水浸提液处理后,萝卜和生菜幼苗的丙二醛含量持续增加,说明其膜脂过氧化现象越来越严重,这和张远兵等[13]在水稻中的研究结果一致。
本研究结果表明空心莲子草植株水浸提液对受体植物萝卜和生菜表现出了明显的化感效应,受体植物的种子萌发和幼苗的生长总体上被抑制,各种保护酶活性的变化可能是其内在的生理基础之一。由于化感作用涉及影响因素极多,本研究仅对空心莲子草植株水浸提液对萝卜和生菜2种受体植物的化感效应进行了初步研究,增加受体植物的类型,探讨胁迫过程中光合作用、呼吸作用和水分代谢等方面的变化,分析并克隆空心莲子草化感作用相关基因,这些方面还有待于进一步深入研究。
[1] 沈国军,徐正浩,俞谷松.空心莲子草的分布、危害与防除对策[J].植物保护,2005,31(3):14-18.
[2] 郭连金,徐卫红,孙海玲,等.空心莲子草入侵对乡土植物群落组成及植物多样性的影响[J].草业科学,2009,26(7):137-142.
[3] 翁伯琦,林嵩,王义祥.空心莲子草在我国的适应性及入侵机制[J].生态学报,2006,26(7):2373-2381.
[4] Callaway R M,Aschehoug E T.Invasive plants versus their new and old neighbors:A mechanism for exotic invasion[J].Science,2000,290:521-523.
[5] 张天瑞,皇甫超河,杨殿林,等.外来植物黄顶菊的入侵机制及生态调控技术研究进展[J].草业学报,2011,20(3):268-278.
[6] Abhilasha D,Quintana N,Vivanco J,etal.Do allelopathic compounds in invasiveSolidagocanadensiss.l.restrain the native European flora[J].Journal of Ecology,2008,96(5):993-1001.
[7] Zangerl A R,Berenbaum M R.Increase in toxicity of an invasive weed after reassociation with its coevolved herbivore[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(43):15529-15532.
[8] 王桂芹,高瑞如,王玉良,等.异质生境空心莲子草的结构基础与生态适应性[J].草业学报,2011,20(4):143-152.
[9] Wilson J R U,Yeates A,Schooler S,etal.Rapid response to shoot removal by the invasive wetland plant,alligator weed(Alternantheraphiloxeroides)[J].Environmental and Experimental Botany,2007,60(1):20-25.
[10] Schooler S,Cook T,Bourne A,etal.Selective herbicides reduce alligator weed(Alternantheraphiloxeroides)biomass by enhancing competition[J].Weed Science,2008,56:259-264.
[11] Tony C,Graham P.Disturbance-mediated competition:the interacting roles of inundation regime and mechanical and herbicidal control in determining native and invasive plant abundance[J].Biological Invasions,2010,12(9):3351-3361.
[12] 喻大昭,魏守辉,朱文达,等.空心莲子草对水稻生长的影响及其经济阈值[J].植物保护学报,2008,35(1):69-73.
[13] 张远兵,刘爱荣,吴倩.空心莲子草水浸液对水稻种子萌发和幼苗生长的化感效应[J].热带作物学报,2009,30(10):1526-1531.
[14] 李洁,蒋娜,范雪涛,等.空心莲子草化感效应的初步研究[J].种子,2007,26(12):32-35.
[15] 徐蕊,刘权,燕志强,等.红车轴草对莴苣生长抑制作用研究[J].草业学报,2011,20(6):45-51.
[16] Hao Z P,Wang Q,Christie P,etal.Allelopathic potential of watermelon tissues and root exudates[J].Scientia Horticulturae,2007,112(3):315-320.
[17] Jefferson L V,Pennacchio M.Allelopathic effects of foliage extracts from four Chenopodiaceae species on seed germination[J].Journal of Arid Environments,2003,55(2):275-285.
[18] 王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006.
[19] Willamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responseswith independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[20] 万欢欢,刘万学,万方浩.紫茎泽兰叶片凋落物对入侵地4种草本植物的化感作用[J].中国生态农业学报,2011,19(1):130-134.
[21] 林文雄,何华勤,郭玉春,等.水稻化感作用及其生理生化特性的研究[J].应用生态学报,2001,12(6):871-875.
[22] 聂呈荣,曾任森,黎华寿,等.三裂叶蟛蜞菊对花生化感作用的生理生化机理[J].花生学报,2002,31(3):1-5.
[23] 郭鸿儒,沈慧敏,杨顺义,等.黄花蒿化感物质对受体燕麦化感作用机理的初步研究[J].甘肃农业大学学报,2008,43(1):102-104.
