两个海拔分布下红砂叶片对渗透胁迫的生理响应
2013-04-10李朝周左丽萍李毅焦健
李朝周,左丽萍,李毅,焦健*
(1.甘肃省干旱生境作物学重点实验室,甘肃 兰州730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州730070;3.庆阳市经济林木工作管理站,甘肃 庆阳745000;4.甘肃农业大学林学院,甘肃 兰州730070)
红砂(Reaumuriasoongorica)是我国荒漠草场中的建群植物和优势植物,作为良好的荒漠草场牧草和维持绿洲稳定性的重要植物之一,红砂具有较高的生态、经济和社会价值[1-3]。有关红砂渗透调节物质、光合生理及生长发育的研究已有报道[4-6],但是关于红砂在不同海拔及水分状况下抗旱生理比较还缺乏系统研究。
在同一地域的不同海拔往往具有不同的生境因子,如不同的温度、光照和降水等,这些不同会影响到植物本身的水分状况、生长发育和抗性生理。当植物遭受到干旱胁迫时,植物细胞往往受到一定程度的渗透胁迫,并造成植物组织及细胞失水,水势和相对含水量下降,并有可能带来细胞内一系列的变化,如活性氧、自由基产生的增加、细胞内脂质过氧化产物的累积和细胞膜选择透性的破坏等[7,8]。活性氧、自由基在低浓度下可作为第二信使,调节细胞间的信号传导和细胞内代谢,但是当活性氧的浓度超过一定“阈值”时,则能对细胞膜系统造成伤害;当然植物在长期的进化过程中也形成了清除活性氧、自由基的机制,如低分子的抗氧化剂与抗氧化酶系统,如抗坏血酸、还原型谷胱甘肽、超氧化物歧化酶、过氧化物酶和过氧化氢酶等[8,9]。近几十年来,许多研究表明用PEG溶液进行渗透胁迫可以在一定程度上模拟干旱胁迫,而处理方式除对整体植物进行根系的PEG溶液渗透胁迫外,离体的叶片也被应用于渗透胁迫,并具有处理均一和便于掌控胁迫程度的优点,因此渗透胁迫在植物逆境生理研究中广为采用[10-13]。
植物的抗旱性是由多种因素相互作用而构成的一个复杂的综合性状,其中每一个因素都与抗旱性本质之间存在着一定的联系,而各因素之间也存在着一定的关联。植物抵御或适应干旱的途径多种多样,用单一指标很难准确评定植物的抗旱性,因此有必要探讨渗透胁迫下抗性相关各生理指标变化间的关联。
为此,本实验以兰州市九州台山上、山下天然分布的红砂枝条为实验材料,通过用PEG-6000溶液渗透胁迫,测定其叶片在不同胁迫程度下相关生理指标的变化及其关联,探讨不同海拔红砂叶片对渗透胁迫生理响应的差别及机制,旨在为干旱半干旱地区荒漠化防治及荒山造林实践提供理论依据。
1 材料与方法
1.1 材料和处理
本实验所用材料取自兰州市九州台山上(海拔1 800m)、山下(海拔1 500m)自然生长且3龄以上的红砂植株,取生长整齐一致的枝条,从各枝条顶端剪取10cm左右枝段插于PEG-6000溶液进行渗透胁迫处理。PEG-6000溶液浓度分别为10%,20%,30%(质量百分比浓度),以蒸馏水作为对照,于处理12和24h时,取其叶片进行各项生理生化指标的测定。渗透胁迫处理在光照培养箱内进行,其温度为(22±1)℃,相对湿度为55%,持续24h光照,光照强度为120μmol/(m2·s)。实验于2008年7-8月进行,各项指标测定均重复3~5次。
1.2 相关指标测定方法
1.2.1 相对含水量(RWC) 烘干法[14]测定。
1.2.2 植物组织水势 小液流法[14]测定。
1.2.3 自由水 (Vs)和束缚水 (Va)含量 参照郝再彬等[15]的方法测定。
1.2.4 丙二醛(MDA)含量 参照Benavides等[16]的方法测定。
1.2.5 脯氨酸含量 茚三酮比色法[14]测定。显色后在520nm波长处测定光密度值,通过标准曲线计算游离脯氨酸含量。
1.2.6 可溶性糖含量 采用蒽酮比色法[14]测定。
1.2.7 O2-·产生速率 参照王爱国和罗广华[17]的方法,测定环境中的光照强度为120μmol/(m2·s)。
1.2.8 抗氧化酶活性 超氧化物歧化酶(SOD)采用Spychalla和Desborough[18]的方法测定,用氮蓝四唑法以抑制氯化硝基氮蓝四唑(NBT)光化还原50%为一个酶活性单位;过氧化物酶(POD)和过氧化氢酶(CAT)活性测定采用Lin和Wang[19]的方法。其中POD活性测定基于愈创木酚的氧化,在470nm测定,以每克植物鲜重中每分钟所含酶活性单位(U)表示;过氧化氢酶(CAT)活性用紫外吸收法,以240nm每分钟光吸收值减少0.01为一个酶活性单位。
1.3 数据处理
采用SPSS统计分析软件进行数据处理及相关性分析,取P<0.05为显著相关,P<0.01为极显著相关。各数据均用平均值±标准差表示。
2 结果与分析
2.1 渗透胁迫对红砂叶片水分生理特征的影响
兰州市九州台山上及山下红砂叶片相对含水量和水势都随PEG-6000处理时间的延长和胁迫程度的加强呈下降趋势(表1)。在30%的PEG处理12h时,山上、山下红砂叶片相对含水量分别比对照降低了48.94%,28.22%,处理24h时分别下降了57.96%,47.72%。在30%的PEG处理12h时山上、山下红砂叶片水势分别比对照降低了0.13和0.88MPa,在处理24h时分别降低了0.26和1.01MPa。可见,山下生长的红砂在受胁迫时持水能力较好。
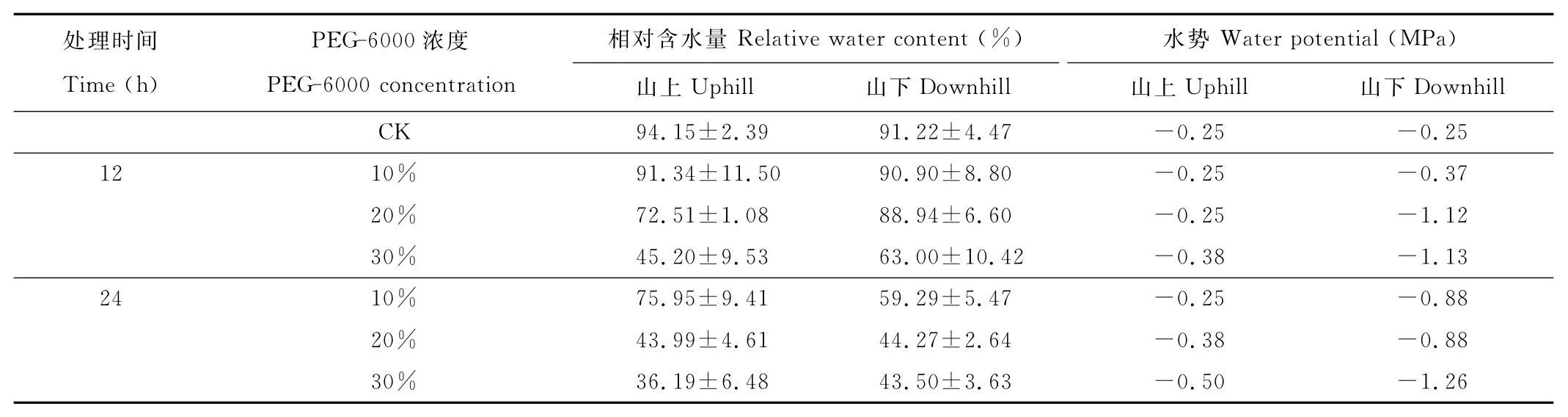
表1 PEG-6000处理下红砂叶片相对含水量及水势变化Table 1 Changes in leaf relative water content and water potential of R.soongoricaunder PEG-6000treatment
随着PEG-6000渗透胁迫程度的加强和胁迫时间的延长,红砂叶片自由水含量逐渐减少,束缚水含量增多,自由水/束缚水的值不断减小(表2)。用浓度30%的PEG处理12h时,山上、山下红砂自由水/束缚水的值分别比对照降低了0.94,0.60;处理24h时分别下降了1.00,0.60。由此可见山下红砂比山上红砂有更强的耐渗透胁迫的能力。
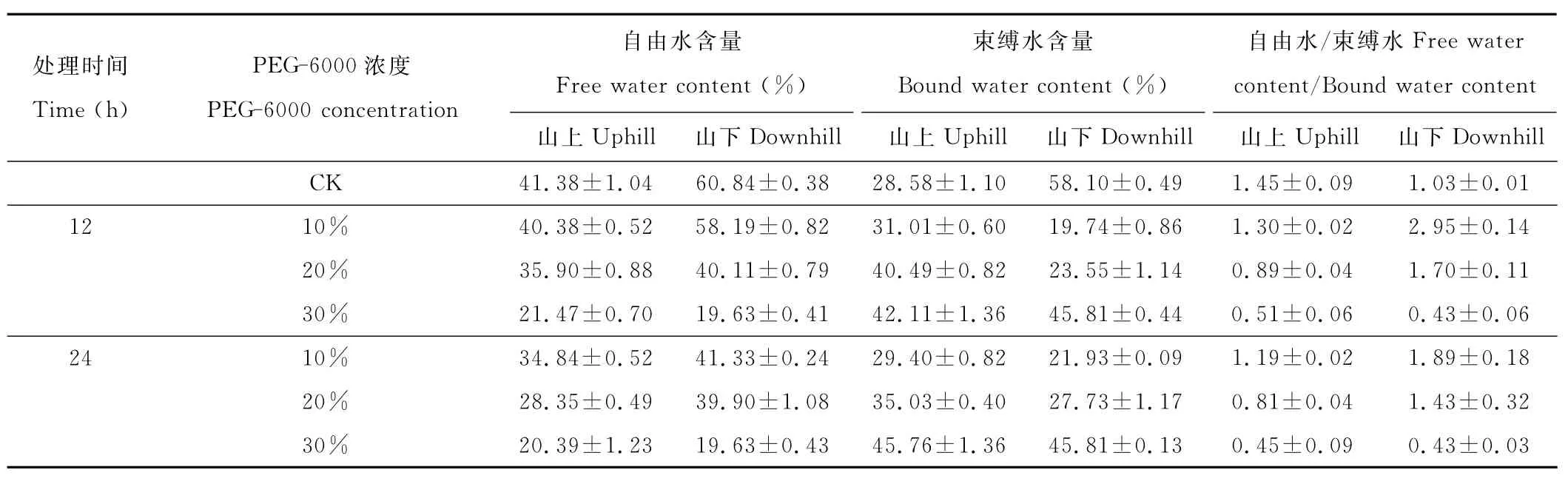
表2 PEG-6000处理下红砂叶片自由水、束缚水及自由水/束缚水的变化Table 2 Changes in leaf Vs,Va and Vs/Va of R.soongoricaunder PEG-6000treatment
2.2 渗透胁迫对红砂叶片MDA含量的影响
兰州市九州台山上、山下红砂叶片MDA含量随PEG渗透胁迫时间的延长和胁迫程度的加强呈上升趋势,但上升的趋势不同(图1),用浓度30%的PEG处理12h时,山上、山下红砂叶片MDA含量分别比对照提高了3.24和1.67μmol/g,处理24h时分别提高了4.08和2.88μmol/g。由此可见,山上红砂叶片在受到渗透胁迫时,膜脂过氧化程度比山下红砂叶片更为严重。
2.3 渗透胁迫对红砂叶片O2-·产生速率的影响
随PEG渗透胁迫时间的延长和胁迫程度的加强,兰州市九州台山上、山下红砂叶片O2-·产生速率呈不断增大趋势,但增大的程度不同,用浓度30%的PEG处理12h时,山上、山下红砂叶片O2-·产生速率分别比对照增大了174.94和167.93μmol/(min·g FW);处理24h时分别增大了179.80和169.30μmol/(min·g FW)(图2)。
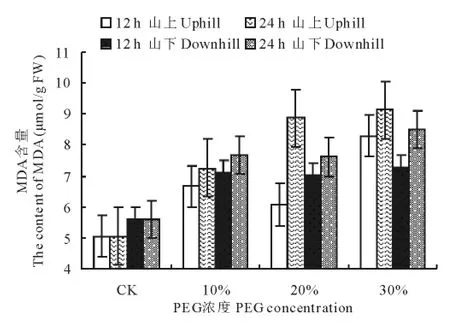
图1 PEG-6000处理对红砂叶片丙二醛含量的影响Fig.1 Effect of PEG-6000treatment on MDA content in R.soongoricaleaf
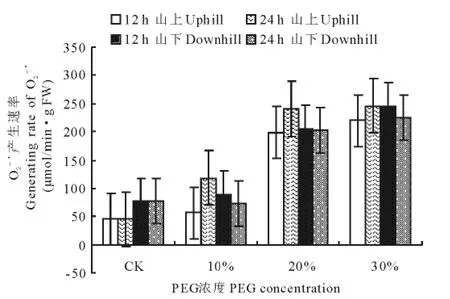
图2 PEG-6000处理对红砂叶片O2-·产生速率的影响Fig.2 Effect of PEG-6000treatment on generating rate of O2-·in R.soongoricaleaf
2.4 渗透胁迫对红砂叶片抗氧化酶活性的影响
试验结果表明,在PEG渗透胁迫下红砂叶片超氧化物歧化酶(SOD)活性均高于对照,且随胁迫时间的延长和胁迫程度的加强呈不断增加趋势;清除H2O2的2种重要的酶CAT和POD变化基本一致,在处理12h时,随PEG浓度的升高,POD和CAT活性升高,但在处理24h时,随PEG浓度的升高,POD和CAT活性先升高后降低(图3)。SOD是一种诱导酶,受到底物浓度的诱导,说明干旱促进红砂叶片O2-·的生成,诱导SOD活性增加,由SOD歧化O2-·产生的H2O2也必然增多,在胁迫后期POD和CAT活性均下降。
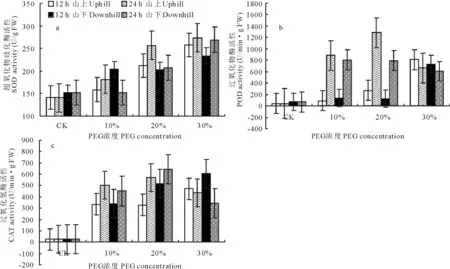
图3 PEG-6000处理对红砂叶片SOD、POD和CAT活性的影响Fig.3 Effect of PEG-6000treatment on SOD,POD and CAT activity in R.soongoricaleaf
2.5 渗透胁迫对红砂叶片渗透调节物质的影响
兰州九州台山上、山下红砂叶片在PEG渗透胁迫下脯氨酸含量变化趋势相同(图4),在不同PEG浓度渗透胁迫处理12h时山上、山下红砂叶片脯氨酸含量均呈增加趋势,处理24h时山上、山下红砂叶片脯氨酸含量在PEG浓度为10%和20%时上升较快,而PEG浓度为30%时有所下降。山下红砂叶片脯氨酸含量变化较为剧烈。随渗透胁迫时间的延长和胁迫程度的加强,红砂叶片可溶性糖含量不断的增加,但增加趋势不同,10%的PEG处理红砂叶片可溶性糖含量比对照变化较小,但高浓度的PEG处理下的红砂叶片可溶性糖含量变化较大。随着胁迫的进行,兰州九州台山下红砂叶片渗透调节物质随胁迫进行变化较为剧烈。
2.6 渗透胁迫下红砂叶片生理特征的相关性
渗透胁迫下,兰州市九州台山上、山下红砂叶片水分指标RWC、水势及自由水/束缚水均与MDA、O2-·产生速率、SOD活性和可溶性糖呈显著或极显著负相关(表3);MDA与SOD活性呈极显著负相关;O2-·产生速率与SOD活性呈显著正相关,其余相关关系不显著。
3 讨论
束缚水含量是植物耐旱性的一个重要指标。束缚水比例增大,则细胞原生质粘滞性及原生质胶体亲水性加强,有利于植物吸水和保持体内水分,对提高植物耐旱能力有利,即自由水/束缚水(Va/Vs)小,则植物耐旱能力强[20]。本研究显示兰州市九州台山下红砂叶片相对含水量虽然低于山上的红砂(表1),但自由水/束缚水下降(表2),这与不同海拔造成的气候条件和干旱程度密切相关,也可能是本研究探讨的不同海拔红砂叶片对渗透胁迫生理反应差异的重要原因。
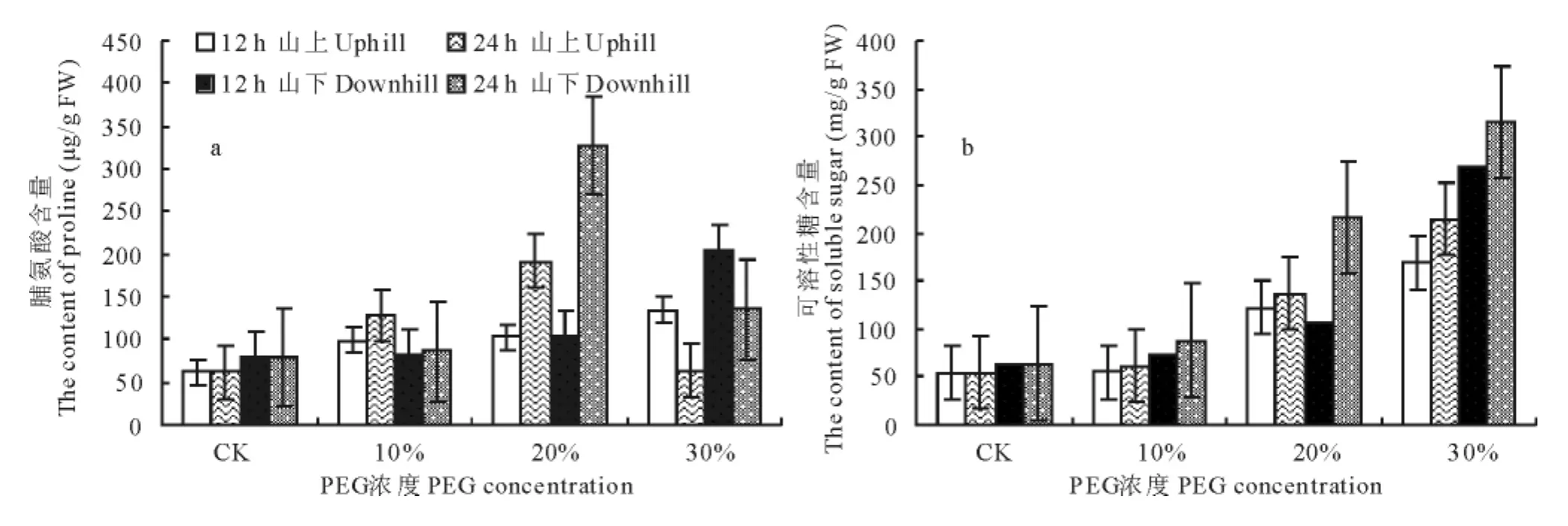
图4 PEG-6000处理对红砂叶片脯氨酸及可溶性糖含量的影响Fig.4 Effect of PEG-6000treatment on proline and soluble sugar content in R.soongoricaleaf
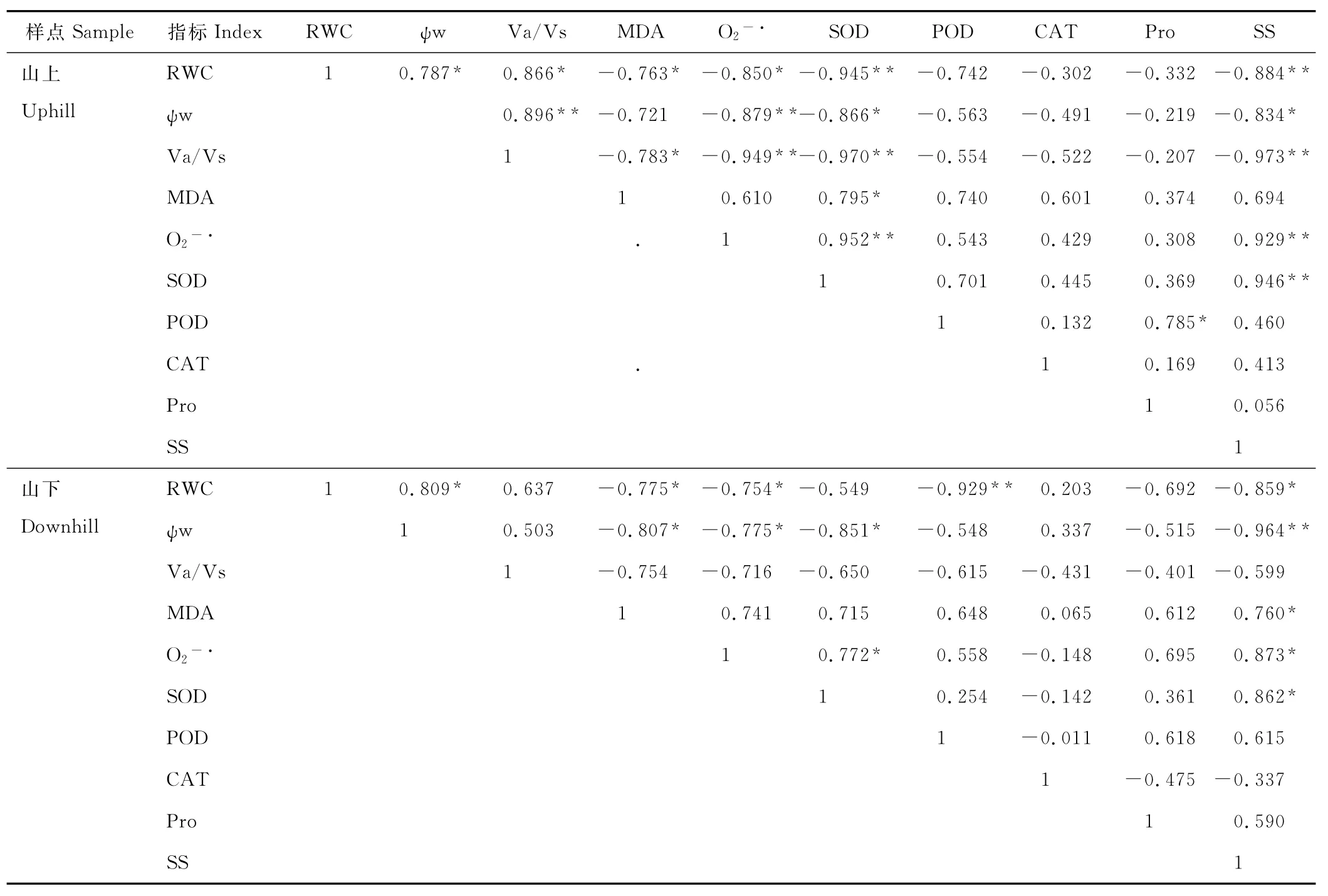
表3 PEG-6000处理下红砂叶片生理特征的相关性Table 3 Correlations among physiological indexes of R.soongoricaleaf under PEG-6000treatment
渗透调节是植物应对水分胁迫的重要措施。有研究显示柽柳属(Tamarix)植物水势越低,持水力越强,抗旱性越强[21]。本研究的结果表明,渗透胁迫导致红砂叶片自由水含量、水势和相对含水量降低(表1),但九州台山上生长的红砂由于其叶片束缚水含量相对较高(表2),随PEG渗透胁迫的加深表现出了较强的保水能力,如在30% 的PEG-6000溶液渗透胁迫24h山上红砂叶片含水量比山下红砂高(表1)。
植物在逆境条件下的膜脂过氧化反应和保护酶系统SOD、POD、CAT等活性的变化已广泛应用于植物对逆境的反应机理研究[22]。MDA是植物细胞脂质过氧化的产物之一,其含量的高低在一定程度上能反映膜脂过氧化水平和膜结构的受害程度。一般认为植物在胁迫条件下细胞膜的受损与超氧自由基增加引起膜脂过氧化有关[9,22,23]。SOD、CAT和POD等酶类是细胞抵御活性氧伤害的重要保护酶,它们在清除超氧自由基、过氧化氢和过氧化物以及阻止或减少自由基产生等方面起着重要作用[9]。超氧化物歧化酶以催化O2-·发生歧化作用起到清除O2-·的解毒作用,超氧化物歧化酶将O2-·歧化产生的H2O2由细胞内CAT和POD清除。胁迫条件下保护酶系统活性上升和下降与植物的抗旱性强弱有关。抗旱强的品种在逆境条件下能使保护酶活力维持在一个较高水平,有利于清除自由基,降低膜脂过氧化水平,从而减轻膜伤害程度[16]。本研究表明,PEG渗透胁迫导致红砂叶片MDA含量增多,在PEG渗透胁迫下SOD,POD和CAT活性增强,上述结果说明渗透胁迫一方面刺激红砂叶片产生更多的自由基,加快脂质过氧化,导致MDA含量增加,另一方面刺激了保护酶系统(SOD、POD和CAT)活性的增强,加快自由基的清除,减轻膜脂过氧化程度。在PEG溶液的渗透胁迫下,红砂叶片水分亏缺随PEG胁迫加剧而逐渐加重,水势不断的降低(表1),由此造成脂质过氧化产物丙二醛(MDA)积累(图1),O2-·产生速率的大幅度增加(图2),从而诱发超氧化物歧化酶(SOD)活性增强(图3a)。在适度胁迫下,植物对环境胁迫做出响应,POD和CAT活性增强(图3b~c),脯氨酸和可溶性糖含量增加(图4a~b),但进一步胁迫导致POD和CAT活性下降(图3b~c),红砂叶片内保护酶系统平衡破坏。PEG渗透胁迫下,兰州市九州台山上、山下红砂叶片渗透胁迫下各生理变化相关分析表明,红砂叶片水分指标RWC、水势及自由水/束缚水均与MDA含量及O2-·产生速率呈显著负相关;SOD活性与O2-·产生速率呈显著正相关(表3),可见渗透胁迫下各生理指标的变化密切关联。
总之,对于九州台山上和山下生长的2组材料,在PEG胁迫加深的条件下,山下的红砂叶片具有较强的渗透调节能力和抗氧化能力,其脂质过氧化的水平也较低,产生这些生理响应差别的主要因素可能为2组材料水分状况的差别,即山下红砂叶片束缚水含量较高,在深度胁迫下的保水性较好,且在通常情况下较低的叶片含水量和水势也可能是其较强抗渗透胁迫能力的重要原因之一。
[1] 种培芳,苏世平,李毅.4个地理种群红砂的抗旱性综合评价[J].草业学报,2011,20(5):26-33.
[2] 黄振英,吴鸿,胡正海.30种新疆沙生植物的结构及其对沙漠环境的适应[J].植物生态学报,1997,2(6):521-530.
[3] 马剑英,方向文,夏敦胜,等.荒漠植物红砂叶片元素含量与气候因子的关系[J].植物生态学报,2008,32(4):848-857.
[4] 李景平,杨鑫光,傅华,等.阿拉善荒漠区3种旱生植物体内主要渗透调节物质的含量和分配特征[J].草业科学,2005,22(9):35-38.
[5] 贾荣亮,周海燕,谭会娟,等.超旱生植物红砂与珍珠光合生理生态日变化特征初探[J].中国沙漠,2006,26(4):631-636.
[6] 曾彦军,王彦荣,保平,等.几种生态因子对红砂和霸王种子萌发与幼苗生长的影响[J].草业学报,2005,14(5):24-31.
[7] 杨鑫光,傅华,牛得草.干旱胁迫下幼苗期霸王的生理响应[J].草业学报,2007,16(5):107-112.
[7] Carlos G B,Marcela S,Eduardo T,etal.Drought and watering-dependent oxidative stress:effect on antioxidant content inTriticumaestivumL.leaves[J].Journal of Experimental Botany,1999,50:375-383.
[9] Bowler C,Van Montagu M,Inze D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Molecular Biology,1992,43:83-116.
[10] Aziz A,Martin-Tanguy J,Larher F.Plasticity of polyamine metabolism associated with high osmotic stress in rape leaf discs and with ethylene treatment[J].Plant Growth Regulation,1997,21:153-163.
[11] 邱真静,李毅,种培芳.PEG胁迫对不同地理种源沙拐枣生理特性的影响[J].草业学报,2011,20(3):108-114.
[12] 王瑾,刘桂茹,杨学举.PEG胁迫下不同抗旱性小麦品种幼苗形态及主要理化特性的比较[J].河北农业大学学报,2005,28(5):6-10.
[13] Li C Z,Wang D,Wang G X.The protective effects of cobalt on potato seedling leaves during osmotic stress[J].Botanical Bulletin of Academia Sinica,2005,46:119-125.
[14] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:11-12,21-23,161-162,111-112.
[15] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨大学出版社,2004:101-108.
[16] Benavides M P,Gallego S M,Comba M E,etal.Relationship between polyamines and paraquat toxicity in sunflower leaf discs[J].Plant Growth Regulation,2000,31:215-224.
[17] 王爱国,罗广华.植物的超氧自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,(6):55-57.
[18] Spychalla J P,Desborough S L.Superoxide dismutase,catalase and alpha tocopherol content of stored potato tubers[J].Plant Physiology,1990,94:1214-1218.
[19] Lin J S,Wang G X.Double CO2could improve the drought tolerance better in sensitive cultivars than in tolerant cultivars in spring wheat[J].Plant Science,2002,163:627-637.
[20] 曹帮华,巩其亮,段祖安,等.3树种苗木水分状况与造林成活效果的研究[J].山东林业科技,1998,(2):7-10.
[21] 高海峰.柽柳属植物水分状况的研究[J].植物生理学通讯,1988,(2):20-24.
[22] 芦翔,石卫东,王宜伦,等.外源NO对NaCl胁迫下燕麦幼苗抗氧化酶活性和生长的影响[J].草业科学,2011,28(12):2150-2156.
[23] Ma L,Li C Z.Effects of cobalt and DFMA on polyamines content and membrane-lipid peroxidation in wheat seedlings leaves under osmotic stress[J].干旱地区农业研究,2010,28(1):137-146.
