人肥大细胞类糜蛋白酶的促血管生成作用
2013-04-09张志伟侯玉涛何素辉邝珠芳陈章权
张志伟,侯玉涛,何素辉,邝珠芳,陈章权#
(1.广东医学院广东省医学分子诊断重点实验室,东莞 523808;2.广东医学院临床免疫学教研室,东莞 523808;3.广东医学院门诊部,东莞 523808)
肥大细胞是多功能细胞,其内的炎性介质对功能的发挥具有重要作用。肥大细胞炎性介质主要分为预先合成和新合成两种介质,其中中性蛋白酶是一类重要的预先合成介质,其主要成分之一的肥大细胞类糜蛋白酶(mast cell chymase,MC-Chy)是一种丝氨酸蛋白酶,在过敏性疾病、动脉粥样硬化、心肌梗死、肿瘤、肺纤维化等疾病的发生发展中发挥着重要的病理生理作用[1-2]。近年来研究表明,MC-Chy与肿瘤的血管生成有关[3]。本实验应用基质胶栓(Matrigel plug)血管生成模型对人MC-Chy的促血管生成作用进行研究。
材料和方法
材料
人MC-Chy分泌型真核表达质粒DNA由广东医学院广东省医学分子诊断重点实验室构建[4]。基质胶(BD MatrigelTMBasement Membrane Matrix High Concentration)购自BD公司。糜蛋白酶抑制剂(chymostatin,CHI)及类糜蛋白酶检测试剂盒(Chymase Assay Kit)购自sigma公司。无内毒素质粒大提试剂盒购自北京TIANGEN公司。兔抗CD34抗体、免疫组化检测试剂盒购自北京博奥森生物科技有限公司。HE染色试剂盒购自北京索莱宝科技有限公司。血红蛋白(hemoglobin,Hb)测定文齐氏液购自天津市现代高科技研究院中山研究所。BALBc小鼠由广东医学院实验动物中心提供。
方法
MC-Chy活性测定:上述离心收集上清,加入0.05%的二甲基亚砜(Dimethyl sulfoxide,DMSO),采用Chymase Assay Kit进行酶活性检测,具体操作步骤按说明书进行。
HE染色:一半基质胶栓组织经4%甲醛固定后常规包埋切片,脱蜡后,苏木精染色液染色8 min,冲洗后分化液分化30 s,温水浸泡5 min,伊红复染,自来水冲洗,常规脱水,透明,中性树脂封片。
免疫组织化学染色:采用CD34作为血管内皮细胞的标记物,对基质胶栓组织的新生血管内皮细胞进行免疫组织化学染色,采用链霉亲和素-过氧化物酶(streptavidin-perosidase,SP)三步法,步骤主要如下:切片脱蜡后,采用0.4%胃蛋白酶(用0.1 molL盐酸配制)修复抗原,3%过氧化氢去离子水去除内源性过氧化物酶,常规封闭后加兔抗CD34多克隆抗体(一抗),孵育洗涤后加生物素化的山羊抗兔IgG(二抗),孵育洗涤后加辣根过氧化物酶标记的链霉亲和素工作液(酶液),孵育洗涤后加二氨基联苯胺-过氧化氢溶液显色,水洗终止显色,苏木素复染、冲洗、脱水、透明、封片。
MVD测量:用免疫组织化学法对血管内皮细胞CD34分子进行染色后,进行血管密度计数,方法参照文献[6]。被抗CD34抗体染成棕黄色的内皮细胞或内皮细胞簇,只要与其他结缔组织成分有明显区别,无论有无管腔,均作为1个微血管计数。在100倍光镜下扫查整个切片,寻找血管高密度区,再在高倍镜(400倍)下记数10个视野被染成棕黄色的血管数,每个高倍镜视野(high power objective,HP)的面积为150 μm×100 μm,取其平均值作为微血管密度。以上的测量过程由带有New OsteoMeasure图像分析软件的成像分析系统进行。
统计学分析
结 果
Hb浓度
Chy50组、Chy100组、Chy150组、Chy200组与对照组比较均存在显著性差异。注射不同剂量的质粒DNA的实验组之间比较,除Chy150组与Chy200之间差异不存在显著统计学意义(P>0.05)外,其他各组之间均存在显著统计学意义(P<0.05)。抑制剂组的Hb含量检测结果与对照组相比差异无显著统计学意义(P>0.05)(表1)。
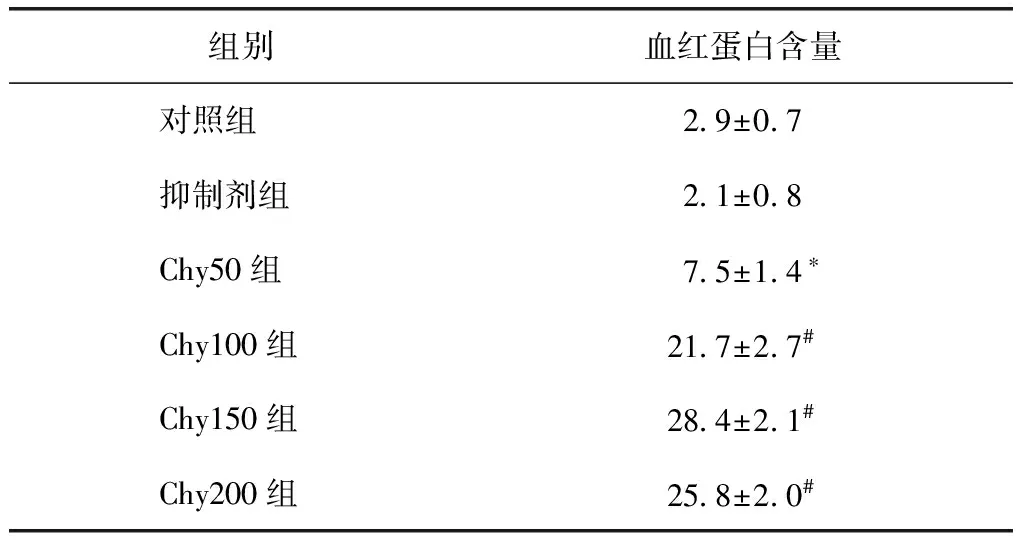
基质胶栓组织中MC-Chy活性测定
阳性对照为试剂盒内提供的MC-Chy,可见酶作用曲线迅速上升且很快,约20 min达到平衡期。阳性对照加CHI后,其反应曲线与只加生理盐水的阴性对照基本相同。Chy100组的MC-Chy反应的光密度(optical density,OD)值持续上升,但上升速度较阳性对照慢,且1.5 h后仍有上升。Chy100组加CHI后,则检测不出酶反应,酶反应被完全抑制(图1)。实验中发现,其他各浓度的实验组得到与Chy100组相似的结果。
表1基质胶栓组织中血红蛋白含量测定(mgg湿组织)
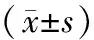
组别血红蛋白含量对照组2 9±0 7抑制剂组2 1±0 8Chy50组7 5±1 4∗Chy100组21 7±2 7#Chy150组28 4±2 1#Chy200组25 8±2 0#
与对照组比较,*P<0.05,#P<0.01
HE染色
对照组偶见少量散在的小血管。4组实验组均可以看到较多的血管;随着MC-Chy质粒DNA注射剂量的增加,其血管数目增加;但当注射的质粒DNA剂量超过150 μg后,血管数则未见明显增加。抑制剂组未见到新生血管(图2)。
免疫组织化学染色
对照组偶见有散在的棕黄色阳性颗粒,抑制剂组未见棕黄色阳性颗粒。实验组均可看到较多的棕黄色阳性颗粒及粗大的血管腔;随着MC-Chy质粒DNA注射剂量的增加,阳性程度不断增加,但当MC-Chy质粒DNA的注射剂量超过150 μg后,则未见明显增加(图3)。
MVD测量
Chy50组、Chy100组、Chy150组、Chy200组与对照组比较,均存在显著性差异(P<0.01)。实验组中各组间比较,随着MC-Chy质粒DNA注射剂量的增加,MVD值则上升,但Chy100组与Chy200组之间、Chy150组与Chy200组间不存在显著性差异(P>0.05)。抑制剂组与对照组相比,无显著性差异(P>0.05)(表2)。
图1 基质胶栓类糜蛋白酶活性测定结果Fig 1 The detection of chymase activity in matrigel plug CHI:糜蛋白酶抑制剂
表2胶体组织血管密度计数(血管数HP)
Table2Count of MVD in matrigel plug (microvessel numberHP)
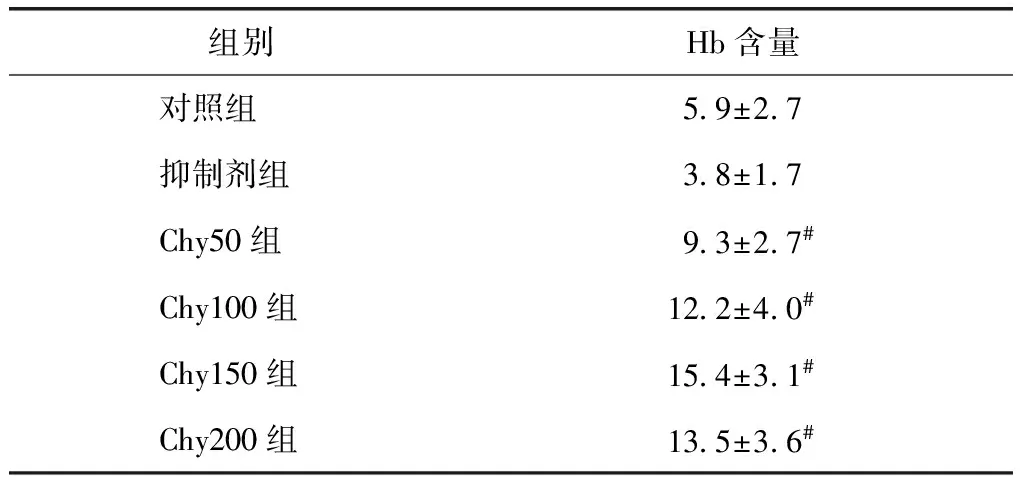
组别Hb含量对照组5 9±2 7抑制剂组3 8±1 7Chy50组9 3±2 7#Chy100组12 2±4 0#Chy150组15 4±3 1#Chy200组13 5±3 6#
与对照组比较,#P<0.01
讨 论
肥大细胞不仅在变态反应性疾病中起着至关重要的作用,在免疫应答及血管生成、组织重塑、伤口愈合、肿瘤的发生发展等方面也起着重要作用[7-8]。肥大细胞作用的发挥主要依赖于细胞活化并产生和释放炎性介质,MC-Chy是其中重要的细胞内预先合成介质。近年来,MC-Chy与肿瘤的血管生成有关[3],但具体机制尚未完全清楚。
研究血管生成作用的实验模型有多种,主要有体内模型和体外模型两大类。基质胶栓模型是一种新的体内模型,该模型利用了基质胶在4℃时维持液态,在室温以上温度时迅速凝结成胶的特点进行。由于天然的人MC-Chy难于获取,本实验采用体内基质胶栓血管生成模型的方法,将人MC-Chy真核表达质粒转染入动物体内,在体内表达MC-Chy的方法来研究其在血管生成中的作用[5-6]。通过Hb浓度及MVD的定量测定,结果发现人MC-Chy真核表达质粒DNA注射实验组与生理盐水对照组比较均存在显著性差异(P<0.05),显示人MC-Chy具有明显的促血管生成作用。HE和免疫组织化学染色结果也显示抑制剂组未见到新生血管,而实验组则见有显明的新生血管。因此,本实验结果表明人MC-Chy具有明显的促血管生成作用,为进一步研究人MC-Chy的促血管新生在肿瘤及其他疾病发生发展中的病理生理作用奠定了基础。
(本文图2、3见插页第Ⅲ页)
[1]Pejler G, Ronnberg E, Waern I, et al. Mast cell proteases: multifaceted regulators of inflammatory disease[J]. Blood, 2010, 115:4981-4890.
[2]Bacani C, Frishman WH. Chymase: a new pharmacologic target in cardiovascular disease[J]. Cardiol Rev, 2006, 14:187-193.
[3]Kondo K, Muramatsu M, Okamoto Y, et al. Expression of chymase-positive cells in gastric cancer and its correlation with the angiogenesis[J]. J Surg Oncol, 2006, 93:36-42.
[4]唐晓磊, 何素辉, 梁晓东, 等. 人肥大细胞类糜蛋白酶分泌型真核表达载体的构建[J]. 山东医药, 2010:23-25.
[5]Murray JC. Angiogenesis protocols[J]. Humana Pr Inc, 2001, 46:45-50.
[6]Muramatsu M, Katada J, Hayashi I, et al. Chymase as a proangiogenic factor. A possible involvement of chymase-angiotensin-dependent pathway in the hamster sponge angiogenesis model[J]. J Biol Chem, 2000, 275:5545-5552.
[7]Kondo K, Muramatsu M, Okamoto Y, et al. Expression of chymase-positive cells in gastric cancer and its correlation with the angiogenesis[J]. Surg Oncol, 2006, 93:36-42.
[8]Mauro LV, Bellido M, Morandi A,et al. Association between mast cells of different phenotypes and angiogenesis in colorectal cancer[J]. Mol Med Report, 2008,1:895-902.
