质子泵抑制剂的分类及药理学特性
2013-04-08陈坚
陈坚
(复旦大学附属华山医院消化科 上海 200040)
人体胃黏膜壁细胞分泌小管膜上的H+/K+-ATP酶又称质子泵或酸泵。能选择性地抑制H+/K+-ATP酶的药物——质子泵抑制剂已成为一代新型抑酸药物,对基础胃酸、夜间胃酸、五肽胃泌素刺激和试餐刺激后的胃酸分泌均有显著的抑制作用,是目前治疗酸相关疾病(消化性溃疡、反流性食管炎等)的首选药物[1]。质子泵抑制剂是苯并咪唑衍生物,能迅速穿过壁细胞胞膜而蓄积在强酸性的分泌小管中,然后转化为次磺酰胺类化合物,后者可与H+/K+-ATP酶α亚基中的半胱氨酸残基上的巯基形成共价结合的二硫键,由此使H+/K+-ATP酶失活、抑制其泌酸活性[2]。自1988年第一个质子泵抑制剂奥美拉唑上市以来,全球至今共上市了8个质子泵抑制剂(表1),其中已在国内上市的有5个(奥美拉唑、兰索拉唑、泮托拉唑、雷贝拉唑、埃索美拉唑[3])。质子泵抑制剂的研发与临床应用在胃肠病学领域具有里程碑性的意义。本文就现已在国内上市的质子泵抑制剂的药理学特性作一简要概述。
1 质子泵抑制剂的分类
1.1 第一代质子泵抑制剂
第一代质子泵抑制剂为奥美拉唑、兰索拉唑和泮托拉唑,它们主要经肝脏细胞色素P450酶系(cytochrome P450, CPY)中的同功酶CYP 2C19和CYP 3A4代谢[4]。CYP 2C19是质子泵抑制剂的主要代谢酶,而CYP 2C19基因存在着多态性[5-6],即快代谢型(extensive metaboliser)和慢代谢型(poor metaboliser)。亚洲人中12%~22%为慢代谢型,但白种人仅3%属慢代谢型[7]。慢代谢型患者的CYP 2C19活性低,对奥美拉唑、兰索拉唑或泮托拉唑的清除慢,故血浆中的药物浓度较高。在慢代谢型人群中,奥美拉唑的最大血药浓度较在快代谢型人群中高约7倍[8]。质子泵抑制剂的这种血药浓度的差异可导致对不同患者抑酸疗效上的巨大差别。因此,第一代质子泵抑制剂有两个药理学局限性:药代动力学和药效学的明显个体差异以及复杂的药物相互作用。
所有质子泵抑制剂均经肝脏代谢,主要代谢酶为CYP 2C19和CYP 3A4[9]。但不同的质子泵抑制剂的药理学参数(半衰期、代谢途径、生物利用度和清除途径)有一些细微差异(表2)。泮托拉唑较少经CYP 2C19代谢,其主要通过肝微粒体中的Ⅱ相代谢途径代谢[10];雷贝拉唑的代谢有80%通过非酶途径,其硫醚代谢物的形成依赖于硫醚非酶还原机制[11]。虽然雷贝拉唑主要通过非酶代谢,但CYP 2C19基因型依然会影响其血药浓度[12]。在快代谢型、慢代谢型和杂合子人群中,雷贝拉唑的血药浓度有明显的差别。不过,当使用CYP 2C19抑制剂后,不同基因型受试者的血药浓度却没有差异了,说明雷贝拉唑的血药浓度依然受到CYP 2C19基因型的影响。
1.2 新一代质子泵抑制剂
近年来问世的新一代质子泵抑制剂(艾普拉唑、雷贝拉唑和埃索美拉唑)能不同程度地克服第一代质子泵抑制剂的某些缺陷、同时增强对酸相关疾病的治疗疗效[13],其中雷贝拉唑和埃索美拉唑已在临床上得到广泛应用。这些质子泵抑制剂的主要特点包括:①临床抑酸效果更好;②抑酸作用起效快;③昼、夜均可维持较高的抑酸水平,防止夜间酸突破(night acid breakthrough,NAB);④疗效确切、个体差异小;⑤与其他药物间的相互影响少;⑥不良反应少[14]。
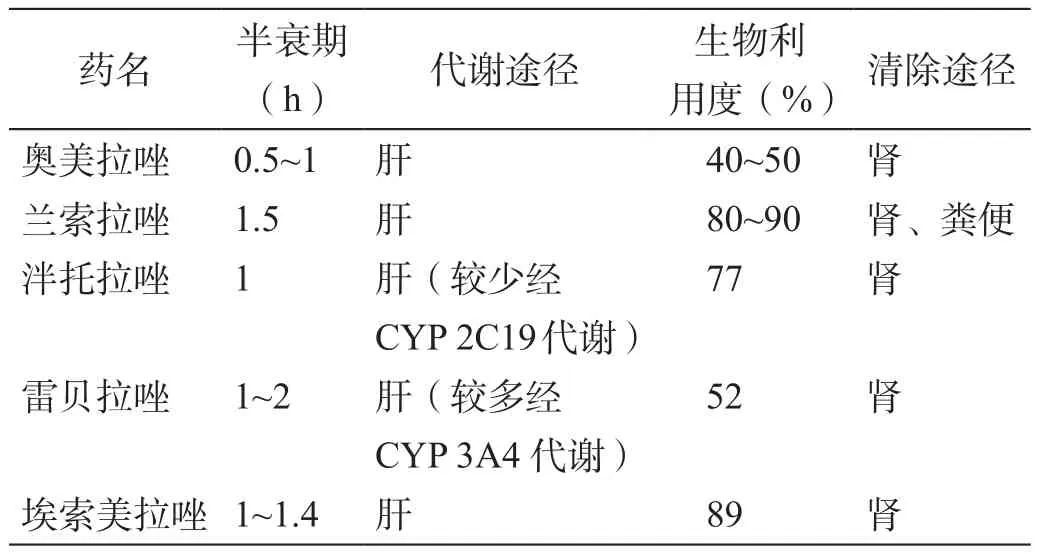
表2 不同质子泵抑制剂的药理学参数
1.3 质子泵抑制剂的抑酸特性
质子泵抑制剂有一些共同特点:①在酸性胃液中很不稳定,与胃酸接触后易于分解,故口服制剂必须外裹保护膜后服用才有效;②均从肠道中被吸收,与食物同服会影响药物的吸收速率;③被小肠吸收后在肝脏内代谢,经尿排泄;④对幽门螺杆菌有抑菌作用,可能与其改变了幽门螺杆菌生存的内环境、进而增强了抗菌药物的杀菌作用有关[15]。
质子泵抑制剂的抑酸特点与其和H+/K+-ATP酶结合部位的不同有关。奥美拉唑与H+/K+-ATP酶有2个结合部位,分别为第4~第6跨膜区的Cys813(或822)和第7~第8跨膜区的Cys892[16],其可选择性、非竞争性地抑制壁细胞膜中的H+/K+-ATP酶。兰索拉唑可与H+/K+-ATP酶的3个部位即第3跨膜区的Cys321、第4~第6跨膜区的Cys813(或822)和第7~第8跨膜区的Cys892结合,亲脂性较强,可迅速透过壁细胞膜转化为次磺酸和次磺酰衍生物而产生作用[17]。泮托拉唑与H+/K+-ATP酶的结合位点与奥美拉唑相同,但其生物利用度明显高于奥美拉唑,对壁细胞的选择性也更专一[18]。泮托拉唑经肝脏Ⅱ相代谢途径代谢,与CYP的相互作用较少,不影响其它药物(如氯吡格雷、华法林、苯二氮䓬类药物等)在肝脏内的代谢[19]。雷贝拉唑是一个部分可逆的H+/K+-ATP酶抑制剂,在酸性的壁细胞内活化,除具有与泮托拉唑相同的2个结合位点外,还能与Cys892和Cys321结合[20]。雷贝拉唑与其他药物的相互作用也较少。
50%的质子泵抑制剂离子化时的pH称为解离常数。胃内pH大于4时,胃蛋白酶活性明显降低,而降低胃蛋白酶活性是酸相关疾病防治的关键。质子泵抑制剂都是解离常数介于4~5的弱碱性药物。奥美拉唑、兰索拉唑、泮托拉唑、雷贝拉唑和埃索美拉唑的解离常数分别为 4.13、4.01、3.96、4.90 和 4.13[21-22]。
内在清除率用来描述肝脏在不受血流速度影响下清除药物的能力,也称肝固有清除率。代谢质子泵抑制剂的酶主要为CYP 2C19和CYP 3A4。与经CYP 2C19代谢相比,经CYP 3A4代谢的速率慢、药物清除也慢,故主要经CYP 3A4代谢的质子泵抑制剂在人体内的蓄积时间更长、药时曲线下面积(area under curve, AUC)也更大,抑酸效果较好。不同人群的CYP 2C19的活性差异很大。我们可以通过计算AUC慢代谢型对AUC快代谢型的比值来估计不同质子泵抑制剂对经CYP 2C19代谢的程度,该比值越小,说明经CYP 2C19代谢的程度越小[23]。研究发现,埃索美拉唑经CYP 3A4代谢的比例为27%、经CYP 2C19代谢的比例为73%,表明埃索美拉唑(奥美拉唑的左旋异构体)经CYP 3A4代谢的比例较奥美拉唑有所增加,因而个体间的差异更小、抑酸效果更稳定[24-27]。
构效关系、解离常数和内在清除率的差别会直接影响到质子泵抑制剂的起效时间和作用时间。服用标准剂量的埃索美拉唑、雷贝拉唑、奥美拉唑、兰索拉唑、艾普拉唑和泮托拉唑各5 d,胃内pH>4的日持续时间分别为 14.0、12.1、11.8、11.3、11.0 和 10.1 h[28]。
2 常用质子泵抑制剂的药理学特点
2.1 奥美拉唑
奥美拉唑是用于临床的第一个质子泵抑制剂,为单烷氧基吡啶衍生物,与胃黏膜壁细胞上的H+/K+-ATP酶有2个结合部位,可选择性、非竞争性地抑制H+/K+-ATP酶。奥美拉唑在体外无活性,进入壁细胞后会在氢离子的作用下依次转化成螺环中间体、次磺酸和次磺酰胺等形态。研究表明,次磺酰胺是奥美拉唑的活性代谢物,其能与H+/K+-ATP酶上的巯基共价结合形成二硫键,从而使H+/K+-ATP酶失活、产生抑酸作用。实际上,奥美拉唑是其活性形态次磺酰胺的前药。因次磺酰胺的极性太大、不能被人体吸收,也不稳定,故不能直接作为药物使用。而壁细胞可蓄积奥美拉唑并使之转化为活性代谢物,这使奥美拉唑成了次磺酰胺的理想前药。
口服奥美拉唑后一般l~3 h达到血浆峰浓度。单剂量口服奥美拉唑的生物利用度为40%~50%,重复给药7 d后的生物利用度增至60%。奥美拉唑在血浆中的清除很快,清除半衰期在l h内。奥美拉唑主要经肝脏完全代谢后排出,约有80%的代谢物经尿排出、约l8%由粪便排出。在人体中,奥美拉唑的主要代谢产物为磺基奥美拉唑和羟基奥美拉唑,另外有少量的硫醚、砜和羟基衍生物。在肝功能损害患者中,奥美拉唑的血浆清除半衰期延长至2.09~3.52 h;但在肾功能损害患者中,奥美拉唑的血浆清除半衰期没有明显变化。食物会延迟奥美拉唑的吸收,所以奥美拉唑应空腹服用。奥美拉唑在慢、快代谢型患者中的AUC明显不同,说明其代谢主要依赖CYP 2C19[28]。
2.2 兰索拉唑
兰索拉唑是继奥美拉唑后全球上市的第2个质子泵抑制剂。兰索拉唑的化学结构中含有氟取代的苯并咪唑侧链,生物利用度较奥美拉唑提高30%以上,且在H+/K+-ATP酶上有3个结合部位,亲脂性较强,可迅速透过壁细胞膜而转化为次磺酸和次磺酰衍生物、由此产生抑酸作用。兰索拉唑对幽门螺杆菌的抑菌活性也较奥美拉唑提高了4倍[29]。
2.3 泮托拉唑
泮托拉唑是全球上市的第3个质子泵抑制剂,具有较高的选择性和生物利用度,在临床上以安全性高而得到了医生和患者的认可。
泮托拉唑为二烷氧基吡啶衍生物,会在壁细胞小管中转化为嗜硫的环化次磺酰胺,然后与H+/K+-ATP酶结合并形成复合物、使H+/K+-ATP酶失活。泮托拉唑的生物利用度较奥美拉唑明显提高,对壁细胞的选择性更专一。泮托拉唑在肝脏内通过Ⅱ相代谢途径代谢,与CYP没有相互作用,不影响其他药物在肝脏内的代谢。泮托拉唑在弱酸性条件下的稳定性优于奥美拉唑和兰索拉唑[30]。
2.4 雷贝拉唑
雷贝拉唑是一个可逆性的质子泵抑制剂,具有较高的解离常数,口服后会在壁细胞内快速活化而产生抑酸作用。雷贝拉唑的代谢没有特异性的CYP同功酶,与其他药物的相互作用很少[31]。
2.5 埃索美拉唑
埃索美拉唑是奥美拉唑的左旋异构体,但其代谢与右旋异构体不同。右旋异构体绝大部分经CYP 2C19代谢为5-羟基物,而在埃索美拉唑的代谢产物中,5-羟基物占27%、5-氧-去甲基物占46%(两者均为CYP 2C19的代谢产物)、砜物占27%(是CYP 3A4的代谢产物)。与奥美拉唑的右旋异构体相比,埃索美拉唑的肝固有清除率较低(分别为42.5%和14.6%)。此外,埃索美拉唑通过CYP 3A4代谢的比例明显增加,在快、慢代谢型人群中的药代动力学差异减少,保证了临床疗效的稳定性和可预测性[25,32-33]。国内进行的一项随机临床研究比较了埃索美拉唑、奥美拉唑、兰索拉唑和雷贝拉唑治疗胃食管反流病的症状缓解率和食管炎愈合率,结果显示埃索美拉唑40 mg治疗组的症状缓解率达93.1%、食管炎愈合率达86.2%,疗效明显优于奥美拉唑、兰索拉唑和雷贝拉唑[34]。
3 结语
目前还有许多新的质子泵抑制剂正在研发中。此外,钾竞争性酸阻滞剂也已进入临床试验,一氧化氮释放相关的抑酸剂也处在临床前研发阶段[35]。相信这些药物的问世会给酸相关疾病治疗带来更多的临床选择。
[1] Shin JM, Kim N. Pharmacokinetics and pharmacodynamics of the proton pump inhibitors [J]. J Neurogastroenterol Motil,2013, 19(1): 25-35.
[2] Hagymási K, Müllner K, Herszényi L,et al. Update on the pharmacogenomics of proton pump inhibitors [J].Pharmacogenomics, 2011, 12(6): 873-888.
[3] 胡雅芳, 邵秀芬. 五种常用质子泵抑制剂前景及国内立项分析[J]. 齐鲁药事, 2011, 30(6): 353-354.
[4] Cianciolo G, Feliciangeli G, Comai G,et al. Protonic pump inhibitors in kidney transplant patients: efficacy and safety [J].Minerva Urol Nefrol, 2007, 59(2): 207-215.
[5] Hunfeld NG, Touw DJ, Mathot RA,et al. A comparison of the acid-inhibitory effects of esomeprazole and rabeprazole in relation to pharmacokinetics and CYP 2C19 polymorphism[J]. Aliment Pharmacol Ther, 2012, 35(7): 810-818.
[6] Li XQ, Andersson TB, Ahlström M,et al. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole, and rabeprazole on human cytochrome P450 activities [J]. Drug Metab Dispos, 2004, 32(8): 821-827.
[7] Sipeky C, Weber A, Szabo M,et al. High prevalence ofCYP2C19*2allele in Roma samples: study on Roma and Hungarian population samples with review of the literature[J]. Mol Biol Rep, 2013, 40(8): 4727-4735.
[8] Flockhart DA. Drug interactions and the cytochrome P450 system — the role of cytochrome P450 2C19 [J]. Clin Pharmacokinet, 1995, 29(Suppl 1): 45-52.
[9] Li H, Meng L, Liu F,et al. H+/K+-ATPase inhibitors: a patent review [J]. Expert Opin Ther Pat, 2013, 23(1): 99-111.
[10] Moreira Dias L. Pantoprazole: a proton pump inhibitor [J].Clin Drug Investig, 2009, 29(Suppl 2): 3-12.
[11] Pallotta S, Pace F, Marelli S. Rabeprazole: a secondgeneration proton pump inhibitor in the treatment of acidrelated disease [J]. Expert Rev Gastroenterol Hepatol, 2008,2(4): 509-522.
[12] Lim PW, Goh KL, Wong BC.CYP 2C19genotype and the PPIs — focus on rabeprazole [J]. J Gastroenterol Hepatol,2005, 20(Suppl): S22-S28.
[13] Baldwin CM, Keam SJ. Rabeprazole: a review of its use in the management of gastric acid-related diseases in adults [J].Drugs, 2009, 69(10): 1373-1401.
[14] Hrelja N, Zerem E. Proton pump inhibitors in the management of gastroesophageal reflux disease [J]. Med Arh, 2011, 65(1):52-55.
[15] Johnson DA, Stacy T, Ryan M,et al. A comparison of esomeprazole and lansoprazole for control of intragastric pH in patients with symptoms of gastro-oesophageal reflux disease [J]. Aliment Pharmacol Ther, 2005, 22(2): 129-134.
[16] Fock KM, Ang TL, Bee LC,et al. Proton pump inhibitors: do differences in pharmacokinetics translate into differences in clinical outcomes? [J]. Clin Pharmacokinet, 2008, 47(1): 1-6.
[17] Zvyaga T, Chang SY, Chen C,et al. Evaluation of six proton pump inhibitors as inhibitors of various human cytochromes P450: focus on cytochrome P450 2C19 [J]. Drug Metab Dispos, 2012, 40(9): 1698-1711.
[18] Sachs G, Shin JM, Briving C,et al. The pharmacology of the gastric acid pump: the H+/K+-ATPase [J]. Annu Rev Pharmacol Toxicol, 1995, 35: 277-305.
[19] Shin JM, Besancon M, Simon A,et al. The site of action of pantoprazole in the gastric H+/K+-ATPase [J]. Biochim Biophys Acta, 1993, 1148(2): 223-233.
[20] Fujisaki H, Oketani K, Shibata H,et al. Inhibitory action of E3810 on H+/K+-ATPase and gastric acid secretionin vitro[EB/OL]. [2013-06-12]. http://www.ncbi.nlm.nih.gov/pubm ed/?term=Inhibitory+action+of+E3810+on+H%2B%2FK%2 B-ATPase+and+gastric+acid+secretion+in+vitro.
[21] De Korwin JD, Ducrotté P, Vallot T. New-generation proton pump inhibitors: progress in the treatment of peptic acid diseases? [J]. Presse Med, 2004, 33(11): 746-754.
[22] Wurst W, Hartmann M. Current status of acid pump antagonists (reversible PPIs) [J]. Yale J Biol Med, 1996,69(3): 233-243.
[23] Cho H, Choi MK, Cho DY,et al. Effect ofCYP 2C19genetic polymorphism on pharmacokinetics and pharmacodynamics of a new proton pump inhibitor, ilaprazole [J]. J Clin Pharmacol, 2012, 52(7): 976-984.
[24] Lin CJ, Yang JC, Uang YS,et al. Time-dependent amplified pharmacokinetic and pharmacodynamic responses of rabeprazole in cytochrome P450 2C19 poor metabolizers [J].Pharmacotherapy, 2003, 23(6): 711-719.
[25] Schwab M, Klotz U, Hofmann U,et al. Esomeprazoleinduced healing of gastroesophageal reflux disease is unrelated to the genotype ofCYP 2C19: evidence from clinical and pharmacokinetic data [J]. Clin Pharmacol Ther,2005, 78(6): 627-634.
[26] Andersson T, Röhss K, Bredberg E,et al. Pharmacokinetics and pharmacodynamics of esomeprazole, theS-isomer of omeprazole [J]. Clin Pharmacokinet, 2001, 40(6): 411-426.
[27] Chong E, Ensom MH. Pharmacogenetics of the proton pump inhibitors: a systematic review [J]. Pharmacotherapy, 2003,23(4): 460-471.
[28] 彭安邦, 石巍, 廖爱军, 等. 埃索美拉唑治疗胃食管反流病与奥美拉唑对照研究[J]. 中华现代内科学杂志, 2005,2(4): 315-316.
[29] Wang X, Fang JY, Lu R,et al. A meta-analysis comparison of esomeprazole and other proton pump inhibitors in eradicatingHelicobacter pylori[J]. Digestion, 2006, 73(2-3): 178-186.
[30] Pallotta S, Pace F, Marelli S. Rabeprazole: a secondgeneration proton pump inhibitor in the treatment of acidrelated disease [J]. Expert Rev Gastroenterol Hepatol, 2008,2(4): 509-522.
[31] Devault KR. Pantoprazole: a proton pump inhibitor with oral and intravenous formulations [J]. Expert Rev Gastroenterol Hepatol, 2007, 1(2): 197-205.
[32] McKeage K, Blick SK, Croxtall JD,et al. Esomeprazole: a review of its use in the management of gastric acid-related diseases in adults [J]. Drugs, 2008, 68(11): 1571-1607.
[33] Edwards SJ, Lind T, Lundell L. Systematic review proton pump inhibitors (PPIs) for the healing of reflux oesophagitis— a comparison of esomeprazole with other PPIs [J]. Aliment Pharmacol Ther, 2006, 24(5): 743-750.
[34] 徐欣萍, 杨昭徐. 4种质子泵抑制剂治疗胃食管反流病的临床观察[J]. 中国新药杂志, 2008, 17(1): 73-74.
[35] Scarpignato C, Hunt RH. Proton pump inhibitors: the beginning of the end or the end of the beginning? [J]. Curr Opin Pharmacol, 2008, 8(6): 677-684.
