樟树叶多酚超声波法提取工艺的响应面优化
2013-04-03周海旭李忠海钟海雁李文清
周海旭,李忠海,钟海雁,张 慧,李文清
(中南林业科技大学 食品科学与工程学院,湖南 长沙 410004)
近年来,有关研究结果表明,多酚类物质具有抗氧化、抗脂质氧化、抗菌、抗病毒、预防心血管疾病、防癌、抗辐射等生物活性[1-5],还具有灭菌或防治病虫害的功效,因此可用以生产抑菌剂或防腐剂而被用于食品加工和运输等行业中[6]。樟树作为常见的经济林树种,其叶子中含有丰富的多酚类物质,通常将樟树叶中的多酚类物质称为樟树多酚[7]。
超声波可以破坏细胞的细胞壁,改善目标产物的选择性,增加提取率,在天然产物提取中显示出了明显的优势[8],超声波提取法具有能缩短提取时间、提高有效成分得率且保护热敏性成分等优点,现在越来越多地被应用于植物有效成分的提取[9]。为了研究以超声波法提取樟树多酚的最优工艺条件,笔者用Folin-ciocalteus法测定樟树多酚,该法灵敏度较高,简便易行[10],并以乙醇为提取剂,采用响应面分析[11]方法,就提取时间、料液比和乙醇浓度对樟树多酚提取量的影响问题进行了试验,建立了超声波提取樟树多酚的数学模型,从而获得了樟树多酚超声波提取的最优工艺条件。
1 材料与方法
1.1 材料与试剂
试验用的樟树叶于2011年5月采自中南林业科技大学,将新鲜树叶晒干后粉碎以备用。
1.2 主要仪器
电子天平,上海浦春计量仪器有限公司;HWS26型电热恒温水浴锅,上海一恒科学仪器有限公司;JY92-11超声波细胞粉碎机,宁波新芝生物科技股份有限公司;紫外分光光度仪,岛津公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司。
1.3 试验方法
1.3.1 标准曲线的绘制
准确称取焦性没食子酸1 g,溶解并定容于100 mL的容量瓶中以备用。分别量取4、8、12、16、20 mL的标准液加入到100 mL的容量瓶中,再分别加入60 mL的蒸馏水,充分混合3 min;再分别加入酚试剂5 mL和20 %无水碳酸钠15 mL,充分混合1 min后定容。于70 ℃水浴,保持时间为10 min,冷却至室温后,在波长为760 nm的条件下测定吸光度[12]。根据不同浓度的标准液及吸光度绘制如图1的标准曲线。测定的标准曲线回归方程为:上式中:x为标准液的浓度(mg/L),y为吸光度。
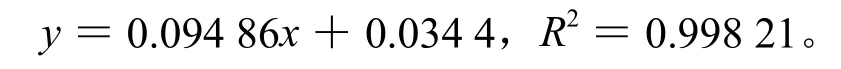
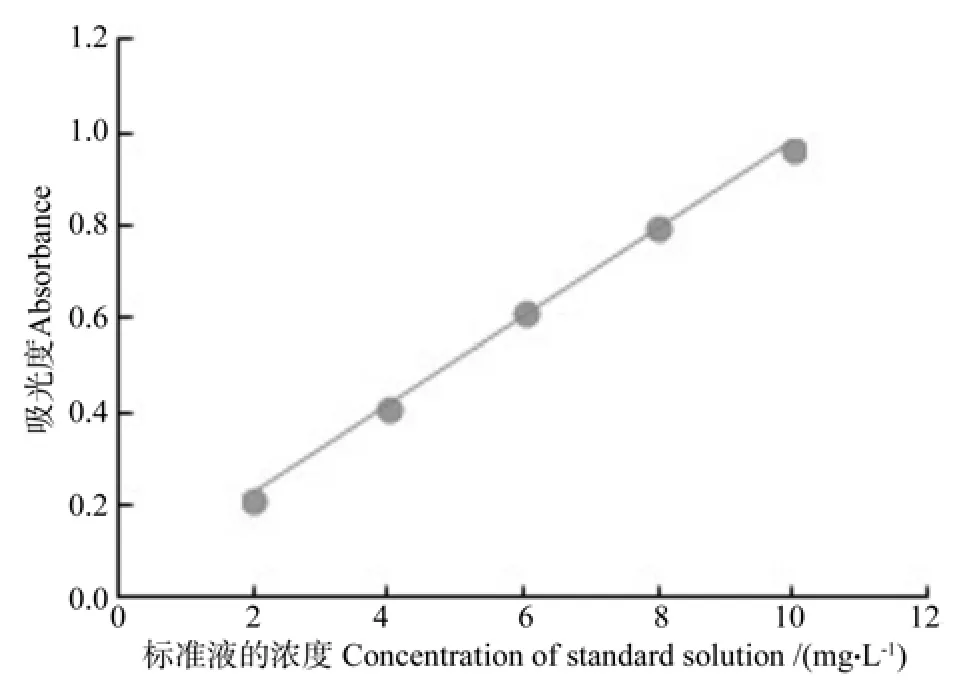
图1 测定多酚含量的标准曲线Fig.1 Standard curve of polyphenols content
1.3.2 单因素试验
通过单因素试验分别考察超声提取时间、料液比、乙醇浓度这3个因素对樟树多酚浓度的影响情况,确定各个试验因素的最优水平,从而为响应面分析试验提供参考依据。
1.3.3 响应面分析
采用Design-Expert 8.0.7软件中的中心组合试验设计原理进行响应面试验设计。根据单因素试验结果,确定乙醇浓度、提取温度和液料比3个因素,以樟树叶多酚含量为响应值。试验因素及水平见表1。

表1 樟树叶多酚提取的响应面试验因素与水平Table 1 Factors and levels of response surface experiment of polyphenols extraction in Cinnamanum camphoral
1.4 数据计算公式
樟树多酚的提取量 (mg)=提取液的体积×樟树叶多酚浓度×100×10-3×2;
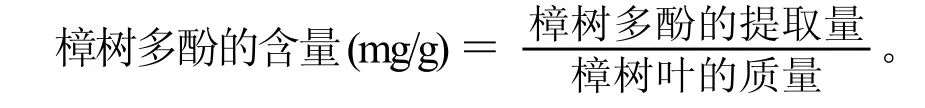
上列两式中:提取液的体积单位为mL,多酚的浓度单位为mg/L。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 超声提取时间对提取的樟树多酚浓度的影响
超声提取时间对提取的樟树多酚浓度的影响情况如图2所示。从图2中可以看出,当超声波提取时间为25 min左右时,提取液中的多酚浓度最大;而当提取时间继续延长时,提取液中的多酚浓度却随之下降。这可能因为随着时间的延长多酚物质被氧化,或者发生其他的化学反应而使得多酚浓度下降。
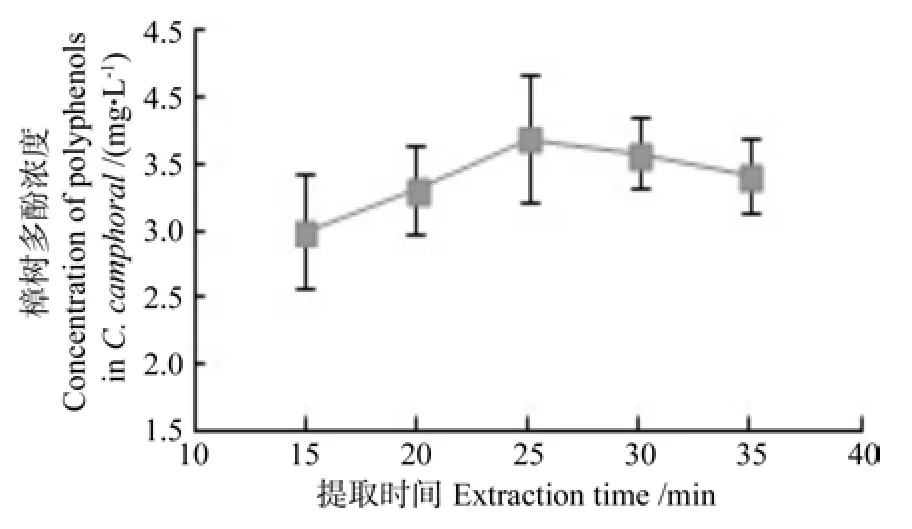
图2 提取时间对樟树多酚提取浓度的影响Fig.2 Effect of extraction time on concentration of extracted polyphenols in Cinnamanum camphoral
2.1.2 料液比对提取的樟树多酚浓度的影响
料液比对提取的樟树多酚浓度的影响情况如图3所示。从图3中可以看出,提取的樟树多酚浓度随着料液比的增加而增加,当料液比为1∶30左右时,提取液中的多酚浓度最大,之后随着料液比的增加提取浓度却稍微减小。考虑到成本与所提取的樟树多酚浓度,故选用1∶30的料液比。

图3 料液比对樟树多酚提取浓度的影响Fig.3 Effect of solid-liquid ratio on concentration of extracted polyphenols in Cinnamanum camphoral
2.1.3 乙醇浓度对提取的樟树多酚浓度的影响
乙醇浓度对提取的樟树多酚浓度的影响情况如图4所示。从图4中可以看出,随着乙醇浓度的增加,樟树多酚的提取浓度也随之增加。当乙醇浓度为60%时,多酚浓度达到最大值;但之后随着乙醇浓度的增加,樟树多酚的提取浓度反而趋于平缓。其原因可能是,随着乙醇浓度的增加,多酚类物质在乙醇溶液中的溶解度增加,当乙醇浓度达到60%以后,溶液极性增加,导致多酚类物质的溶解度下降[13],所以选择浓度为60%的乙醇作为提取溶剂。
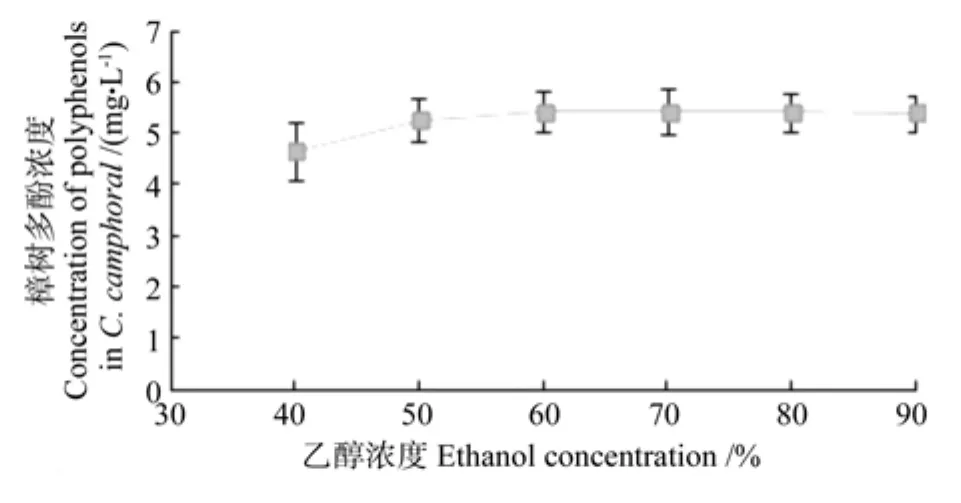
图4 乙醇浓度对樟树多酚提取浓度的影响Fig.4 Effect of ethanol concentration on concentration of extracted polyphenols in Cinnamanum camphoral
2.2 樟树叶多酚提取响应面法优化分析
2.2.1 超声波提取樟树多酚的模型建立
响应面试验共设有17组试验,其中有12个分析点、5个中心点试验。采用响应面分析法分析试验结果,得到了如下的以多酚含量为响应值的数学模型:
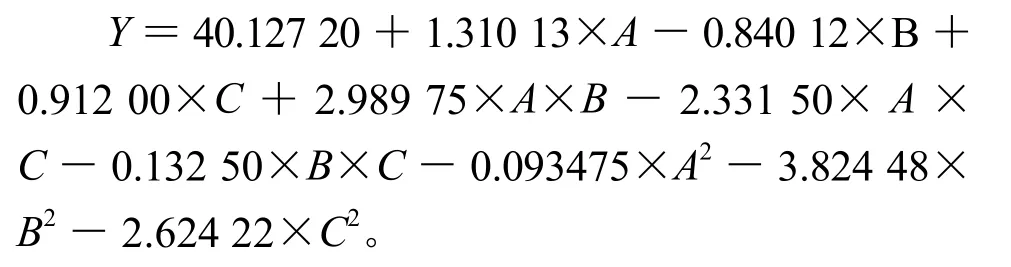
式中:Y表示樟树多酚提取量的预测值,A、B、C分别表示提取时间、乙醇浓度、料液比的数值。
采回归方程中各变率对响应值影响的显著性,由F检验来判定,“Prob>F”值小于0.05级表示该指标显著。模型回归方程方差分析结果如表2所示。由表2可知,模型P值<0.01,表明该二次方程的模型极为显著[14],可利用该模型来预测分析以超声波提取的樟树多酚的含量。提取时间(A)对樟树多酚含量的影响是极显著的,乙醇浓度(B)、料液比(C)对樟树多酚含量的影响也具有显著性,A和B的交叉因素、A和C的交叉因素对樟树多酚含量的影响也具有显著性。借助数据分析软件对数学模型进行优化,最终得出的樟树多酚超声波提取的最优工艺条件为:超声提取时间25 min、乙醇浓度60%、料液比1∶40。在此工艺条件下获得的多酚含量为40.794 mg/g。
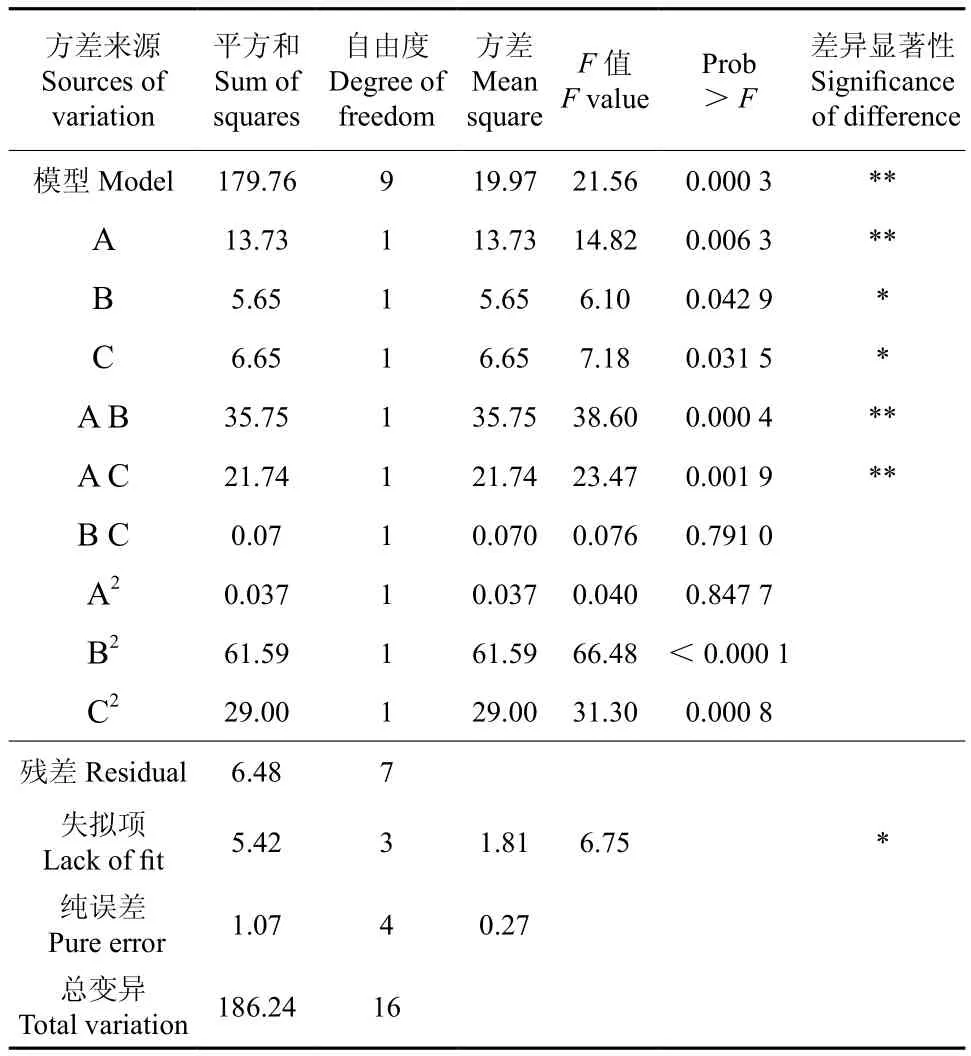
表2 樟树多酚含量的ANOVA分析结果Table 2 ANOVA analysis of content of extracted polyphenols in Cinnamanum camphoral
2.2.2 超声波提取樟树多酚各影响因素的交互作用
响应面图形是响应值对试验因子A、B、C所构成的三维空间曲面图,从响应面分析图中可以看出最佳参数及各参数之间的相互作用情况。根据回归方程作出不同试验因素的响应面分析图(见图5~7)[15],图5~7可以直观地反映出两个变量交互作用影响的显著程度。因为极值条件出现在等高线的圆心处,从图5~7中可以看出,B与C的等高线图最圆,说明乙醇浓度和料液比之间的交互作用对樟树多酚含量的影响最小;而等高线图越扁平,则表示试验因素之间交互作用的影响越大[16]。
提取时间(A)与乙醇浓度(B)对樟树多酚交互作用的响应面图见图5。由图5可知,随着提取时间的增加樟树多酚的含量呈逐渐增加的变化趋势,所以提取时间可选择25 min。当提取时间固定为25 min时,樟树多酚的含量随着乙醇浓度的增加呈现出先增加后减少的变化趋势;当乙醇浓度为60%左右时,樟树多酚的含量达到本试验的最大值。这一试验结果表明,乙醇浓度与提取时间二者的交互作用对樟树多酚的含量的影响较大。
提取时间和料液比对樟树多酚交互作用的响应面图见图6。由图6可知,随着提取时间和料液比的增加樟树多酚含量也逐步增加。因此,料液比应选择1∶40,超声提取时间和料液比二者的交互作用对樟树多酚含量的影响较大。
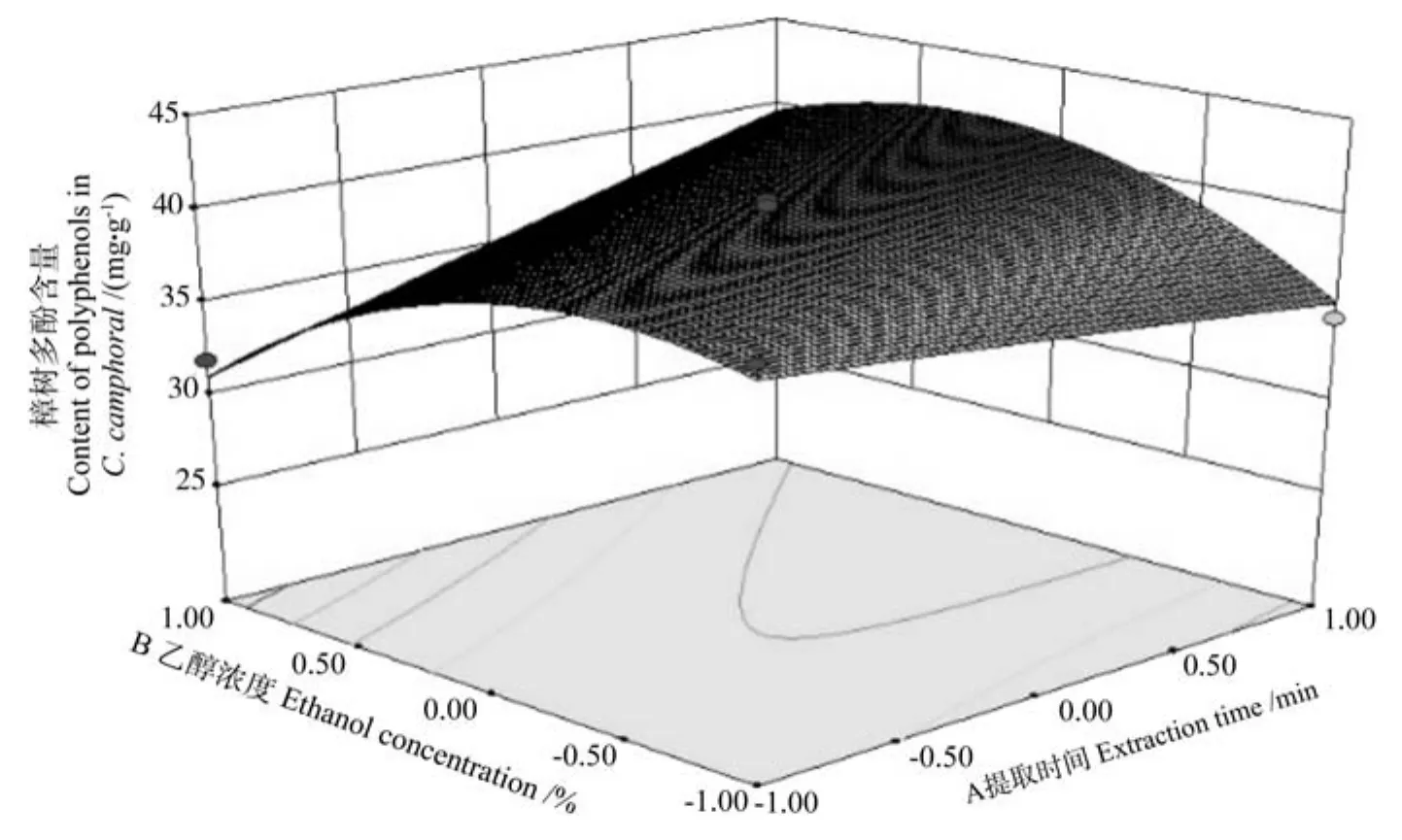
图5 提取时间(A)与乙醇浓度(B)对樟树多酚含量交互作用的响应面图Fig.5 Response surface plot of interaction of extraction time (A) and ethanol concentration (B) on content of extracted polyphenols in Cinnamanum camphoral
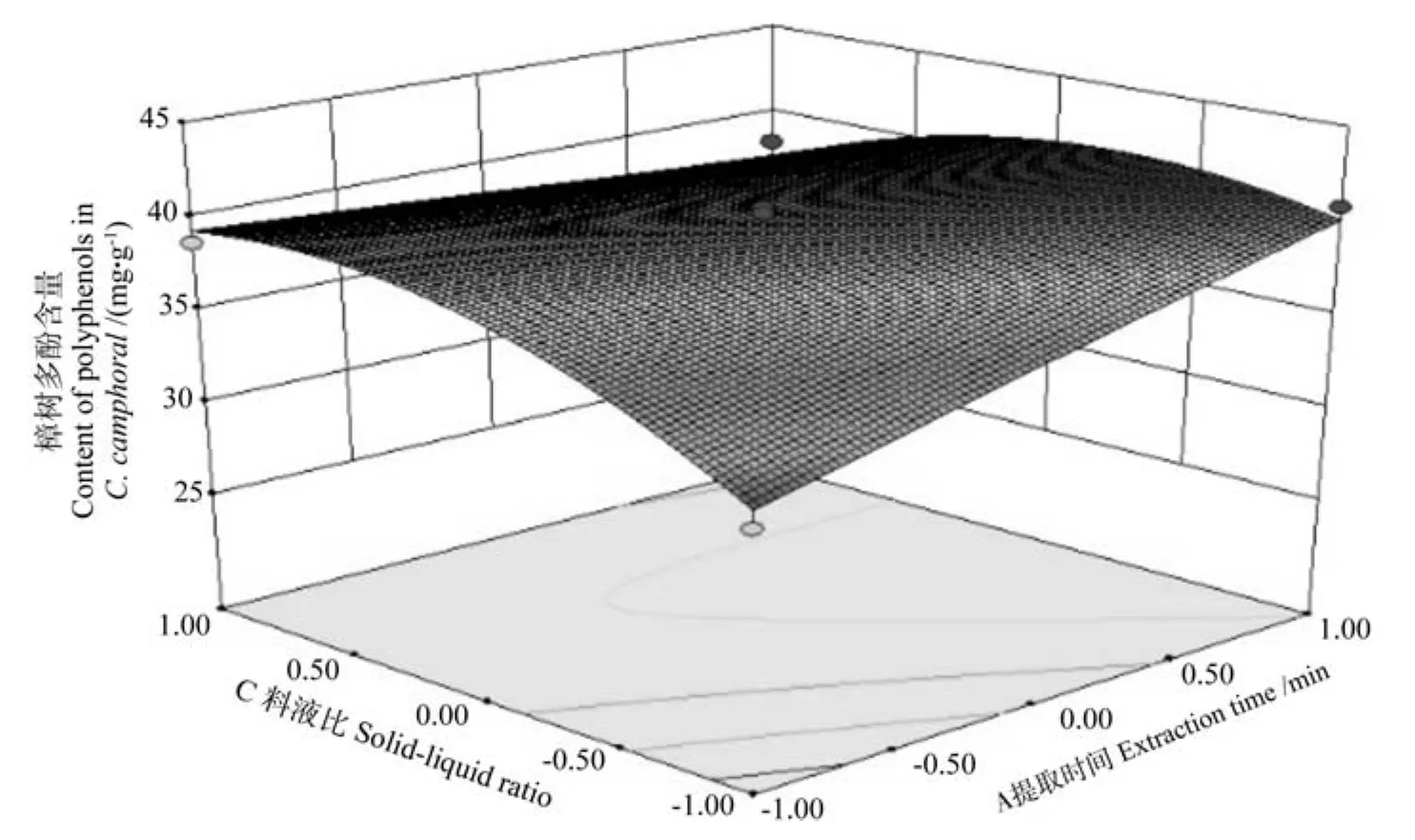
图6 提取时间和料液比对樟树多酚含量交互作用的响应面图Fig.6 Response surface plot of interaction of extraction time and solid-liquid ratio on content of extracted polyphenols in Cinnamanum camphoral
乙醇浓度和料液比对樟树多酚交互作用的响应面图见图7,由图7可知,樟树多酚的提取量随着乙醇浓度和料液比的增加呈现出先增加后减小的变化趋势,乙醇浓度和料液比二者的交互作用对樟树多酚含量的影响较小。
3 结 论
本试验采用响应面法[17]分析了乙醇浓度、提取时间和料液比对樟树多酚超声波提取效率的影响情况,最终确定的樟树多酚超声波提取的最优工艺条件为:提取时间25 min,料液比1:40,乙醇浓度60%。在此工艺条件下,樟树多酚的含量为40.794 mg/g。
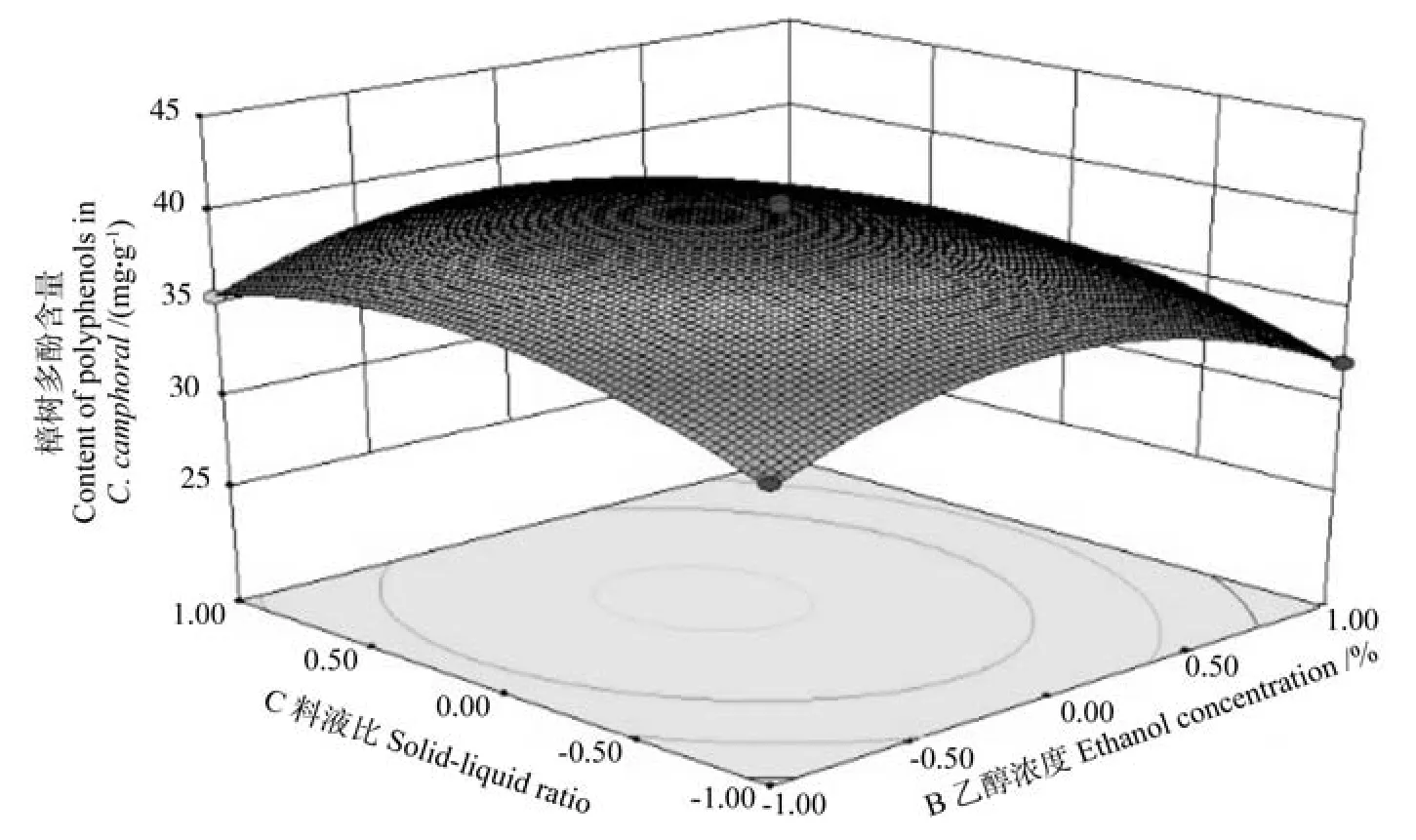
图7 乙醇浓度与料液比对樟树多酚含量的交互作用响应面图Fig.7 Response surface plot of interaction of ethanol concentration and solid-liquid ratio on content of extracted polyphenols in Cinnamanum camphoral
参考文献:
[1] 何志勇,夏文水.橄榄多酚的提取研究[J].林产化学与工业,2007, 27(1):77-80.
[2] 宋立江,狄 莹,石 碧,等.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161-171.
[3] 林璎姬,赵 萍,王 雅.植物多酚的提取方法和生物活性研究进展[J].山西农业科学,2009,(6):105-108.
[4] 尹志娜.植物多酚分离提取方法和生物功能研究进展[J].生命科学仪器,2010,8(6):43-50.
[5] 孙广欣,齐艳玲,关学敏,等.玉兰多酚提取条件的筛选[J].经济林研究,2010,28(1):115-117.
[6] 王 明,李阿娜,张伟伟,等.园林植物叶片中多酚及总黄酮含量与病虫害的关系[J].经济林研究,2010,28(2):42-48.
[7] 李 涛,岳田利,袁亚宏.苹果多酚提取的响应曲面法优化研究[J].食品科技,2007,32(8):118-121.
[8] 龙 跃,王 超,王武鹏,等.超声波提取雀儿舌头多酚物质的工艺研究[J].郑州大学学报:工学版,2012,33(1):64-68.
[9] 王婧杰,马凤鸣,穆立蔷.用响应面法优化超声波辅助提取紫椴枝皮中的黄酮[J].经济林研究,2010, 28(1):115-117.
[10] 郑仕宏,张海德,何 双,等.Folin-ciocalteus法测定槟榔中多酚含量的研究[J].中南林业科技大学学报,2009,29(6):165-169.
[11] 慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[12] 陈海光,刘朝霞,于立梅.山竹果皮中多酚类物质的抗氧化性研究[J].食品工业科技,2011, 32(9):107-115.
[13] 胡明明,张国文,何 力.响应面法优化超声提取花生壳多酚[J].南昌大学学报:理科板,2011,35(3):241-246.
[14] 吕 杰,钟海雁,袁英姿,等.油茶籽多酚微波辅助提取响应面法的优化[J].经济林研究,2010,28(3):40-44.
[15] 于 帅,杜 彬,杨越冬,等.用响应面法优化微波辅助提取栗仁中多酚物质[J].经济林研究,2011,29(3):8-16.
[16] 王茂生,梁俊玉,高 莹,等.响应面法优化超声辅助提取核桃叶多酚的工艺研究[J].食品工业科技, 2012, 33(7):311-314.
[17] Reza T, Ashraf N.Optimization of ultrasonic-assisted extraction of natural antioxidants from rice bran using response surface methodology [J].Ultrasonics Sonochemistry, 2011,18(6): 1279-1286.
