云南野生中华猕猴桃PGIP基因的克隆与分析
2013-04-03刘小珍刘惠民张汉尧
于 瑶,刘小珍,刘惠民,张汉尧
(西南林业大学 西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
猕猴桃是原产于我国的野生多年生藤本落叶植物,属于猕猴桃科Actinidiaceae猕猴桃属Actinidia,是当前世界新兴的果树之一。猕猴桃属共有66个种,约有118个种下分类单位(变种、变型)[1]。猕猴桃与中美洲鳄梨、美国东部越桔及澳洲坚果同为20世纪人工驯化栽培成就最大的四大野生果树树种,因其具有很高的实用价值,而且耐贮藏,近几年在世界各地得到了迅速的发展[2-6]。
多聚半乳糖醛酸酶抑制蛋白(polygalacturonase inhibiting protein, PGIP)广泛存在于双子叶植物细胞壁中,富含亮氨酸区域,能够非竞争性地抑制多种真菌的多聚半乳糖醛酸酶的活性,干扰灰霉菌等种真菌病害对植物组织的侵染过程,从而抑制这些真菌病害的发生。它能与多聚半乳糖醛酸酶(PG polygalacturonase)结合,从而降低和抑制该酶的活性并且诱导寡聚糖的形成,因而在植物的防御反应中起着重要的作用[7-12]。而克隆和分析某一功能基因可从分子水平上了解其结构,并可为直接利用该功能基因打下基础,在经济林中目前已有许多基因被克隆和分析[13-16]。自1993年首次从未成熟的树莓果实中分离和纯化到PGIP蛋白至今已有越来越多的植物PGIP基因被人们所克隆和分析[17]。到目前为止,国内外科学家先后从苹果、梨、杏、樱桃、大豆、番茄、马铃薯等25 属45 种植物中克隆到了PGIP基因或片段,并对其进行了分析[8,18-23]。为了利用云南野生猕猴桃抗病能力强的优良特性,为后续的基因功能确证及猕猴桃品种改良奠定重要的分子生物学基础,本实验利用同源序列克隆法,从云南野生中华猕猴桃Actinidia chinensis中成功克隆了PGIP基因的完整编码序列,并对克隆出的基因片段进行了如氨基酸序列的结构域和功能域分析、亲疏水性分析、跨膜结构分析及蛋白质高级结构预测等方面的生物信息学分析,探讨了它与其它品种或物种同源基因的相似性,并构建了系统进化树,以期为猕猴桃种质改良和抗病研究奠定基础。
1 材料与方法
1.1 植物材料
供试材料为云南省农业科学院园艺作物研究所收集的云南野生中华猕猴桃叶片和果实。取样后用液氮速冻并存于-70 ℃的冰箱中以备用。
1.2 生化试剂
UNIQ-10柱式Trizol总RNA抽提试剂盒,购自上海生工生物工程技术服务有限公司;DNA片段快速纯化/回收试剂盒,购自上海生工生物工程有限公司;cDNA 反转录试剂,购于北京百泰克生物技术有限公司;2×Power Taq PCR MasterMix,购自北京百泰克生物技术有限公司。
1.3 cDNA的制备
参照有关文献[24]中的方法,利用UNIQ-10柱式Trizol总RNA抽提试剂盒,分别取1.5 g果肉、果皮和大约0.1 g叶片提取云南野生中华猕猴桃不同组织的高质量RNA,取5 μg总RNA,按照反转录试剂盒(Rever-tAidTMFirst Strand cDNA Synthesis kit,MBI,USA)的说明合成第 1链cDNA,经琼脂糖凝胶电泳检测后,用于后续基因片段的扩增和验证。
1.4 RT-PCR
根据GenBank中登录的PGIP基因序列,采用Primer Primer 5软件,确定了特异扩增引物,进行PCR扩增。上游、下游引物分别为:上游引物1为5’-GAGTACTACTGCCATTTCCC-3’,下游引物1为5’-GCGAGACATCAATCACTGTG-3’;上游引物 2 为5’-ATGAAGGCCAGTTTTTTTGGGAGAC-3’,下游引 物 2 为 5’-GCGAGGTAACGGCCTGAGGTTCATT-3’。按照2×Power Taq PCR MasterMix 说明书的要求确定的PCR反应体系如下:2×MasterMix 25 μL,上游 Primer(10 μM)2 μL,下游 Primer(10 μM)2 μL,模板 2 μL,ddH2O 加至 50 μL。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性30 s;退火1 min;72 ℃延伸1 min,循环35次;最后72 ℃延伸7 min。用第1次PCR产物作为模板进行2次PCR,继续扩增。PCR产物经1.2%琼脂糖凝胶电泳(含0.5 μg·mL-1的溴化乙锭),电压为3~5 V/cm,用凝胶成像系统观察结果,并照像记录。
1.5 测序结果的生物信息学分析
PCR产物经纯化后送上海生工生物工程有限公司进行测序,并将测序得到的核酸序列和推导的氨基酸序列在NCBI上分别用BLASTn和BLASTp进行序列相似性分析和功能域分析;然后进行氨基酸组分分析、亲疏水性分析、信号肽分析、跨膜区分析和结构域分析。用Genbank数据库中收录的各物种的PGIP基因序列进行多序列比对,并通过邻接算法(N-J法)完成系统进化树的构建。用TreeView软件观看输出的无根进化树。
2 结果与分析
2.1 核酸序列组分分析
利用试验中提取的云南野生猕猴桃总RNA作为模板合成cDNA,再以cDNA为模板进行多次PCR特异性扩增,扩增产物用1.2%的琼脂糖凝胶电泳检测,获得特异条带,其大小与预期的一致。送检测序后,运用BioEdit软件进行拼接并分析,结果表明:该片段编码区长度为996 bp;分子量为304.4 kDa(单链状态)和605.3 kDa(双链状态);GC含量48.19%;AT含量51.81%。
2.2 理化性质与蛋白信息学分析
利用ProtParam tool软件进行分析,结果表明:该蛋白的分子量为37 kDa;理论等电点pI为8.95;总共包括5 194个原子;其分子式为C1659H2608N434O481S12;在组成该蛋白的20种氨基酸中,亮氨酸(L)所占比例最高,达到15.1%,而谷氨酸(E)多占比例最低,为0.3%,该蛋白的不稳定指数为28.44,脂肪指数为98.64;该蛋白为稳定蛋白。经SignalP 4.0软件预测,该PGIP蛋白的N端具信号肽结构,表明该蛋白为分泌蛋白,含有由25个氨基酸组成的N端信号肽,断裂位点位于第26个氨基酸与第28个氨基酸之间(如图1所示)。
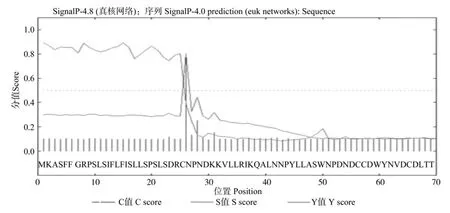
图1 PGIP氨基酸序列信号肽预测结果Fig.1 Prediction of the signal peptide of amino acids sequences in PGIP
利用TargetP 1.1 Server-prediction软件进行分析,结果表明:SP分值最高为0.556,预测结果为定位信号肽;基于上面分析预测的“Loc”可能定位为S 分泌通路即分泌到细胞周质;RC可靠级别为3级(0.600>diff>0.400);TPlen预测剪切位点序列长度为25个氨基酸。利用TMHMM软件进行分析,结果表明:该蛋白的332个氨基酸均位于膜表面,该蛋白没有跨膜结构;蛋白质分子的基本特性之一是,亲水的极性部分在分子的表面,而疏水的非极性部分在分子内部。运用ProtScale和BioEdit软件进行分析,结果表明:该蛋白大约在15~20位氨基酸之间有一个典型的疏水性区域,在25~30位氨基酸之间还有个明显的疏水性区域。运用NCBI在线分析软件(http://www.ncbi.nlm.nih.gov.blast/)进行分析,结果表明:该PGIP基因片段含有一个cl08472超家族结构域,该结构N末端富含亮氨酸重复结构域,往往是两侧的半胱氨酸丰富域。这是典型的植物抗病基因特征结构。
2.3 蛋白质结构预测
利用PSIPRED软件进行分析,结果表明:PGIP基因部分肽段存在一个α-螺旋和卷曲螺旋区域及若干个β-折叠片区。α-螺旋和卷曲螺旋是PGIP基因肽段的主要组成部分。通过SWISSMODEL同源建模预测分析,预测到了其三维结构(见图2),该区域含有一个明显的Rossman折叠,其中α-螺旋处于β-折叠片的上侧。该蛋白由31.02%的α-螺旋、48.49%的随机卷曲、3.61%的β-转角和16.87%的β-折叠组成。
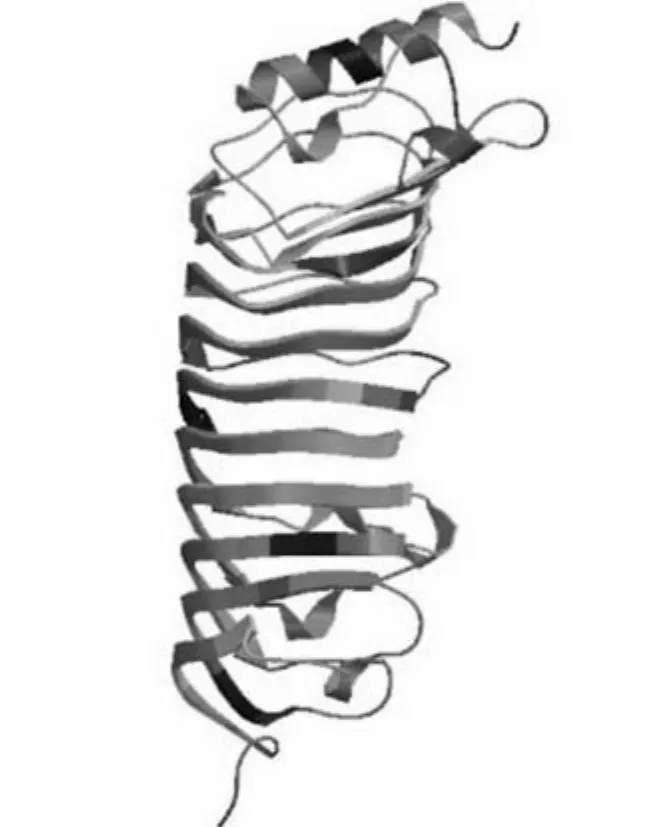
图2 PGIP蛋白质二级结构预测结果Fig.2 Prediction of secondary structure of PGIP protein
2.4 序列对比分析
利用BLAST引擎从NBCI搜索并下载同源的PGIP基因核酸序列,经过比对分析,结果表明:该基因与美味猕猴桃PGIP基因的同源性高达98%;其与越桔灌蓝莓Vaccinium corymbosum(FJ347133)PGIP基因的同源性为78%;与小山本 葡 萄Vitis thunbergii(EU037367、JF832387、JF832388)PGIP基因的同源性为73%;与葡萄Vitis vinifera(AF499451)PGIP基因的同源性为73%。系统进化树分析结果(见图3)表明:云南野生种猕猴桃和美味猕猴桃的亲缘关系最近,与越桔灌蓝莓的PGIP基因的同源性较近。
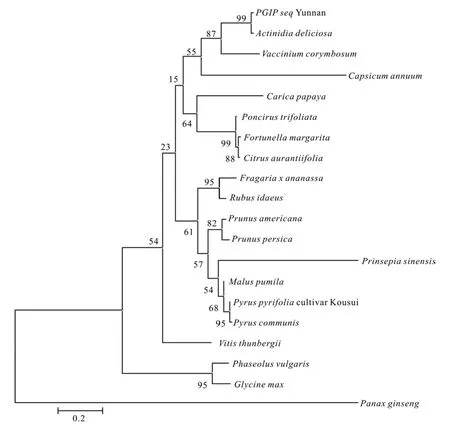
图3 PGIP基因序列进化树Fig.3 Phylogenetic tree of PGIP sequences from different species
3 讨 论
PGIP蛋白大多由信号肽、氨基端、亮氨酸富集区和羧基端四部分组成,其中亮氨酸富集区由多个重复的LRR组成。LRR结构域被认为是R基因的功能区域,是植物抗病基因(R gene)的特征结构,笔者在研究中也发现了同样的特征结构。生化分析结果表明:该段序列在二级结构上能形成发夹状的β-α单位结构,有利于蛋白质间的结合。进一步研究还发现,该保守性特别强的区域是PGIP蛋白和endo-PG蛋白间相互作用的结构域,所以该段序列也常作为PGIP基因克隆时引物设计的靶序列[25]。所有PGIP蛋白的N端都含有一个疏水性的信号肽段,这使其将靶向内膜系统输出到胞外空间,而且信号肽的剪切位点也是保守的,均在Ser后剪切[26],我们的研究结果也支持了这一结论。
PGIP是特异性的抑制剂,对病原菌endo-PG活性抑制的专一性特别强,其抑制强度因不同病原物分泌的PGs 不同而不同[27]。在对大豆PGIP的研究中发现,功能区单个氨基酸的改变就会致使PGIP对病原菌的PG的识辨能力发生很大的变化,同一植物的PGIP基因家族的不同成员对同一病原菌endo-PG活性的抑制作用也存在差异,大豆PGIP基因家族中至少有5个成员,其中2个对病原菌Fusarium moniliforme和Aspergillus niger分泌的PG的抑制力均存在明显差异,这证实了PGIPs 能够特异识别不同的PGs[28]。本研究获得的PGIP基因,是猕猴桃PGIP基因家族的一员,对猕猴桃某一类型的病原菌可能有较好的抗病效果,应该具有一定的应用前景。
4 结 论
通过多次PCR分析获得了云南野生中华猕猴桃PGIP基因的一个996 bp的目的片段,其为一个完整的开放阅读框,编码332个氨基酸。经核苷酸序列同源性分析,该片段与其它植物中的PGIP基因有很高的同源性,和美味猕猴桃的同源性最高(达99%)。另外,文中通过生物信息学分析,还对这个基因的编码区、核苷酸序列和氨基酸序列进行了系统的分析,并推测了其蛋白质结构,这为猕猴桃种质改良和抗病育种的研究奠定了基础。
参考文献:
[1] 黄宏文.猕猴桃研究进展[M].北京:科学出版社,2000:65-79.
[2] 宋圃菊,唐 仪,俞锡璇.猕猴桃浓缩果汁中抗坏血酸在人体的利用[J].营养学报,1984,6(l):35-40.
[3] 宋圃菊,Tannenbaum SR.中华猕猴桃的防癌作用[J].营养学报,1984,6(2):25-30.
[4] WARRINGTON I J, WESTON G C.Kiwifruit, Science and Management[M].New Zealand: Society for Horticultural Science,1990, 193-204.
[5] 朱道圩.猕猴桃遗传育种研究现状及展望[J].河南农业大学学报,1995,29(4):326-328.
[6] FERGUSON A R, BOLLARD E G.Domestieation of the kiwifruit[C]//WARRINGTON I J, WESTON G C.Kiwifruit:Seienee and Management.Ithaca: Ray Richards Publisher,1990:165-246.
[7] DESIDERIO A, ARACRI B, LECKIE F,et al.Polygalacturonase inhibiting proteins (PGIPs) with different specificities are expressed inPhaseolus vulgaris[J].Mol Plant-Microbe Interact,1997, 10: 852-860.
[8] YAO C L, CON W S, SAMS C E.Puri fi cation and characterization of a polygalacturonase inhibiting protein from apple fruit [J].Biochemistry and Biology, 1995,85(11):1373-1377.
[9] 万 琳,周 立.小麦多聚半乳糖抑制蛋白的部分结构[J].中国生物化学与分子生物学报,2002,18(2):197-201.
[10] SHARROCK K R, LAVACITCH J M.Polygalacturonase inhibitors of Bartlett pear fruits: differential effects onBotrytis cinereapolygalacturonase isozymes, and in fl uence on products of fungal hydrolysis of pear cell walls and on ethylene induction in cell culture [J].Physiol Mol Plant Pathol,1994,45:305-319.
[11] MOHAMED F, TOMOKO S, LYDIA A F,et al.Polygalacturonase inhibiting protein (PGIP) from Japanese pear: possible involvement in resistance against scab [J].Physiol Mol Plant Pathol, 2003,63:319-327.
[12] 张 丽,哈斯阿古拉,张竞秋,等.甜瓜多聚半乳糖醛酸酶基因cDNA的克隆和序列分析[J].内蒙古大学学报(自然科学版),2003,34(3):304-307.
[13] 龙洪旭,谭晓风,张 琳,等.油桐亲环素基因全长cDNA的克隆及序列分析[J].中南林业科技大学学报, 2011, 31(12):111-117.
[14] 刘 凯,谭晓风,龙洪旭,等.油茶DGAT1基因的全长cDNA序列克隆及分析[J].中南林业科技大学学报, 2012,32(4): 148-152.
[15] 谢禄山,谭晓风,张 琳,等.油桐种子FAD2基因全长cDNA序列分析[J].经济林研究,2012,30(2):1-9.
[16] 邬萌萌,谭晓风,周 荣.油茶EMF2基因的全长cDNA克隆及序列分析[J].经济林研究,2013,31(2):7-12.
[17] WILLIAMSON B, JOHNSTON D J J, RAMANATHAN V J.A polygalacturonase inhibitor from immature rasperberry fruits:a possible new approach to grey mou1d control [J].Acta Hort,1993, 352: 601-605.
[18] STOTZ H U, POWELL A L T, DAMON S E,et al.Molecular characterization of a polygalacturonase inhibitor fromPyrus communis[J].Barlett Plant Physiol, 1993, 102: 133-138.
[19] Puehringer H, Laimer D A, Cama R E,et al.Identi fi cation and characterization of an apricot gene coding for polygalactouronase inhibiting protein [J].Plant physiol, 1998, 118 (4): 41-48.
[20] 张开春,张军科.马哈利樱桃PGIP基因克隆及全序列测定[J].农业生物技术学报,2000,8(3): 281-283.
[21] FAVARON N F, D'OVIDI O R, PORCEDD U E, et al.Puri fi cation and molecular characterization of a soybean polygalacturonase inhibiting protein [J].Planta, 1994, 195: 80-87.
[22] STOTZ H, CONTOS J, POWELL A,et al.Structure and expression of an inhibitor of fungal polygalacturonases from tomato[J].Plant Mol Biol, 1994, 25(4): 607-617.
[23] MACHINADIARENA M F, OLIVIERI F P, DALEO G R,et al.Isolation and characterization of a polygalacturonase- inhibiting protein from potato leaves: Accumulation in response to salicylic acid, wounding and infection [J].Plant Physiol Biochem, 2001,39: 129-136.
[24] ZHANG H Y, LIU X Z, WEI L,et al.Insect-resistant Transgenic Tobacco Plants Containing both B t and GNA Genes[J].Biol Plantarum, 2007, 51 (4): 746-748.
[25] 杨崇林,陈章良.高等植物的LRR蛋白:结构与功能[J].生物工程进展,1997,6:43-47.
[26] YAO C, CONWAY W S, REN R,et al.Gene eneoding Polygalacturonase inhibitor in apple fruit is developmentally regulated and activated by wounding and fungal infection[J].Plant Mol Biol, 1999, 39(6):1231-1241.
[27] GOMATHI V, GNANAMNICKAM S S.Polygalacturonaseinhibiting proteins in plant defence [J].Curr Sci,2004,87:1211-1217.
[28] LEEKIE F, MATTEI B, CAPODIEASA C,et al.The speei fi eity of Polygalaeturonase-inhibiting Protein (PGIP): a single amino acid substitution in the solvent-exposed beta-strand/betatum Region of the leueine-rich repeats (LRRs) confers a new recognition capability [J].EMBO Journal,1999,18:2352-2363.
