杜仲成熟果实和幼果MVA途径基因表达差异分析
2013-04-03乌云塔娜叶生晶
王 淋,乌云塔娜,叶生晶
(1.中南林业科技大学 a.经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;3.国家林业局杜仲工程技术研究中心,河南 郑州 450003;4.国家林业局中南林业调查规划设计院,湖南 长沙 410014)
杜仲Eucommia ulmoidesOliv.别名丝楝树皮、胶树,为落叶乔木,其在我国的栽培面积占世界总栽培面积的90%以上,是我国特有的经济林树种之一[1]。杜仲树皮为传统名贵中药;杜仲叶富含绿原酸、京尼平苷酸等活性成分[2-3];杜仲种仁中含有α-亚麻酸,其含量为橄榄油、茶油中的α-亚麻酸含量的8~60 倍,而其桃叶珊瑚苷含量高达11.3%,是目前同类植物中含量最高的[4]。此外,杜仲各组织器官中均含有一种重要的工业原料——杜仲胶[5],杜仲胶的反式聚异戊二烯结构使其具有良好的绝缘性和粘着性,因而被广泛应用于电器工业、化学工业和电信器材工业,故其被誉为具有良好橡塑二重性的高分子合金材料,是目前最具开发价值的温带胶资源[6]。
萜类物质是植物次生代谢过程中重要的代谢产物,因其结构类型丰富多样而被称为“terpenome”[7]。杜仲胶的主要化学成分为聚异戊二烯,属于多萜类化合物[8]。而植物萜类化合物主要通过两个途径独立合成,即位于细胞质的甲羟戊酸(MVA)途径和位于质体中的甲基赤藓醇4-磷酸(MEP)途径[9]。作为植物萜类生物合成的重要上游调控路径之一的MVA途径是一个不可逆的过程:2个乙酰辅酶A(acetyl-CoA)在乙酰辅酶A转移酶 (acetoacetyl-CoA acethyltransferase,ACOT) 的作用下合成乙酰乙酰辅酶A(acetoacetyl-CoA),经3-羟基-3-甲基戊二酰辅酶A合酶(hydroxymethylglutaryl-CoA synthase,HMGS)的催化形成3-羟基-3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl coenzyme A, HMGCoA),再经3-羟基-3-甲基戊二酰辅酶A还原酶(hydroxymethylglutaryl-CoAreductase,HMGR) 的催化下生成甲羟戊酸(mevalonate, MVA),之后在MVA激酶(mevalonate kinase,MK)的作用下形成磷酸甲羟戊酸(mevalonate-5-phosphate,MVAP),接着在磷酸甲羟戊酸激酶(phosphomevalonate kinase,PMK)的作用下生成焦磷酸甲羟戊酸(mevalonate-5-diphosphate,MVAPP), 最 终 在甲羟戊酸焦磷脱羧酶(mevalonatepyrophosphate decarboxylase,MPD) 的作用下生成萜类物质合成前体异戊烯焦磷酸(Isopenteny, IPP)[10-13]。
本文确定了杜仲幼果和成熟果实在MVA途径中的相关基因,并对这些基因表达量的差异情况进行了分析,为充分挖掘杜仲胶的生物合成过程中潜在的功能基因,深入了解合成途径中的限速步骤,解析杜仲萜类生物合成的分子机理以及为确定杜仲萜类代谢工程靶点提供了基础信息。
1 材料与方法
1.1 材 料
选取国家林业局泡桐研究开发中心“华仲6号”的杜仲幼果(授粉后50 d,杜仲胶合成第一个高峰期)、杜仲成熟果(授粉后210 d,杜仲胶合成第二个高峰期)和杜仲叶子(展叶后55 d,胶含量高)作为实验材料,洗净后投入液氮中,于-80 ℃下保存以备用。
1.2 杜仲样品RNA的提取
采用Omega公司的Plant RNA Kit试剂盒提取杜仲叶片中的总RNA,提取完毕后测定样品A260与A280的数值,根据A260/A280的比值估测RNA的质量,然后将能满足实验要求的RNA样品用干冰保存好,再将其送至深圳华大基因公司进行转录组测序和基因功能注释。
1.3 转录组测序方法
深圳华大基因公司对目的样品的浓度及完整度进行了检测,符合测序要求后,采用Illumina技术开始上机测序,通过OligodT富集mRNA,并收集200~700 nt的片段;以随机引物为接头,将mRNA反转录cDNA;按照长度对合成的cDNA片段进行分类,并进行PCR扩增;对获得的PCR产物进行Illumina测序[14-15]。
1.4 Unigene功能注释方法和流程
本研究对杜仲果实的转录组进行了测序,构建了转录组数据库,然后对数据库中的Unigene进行了全面分析和注释。功能注释信息给出了各Unigene的蛋白功能注释、Pathway注释、Gene Ontology(GO)基因功能的注释,具体流程如图1 所示[14-15]。
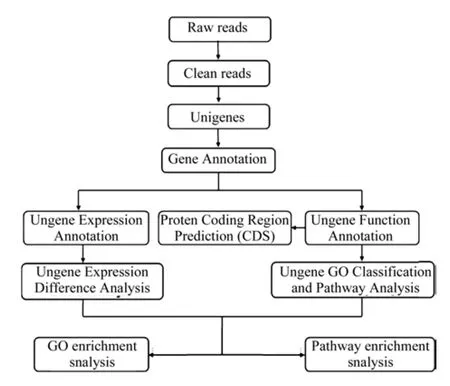
图1 数字化转录组数据库的分析流程Fig.1 Analysis process of digital transcriptome data
2 结果与分析
在杜仲幼果和成熟果实转录组数据中,MVA合成途径共有6个代谢位点、30条Unigene被注释(详见图2)。其中,代谢位点2.3.1.9为乙酰辅酶A转移酶(acetyl-CoA C-acetyltransferase,ACOT),共注释7条;代谢位点2.3.3.10为3-羟基-3-甲基戊二酰辅酶A合酶(hydroxymethylglutaryl-CoA synthase,HMGS),共注释3条;代谢位点1.1.1.34为3-羟基-3-甲基戊二酰辅酶A还原酶(hydroxymethylglutaryl-CoA reductase,HMGR),共注释11条;代谢位点2.7.1.36为甲羟戊酸激酶(mevalonate kinase,MK),共注释2条;代谢位点2.7.4.2为磷酸甲羟戊酸激酶(phosphomevalonate kinase,PMK),共注释2条;代谢位点4.1.1.33为甲羟戊酸焦磷脱羧酶(diphosphomevalonate decarboxylase,MDP),共注释5条。
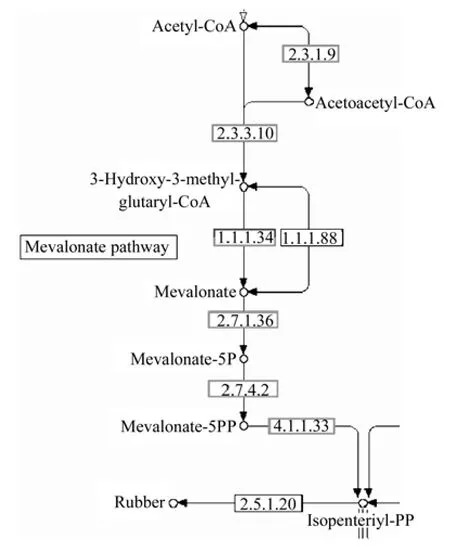
图2 杜仲幼果和成熟果实KEGG数据库中的MVA途径Fig.2 MVA pathway of young and ripe fruits in KEGG Data
2.1 杜仲乙酰辅酶A转移酶EuACOT的确定及其表达差异分析
杜仲乙酰辅酶A转移酶在杜仲幼果和成熟果实的转录组数据中共有7条被注释,这些基因的编码序列与烟草Nicotiana tabacum(AAU95619.1)、胡黄连Picrorhiza kurrooa(ABC74567.1)、油茶Camellia oleifera(ADD10719.1)、伊乐假单胞菌Sphingomonas elodea(ZP_09954590.1) 的 ACOT基因的氨基酸序列同源性均达到80%以上,故被命名为EuACOT,记为EuACOT1~7。
EuACOT在杜仲果实中的表达量见图3。EuACOT7在杜仲幼果中不表达,只在成熟果实中表达,而其他EuACOT成员在杜仲幼果和成熟果实中均有表达,且其在幼果中的表达量大于在成熟果实中的表达量,这说明,EuACOT7为杜仲果实生长发育的晚期基因。

图3 EuACOT 在杜仲幼果和成熟果实中表达的差异情况Fig.3 Differential expression of EuACOT in young and ripe fruits
EuACOT在杜仲幼果和成熟果实中表达的多样性如表1。EuACOT2、EuACOT3、EuACOT4、EuACOT5、EuACOT6在杜仲幼果和成熟果实中的表达量均存在显著差异,EuACOT在幼果中的表达量的大小顺序为EuACOT4>EuACOT5>EuACOT3>EuACOT6>EuACOT2>EuACOT1>EuACOT7;而在成熟果中,EuACOT4和EuACOT5基因的表达量较高。幼果中的基因表达量比成熟果实中的表达量相对高很多,说明幼果的遗传多样性比成熟果高很多,其表达调控模式较为复杂。

表1 EuACOT在杜仲幼果和成熟果中表达的多样性Table 1 Diversity of EuACOT expression in young and ripe fruits
2.2 3-羟基-3-甲基戊二酰辅酶A合酶EuHMGS的确定及其表达差异分析
在杜仲幼果和成熟果实中共有3条EuHMGS基因被注释,这些基因编码序列与喜树Camptotheca acuminate(ACD87446.1)、烟草属观赏烟Nicotiana langsdorf fi ixNicotiana sanderae(ABV02025.1)的HMGS基因的氨基酸序列的同源性均达到了83%~89%,记为EuHMGS1~3。
EuHMGS基因在杜仲幼果和成熟果实中的表达量见图4。EuHMGS家族成员在杜仲幼果和成熟果实中均有表达,且幼果中的表达量均大于成熟果实中的表达量。
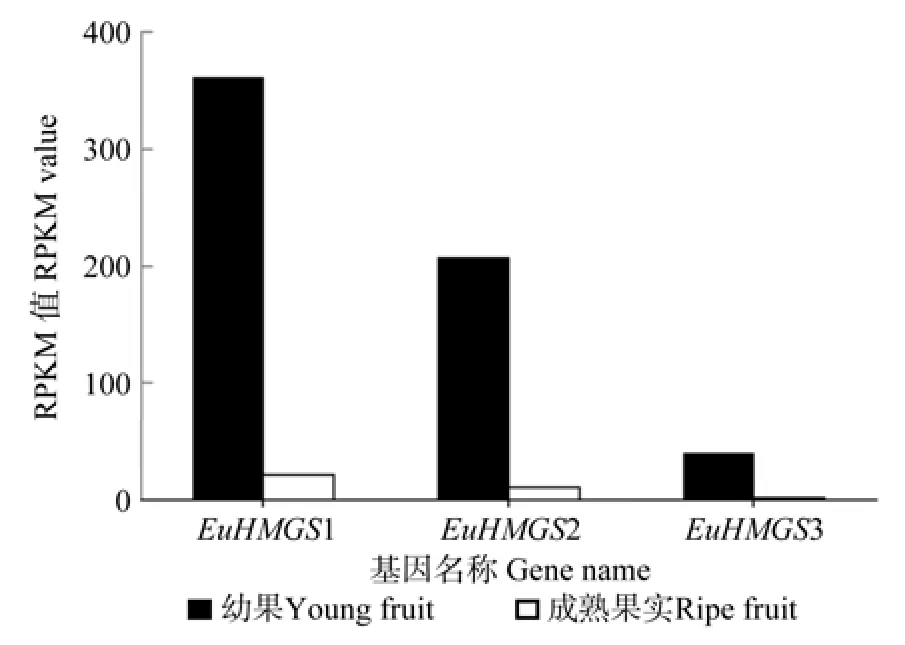
图4 EuHMGS 在杜仲幼果和成熟果实中表达的差异情况Fig.4 Differential expression of EuHMGS in young and ripe fruits
EuHMGS在杜仲幼果和成熟果中表达的多样性如表2。EuHMGS1、EuHMGS2、EuHMGS3等基因在幼果和成熟果实中的表达量均存在显著差异,无论在幼果还是成熟果实中其表达量的大小顺序均为EuHMGS1>EuHMGS2>EuHMGS3。
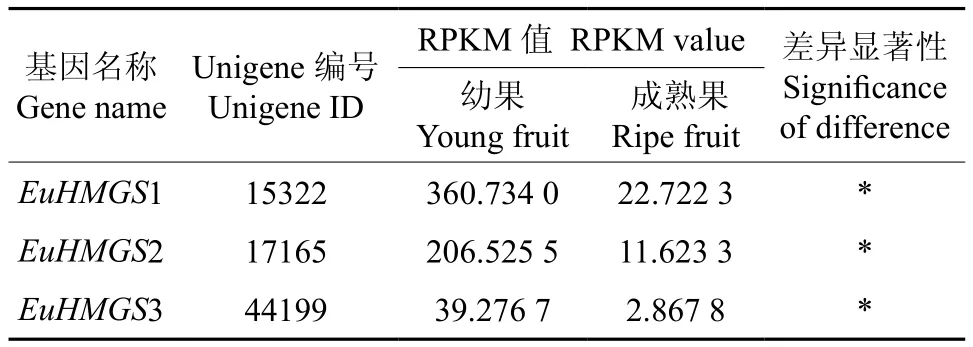
表2 EuHMGS在杜仲幼果和成熟果中表达的多样性Table 2 Diversity of EuHMGS expression in young and ripe fruits
2.3 3-羟基-3-甲基戊二酰辅酶A还原酶EuHMGR的确定及其表达差异分析
在杜仲幼果和成熟果实的转录组数据中共有11条EuHMGR基因被注释,这些基因编码序列与喜树Camptotheca acuminata(P48021.1)、马铃薯Solanum tuberosum(P48020.1)、黄龙胆Gentianalutea(BAE92730.1)等其他植物的HMGR基因的氨基酸序列的同源性均达到80%以上,故其被命名为EuHMGR,记为EuHMGR1~11。
EuHMGR在杜仲幼果及成熟果实中的表达量如图5所示。从图5中可以看出,EuHMGR4、EuHMGR5基因在杜仲成熟果实中不表达,只在杜仲幼果中有特异表达,说明EuHMGR4、EuHMGR5基因为杜仲果实生长发育的早期基因;EuHMGR10在幼果中不表达,只在成熟果实中有特异表达,说明EuHMGR10为杜仲果实生长发育的晚期基因,也是萜类物质大量合成时表达的基因。综上所述,EuHMGR10在萜类化合物的生物合成中起重要作用;且EuHMGR1、EuHMGR8、EuHMGR9在成熟果实中的表达量大于幼果,EuHMGR2、EuHMGR3、EuHMGR6、EuHMGR7、EuHMGR11等基因在幼果中的表达量大于其在成熟果实中的表达量。
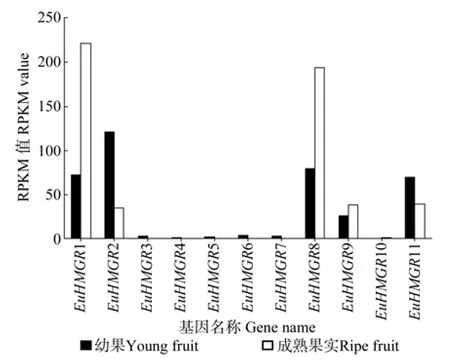
图5 EuHMGR 在杜仲幼果和成熟果实中表达的差异情况Fig.5 Differential expression of EuHMGR in young and ripe fruits
EuHMGR在杜仲幼果和成熟果实中表达的多样性如表3所示。由表3可知,EuHMGR3、EuHMGR4、EuHMGR5、EuHMGR6、EuHMGR7、EuHMGR9、EuHMGR11在杜仲幼果和成熟果中的表达量无显著差异,而EuHMGR1、EuHMGR2、EuHMGR8、EuHMGR10在杜仲幼果和成熟果实中的表达量存在显著差异,这说明,EuHMGR基因表达调控模式极其复杂。
2.4 甲羟戊酸激酶EuMK的确定及其表达差异分析
从杜仲幼果和成熟果实转录组数据中可以发现,EuMK基因有2条被注释,这些基因编码序列与拟南芥Arabidopsis thaliana(AAD45421.1)和橡胶树Hevea brasiliensis(AAL18925.1)等植物的MK基因的氨基酸序列的同源性均达到80%以上,故其被命名为EuMK,记为EuMK1~2。
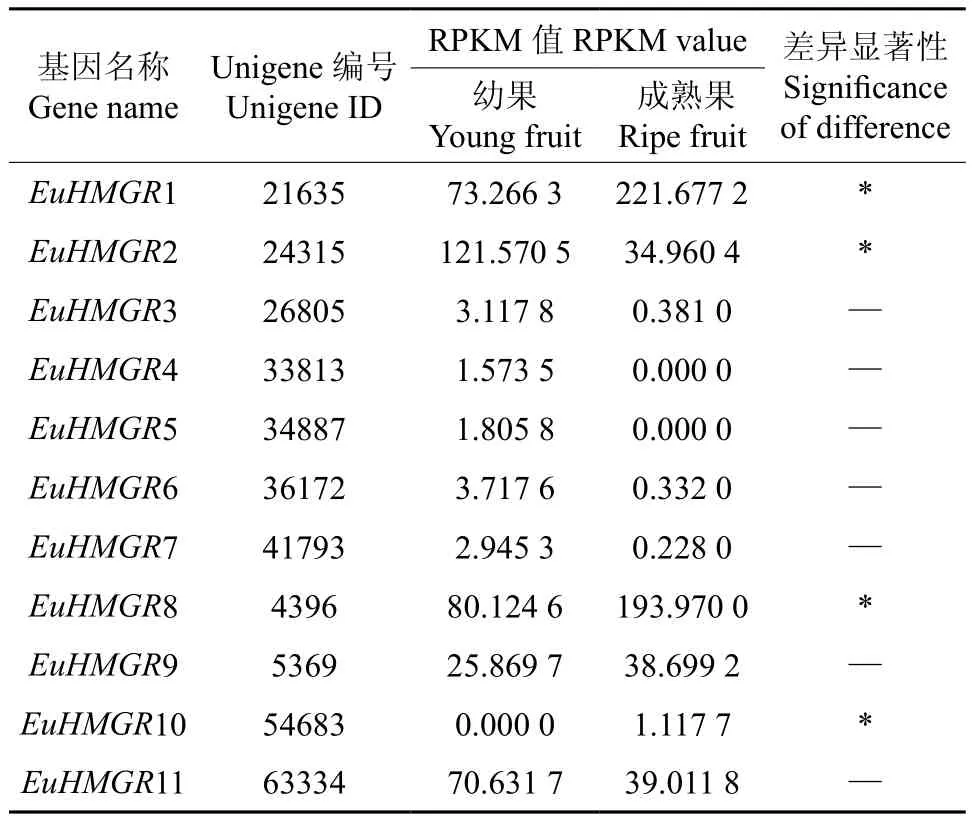
表3 EuHMGR在杜仲幼果和成熟果中表达的多样性Table 3 Diversity of EuHMGR expression in young and ripe fruits
EuMK在杜仲幼果与成熟果实中均有表达(见图6),且在幼果中的表达量大于在成熟果实中的表达量。
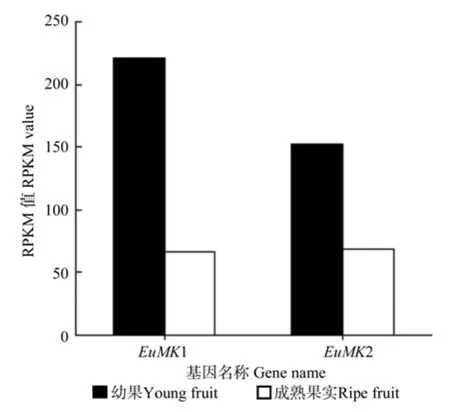
图6 EuMK 在杜仲幼果和成熟果实中表达的差异情况Fig.6 Differential expression of EuMK in young and ripe fruits
EuMK在杜仲幼果和成熟果实中表达的多样性如表4所示。由表4可知,EuMK在杜仲幼果和成熟果实中的表达量均存在显著差异。
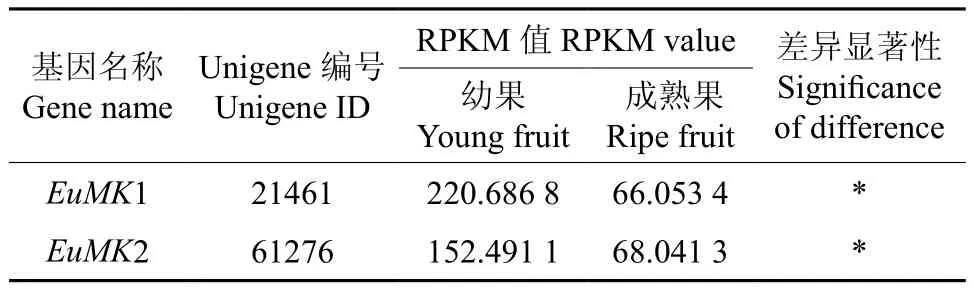
表4 EuMK在杜仲幼果和成熟果中表达的多样性Table 4 Diversity of EuMK expression in young and ripe fruits
2.5 磷酸甲羟戊酸激酶EuPM的确定及其表达差异分析
从杜仲幼果和成熟果实的转录组数据中发现,EuPMK基因有2条被注释,这些基因编码序列与烟草属观赏烟Nicotiana langsdorf fi ixNicotiana sanderae(ABV02027.1)、橡胶树Hevea brasiliensis(AAL18926.1)、 茶Camellia sinensis(AFC34137.1)等植物的MK基因的氨基酸编码序列的同源性分别为83%、77%、90%,故其被命名为EuPMK,记为EuPMK1与EuPMK2。
EuPMK在杜仲幼果和成熟果实中均有表达(见图7),EuPMK1与EuPMK2在杜仲幼果中的表达量均大于其在成熟果中的表达量。
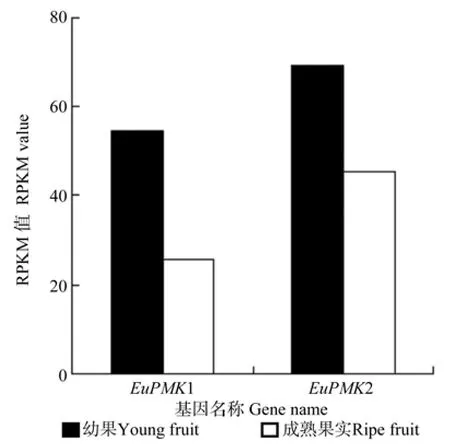
图7 EuMDP在杜仲幼果和成熟果实中表达的差异情况Fig.7 Differential expression of EuMDP in young and ripe fruits
EuPMK在杜仲幼果和成熟果中表达的多样性如表5所示。由表5可知,EuPMK1在杜仲幼果和成熟果实中的表达量均存在显著差异,而EuPMK2在杜仲幼果和成熟果实中的表达量却无显著差异。
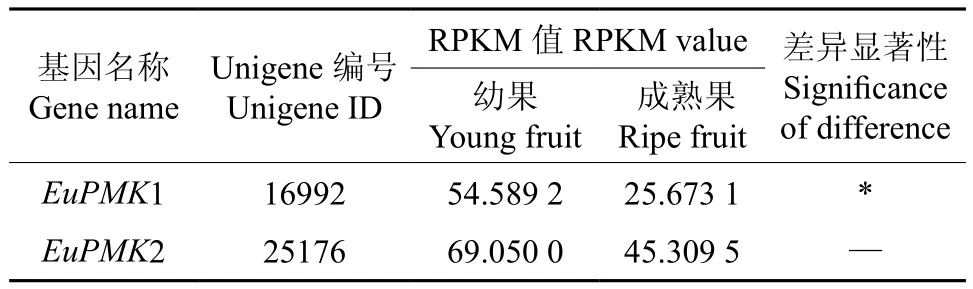
表5 EuPMK在杜仲幼果和成熟果中表达的多样性Table 5 Diversity of EuPMK expression in young and ripe fruits
2.6 磷酸甲羟戊酸激酶EuMDP的确定及其表达差异分析
从杜仲幼果和成熟果实的转录组数据中发现,EuPMK基因有5条被注释,这些基因编码序列与人参Panax ginseng(ADI80345.1)、橡胶树Hevea brasiliensis(AAL18927.1)、烟草属观赏烟Nicotiana langsdorf fi ixNicotiana sanderae(ABV02028.1)等植物的MDP基因的氨基酸序列的同源性均达到85%以上,故其被命名为EuMDP,记为EuMDP1~5。
EuMDP在杜仲幼果和成熟果及杜仲幼果和叶子中均有表达(详见图8),EuMDP家族各成员在杜仲幼果中表达量的大小顺序为EuMDP2>EuMDP5>EuMDP3 >EuMDP4>EuMDP1;而在杜仲成熟果中,EuMDP3和EuMDP4的表达量相对较高。

图8 EuMDP在杜仲幼果和成熟果实中表达的差异情况Fig.8 Differential expression of EuMDP in young and ripe fruits
EuMDP在杜仲幼果和成熟果中表达的多样性如表6所示。由表6可知,EuMDP家族其他成员在幼果和成熟果实中的表达量均达到显著差异水平。
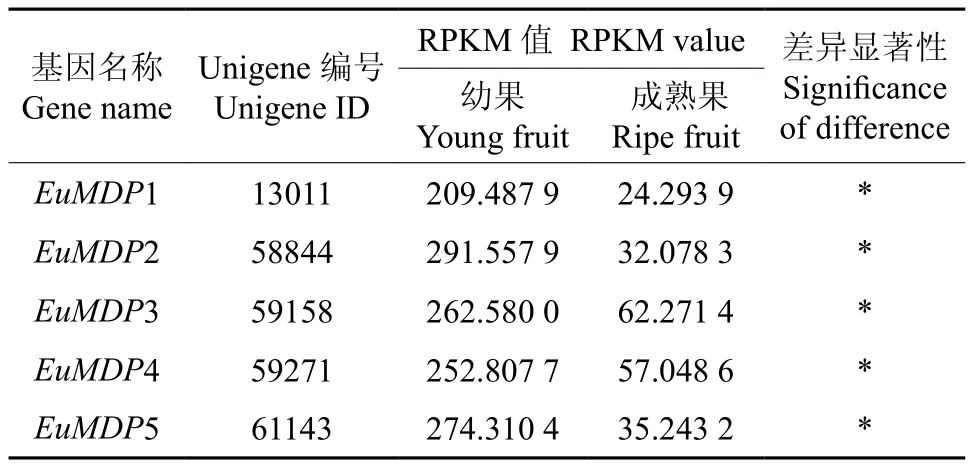
表6 EuMDP 在杜仲幼果和成熟果中表达的多样性Table 6 Diversity of EuMDP expression in young and ripe fruits
3 结论与讨论
萜类化合物(terpenoids)是植物次生代谢产物中最大的一个家族,在自然界中广泛分布,但一般萜类物质在植物中的含量较低,难于分离纯化,例如,紫杉醇在紫杉树皮中的含量每千克只有40~100 mg[16]。本研究采用转录组测序方法,可以检测到MVA途径低表达量的基因的存在,这为进一步分离、纯化和克隆萜类物质合成相关酶提供了依据。
萜类化合物生物合成途径迄今已基本阐明,主要为通过细胞质中的MVA途径和质体中 的MEP途径合成,其生物合成中相关酶的克隆、表达和调控是目前研究的热点。本文确定了MVA途径的相关基因:EuACOT7条、记为EuACOT1~7;EuHMGS3条、 记 为EuHMGS1~ 3;EuHMGR11条、记为EuHMGR1~11;EuMK2条、记为EuMK1~2;EuPMK2条、记为EuPMK1~2;EuMDP5条、记为EuMDP1~5。
植物体内许多萜烯成分通常有着复杂而独特的生物合成途径和迥异的化学结构,其分布通常具有种属、器官、组织和生长发育阶段的特异性[17],这就充分说明了萜类合成酶存在表达和调控的时空特异性。乙酰COA酰基转移酶是萜类化合物合成MVA途径的起始酶,在不同的组织中其表达量有所不同[18]。在丹参的根、茎、叶中均有表达,但是根中的表达量明显高于茎和叶中的表达量[19]。EuACOT家族基因在杜仲成熟果实中均有表达,除了EuACOT7,其他EuACOT成员在杜仲幼果中均有表达,且其在幼果中的表达量大于其在成熟果实中的表达量。3-羟基-3-甲基戊二酰辅酶A合酶是萜类物质合成MVA途径中重要的中间体,HMGS在不同组织部位的表达不尽相同,例如喜树HMGS基因在子叶和胚轴中的表达量最高,而在根部几乎不表达[20];EuHMGS在杜仲幼果和成熟果实中均有表达,且其在幼果中的表达量大于其在成熟果实中的表达量,并且存在显著性差异。不同物种MVA途径关键酶基因的克隆与功能的研究多集中于3-羟基-3-甲基戊二酰辅酶A还原酶,HMGR是MVA途径中的第一个限速酶,为细胞质萜类代谢中的重要调控位点。Schaller等人[21]将HMGR的基因组片段hmg1基因转入烟草中,使总的甾醇量增加6倍,其原因可能是hmg1表达水平的提高导致了相应的HMGR酶活性的提高,并且最终产物在转基因的组织中得以累积。本文对EuHMGR基因在杜仲幼果和成熟果实中表达量的差异情况进行了分析,结果发现,EuHMGR4、EuHMGR5只在杜仲幼果中有特异表达,EuHMGR10只在成熟果实中有特异表达,EuHMGR1、EuHMGR2、EuHMGR3、EuHMGR6、EuHMGR7、EuHMGR8、EuHMGR9、EuHMGR11在杜仲幼果和成熟果实中均有表达。由此可见,EuHMGR表达调控模式较为复杂。EuMK、EuPMK、EuMDP家族基因在杜仲幼果和成熟果中均有表达,且其在幼果中的表达量高于其在成熟果实中的表达量。
本文首次对杜仲幼果和成熟果实MVA途径相关基因表达的差异情况进行了分析,分析结果为以后研究杜仲萜类物质的生物合成机制提供了理论依据。
参考文献:
[1] 杜红岩.我国的杜仲胶资源及其开发潜力与产业发展思路[J].经济林研究,2010,28(3):1-6.
[2] 杜红岩.杜仲活性成分与药理研究的新进展[J].经济林研究,2003,21(2):58-61.
[3] 杜红岩,刘昌勇,李 钦,等.杜仲叶中3种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011,31(8): 6-9.
[4] 朱莉伟,陈素文,蒋建新,等.杜仲种仁化学成分研究[J].中国野生植物资源,2005,24(2):44-45.
[5] 彭金年.杜仲叶中杜仲胶含量与分子量分布研究[D].沈阳:沈阳药科大学,2007.
[6] 杜红岩,胡文臻,俞 锐.杜仲产业绿皮书:中国杜仲橡胶资源与产业发展报告(2013)[M].北京:社会科学文献出版社,2013:3-7.
[7] 李军玲,罗晓东,赵沛基,等.植物萜类生物合成中的后修饰酶[J].云南植物研究,2009, 31(5):461-468.
[8] 叶生晶,乌云塔娜,田大伦,等.杜仲MVA途径相关基因的鉴定及荧光定量PCR引物筛选[J].中南林业科技大学学报,2013, 33(8):51-56.
[9] Newman J D, Chappell J.Isoprenoid biosynthesis in plants:carbon partitioning within the cytoplasmic pathway [J].Critical Reviews in Biochemistry and Molecular Biology, 1999, 34(2):95-106.
[10] 沈少华,刘姬艳,胡江琴,等.喜树碱生物合成途径及其相关酶的研究进展[J].中草药,2001,42(9):204-210.
[11] Lichtenthaler H K.The 12deoxy2D2xylulose252phosphate pathway of isoprenoid biosynthesis in plants[J].Annu RevPlant Physiol PlantMolBiol,1999, 50: 47-65.
[12] Dudareva N, Andersson S, Orlova I,et al.The nonmevalonate pathway supports both monoterpene and sesquiterpene formation in snapdragon fl owers [J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(3): 933-938.
[13] Hemmerlin A, Hoef fl er J F, Meyer O,et al.Cross2talk between the cytosolic mevalonate and the plastidial methylerythritol phosphate pathways in tobacco bright yellow22 cells [J].Journal of Biological Chemistry, 2003, 278 (29) : 26666-26676.
[14] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报, 2012,32(11):122-130.
[15] 李铁柱,杜红岩,刘慧敏,等.杜仲幼果和成熟果实转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(10): 9-17.
[16] 张长波,孙红霞,巩中军,等.植物萜类化合物的天然合成途径及其相关合酶[J].植物生理学通讯,2007,43(4):779-785.
[17] 刘蓉蓉.植物次生代谢途径的遗传修饰研究进展[J].生物技术通报,2008,(6):10-13.
[18] 张 琳,谭晓风,胡 娇,等.油茶乙酰CoA酰基转移酶基因cDNA克隆及序列特征分析[J].中南林业科技大学学报,2011, 31(8):108-112 .
[19] 崔光红,王学勇,冯 华,等.丹参乙酰CoA酰基转移酶基因全长克隆和SNP分析[J].药学学报,2012,45(6):113-118.
[20] 王 伟.喜树毛状根培养体系的建立及喜树hmgs基因的克隆分析[D].上海:上海师范大学,2009.
[21] Schaller B, Grausem P, Benveniste ML,et al.Expression of theHevea brasiliensis(H.B.K.) Mull Arg 3-hydroxy-3-methylglutaryl-Coenzyme A reductase 1 in tobacco results in sterol overproduction[J].Plant Physiology, 1995,56(4):89-95.
