熊果酸对实验性糖尿病小鼠心肌纤维化作用的研究*
2013-03-28杨钧杰齐敏友
杨钧杰,宫 燕,史 杰,齐敏友
(浙江工业大学药学院,杭州310014)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病常见而危害严重的并发症。其发病机制主要与氧化应激、心肌纤维化、炎症因子、肾素-血管紧张素(renin-angiotensin system,RAS)系统激活有关[1,2]。近年来转化生长因子β(transforming growth factor beta,TGF-β)在心肌纤维的进程中受到关注[3]。熊果酸(ursolic acid,UA)是一种存在于天然植物中的α-香树脂醇(α-amyrin)型五环三萜类化合物,是许多中药复方的主要有效成分之一。现代药理学研究表明,UA具有抗肿瘤、降血糖、抗氧化、抗肝纤维化等作用[4,5],但其是否可以通过抑制心肌 TGF-β1的表达抗糖尿病心肌纤维化尚无报道。本实验通过四氧嘧啶建立糖尿病小鼠心肌病变模型,观察熊果酸对糖尿病小鼠心肌病的作用,初步探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性昆明种小鼠,体重(20±2)g,由浙江医学科学院实验动物中心提供。合格证号:SCXK(浙)-2008-0033。
1.1.2 药物和主要试剂 熊果酸(HPLC测定纯度98.25%),由湖南上禾生物科技提供;贝那普利(Benazepril),由北京诺华提供;四氧嘧啶,由sigma公司生产,上海贝基生物有限公司分装,批号:10080210;MDA、SOD试剂盒,考马斯亮兰测试盒,均由南京建成生物工程有限公司提供;兔抗大鼠TGF-β1抗体,由武汉博士德公司提供。
1.1.3 主要仪器设备 血糖测定仪(美国强生公司);离心机、紫外分光光度计(巩义市英峪予华仪器厂);104型电子天平(Made by Mettler-Toledo Group);石蜡切片机(日本日立公司);WB22型恒温水浴箱(Made in German)。
1.2 方法
1.2.1 糖尿病小鼠模型的建立 雄性昆明种小鼠分笼饲养,禁食不禁水12 h后,一次性尾静脉注射四氧嘧啶(70 mg/kg)。正常喂食15 d后,空腹12 h尾静脉取血测定血糖,将血糖高于13.9 mmol/L的小鼠按随机分为模型组、熊果酸组和贝那普利组(n=10),另取10只健康小鼠作为正常对照组。熊果酸以生理盐水混悬后灌胃(35 mg/kg,根据预试验结果确定此剂量),贝那普利组(5 mg/kg,p.o.),正常组和模型组用等体积生理盐水灌胃,持续8周。
1.2.2 血糖测定 末次给药后空腹12 h,尾静脉取血,用血糖测定仪测定各组小鼠血糖。
1.2.3 脏器系数 处死小鼠后,快速取出心脏,去除心包膜、血管,生理盐水洗净,滤纸吸干后称取全心重。剪去右心室及心房部分,吸干称取左心室重,根据末次体重计算心脏脏器系数(左心室重/全心重、全心重/体重)。
1.2.4 生化指标测定 取适量左心室心肌组织,用0.9%冷生理盐水制成10%均浆液,离心(3 000 r/min,10 min),取上清液,-20℃保存。按照试剂盒说明书检测心肌组织SOD活性,MDA和羟脯氨酸的含量。
1.2.5 组织学检测 取心肌组织以10%中性甲醛固定,石蜡包埋切片,进行Masson染色,胶原成纤维细胞呈蓝色,于光镜下观察。
1.2.6 免疫组化检测 取各组小鼠心肌组织石蜡包埋制成4μm切片。切片常规脱蜡至水,3%H2O2处理,抗原热修复。以正常山羊血清封闭后,滴加兔抗大鼠TGF-β1抗体,4℃孵育过夜。滴加Envision工作液室温30 min。用DAB显色,控制显色程度后水洗。苏木素衬染,二甲苯透明,树胶封片。半定量分析:在400倍光镜下随机选取组织结构保存较好的切片,取6个视野点,用Image-Pro Plus 5.0病理图像分析软件分析,测定阳性颗粒(TGF-β1阳性为棕黄色颗粒)的平均吸光度,计算均值。
1.3 统计学处理
数据以均数±标准差(¯x±s)表示。数据统计应用SPSS 17.0软件,采用单因素方差分析(ANOVA),并作组间两两比较。
2 结果
2.1 熊果酸对小鼠一般体征、血糖影响
正常组小鼠精神状态良好、反应灵敏、毛色有光泽,体重逐渐增加。造模小鼠表现为明显的多饮、多食、多尿症状,同时体重减轻,且小鼠血糖明显上升,熊果酸和贝那普利组对小鼠的一般体征有改善作用,熊果酸治疗组血糖较模型组下降,表明熊果酸具有较好的降血糖作用(P<0.01,表 1)。

Tab.1 Changes of the body weight and blood glucose level(¯x±s,n=10)
2.2 熊果酸对心脏脏器系数的影响
模型组小鼠全心和左心室脏器系数较正常组升高(P<0.05),熊果酸和贝那普利组其值接近正常水平。结果显示:熊果酸和贝那普利组对心脏器系数有明显改善作用(P<0.01,表 2)。

Tab.2 Index of heart weight of mice(¯x±s,n=10)
2.3 熊果酸对心肌组织SOD活力、MDA和HPY含量的影响
与对照组相比,模型组心肌组织中SOD活性明显降低(P<0.05),MDA含量明显升高(P<0.01),羟脯氨酸含量明显升高(P<0.01),表明心肌内存在过度的氧自由基,机体抗氧化能力下降,胶原纤维增生明显,熊果酸和贝那普利组对上述改变具有良好的改善作用(P<0.01,表 3)。
2.4 熊果酸对心肌组织形态学的影响
心肌组织Masson染色,400倍光镜下观察。结果显示:正常组小鼠心肌组织仅可见少量蓝色斑点,表明心肌中胶原很少;模型组小鼠心肌内层及间质中可见多处蓝色大面积的块状瘢痕组织,为胶原蛋白过度表达及心肌坏死后成纤维细胞增生所致;熊果酸组对上述改变有明显的改善作用。箭头所示为心肌胶原纤维(图1)。
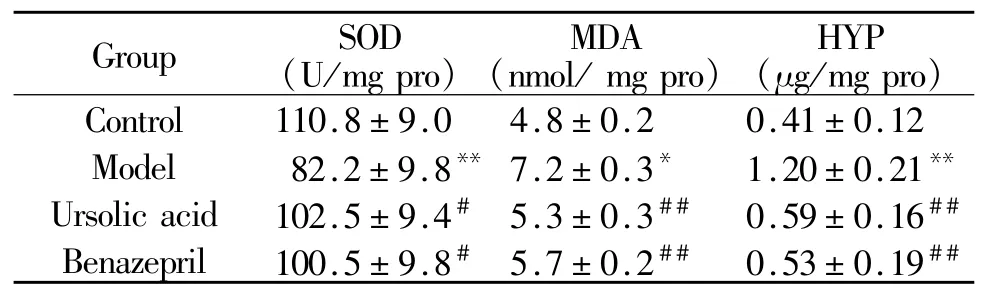
Tab.3 Content of SODand MDA in myocardium(¯x±s,n=10)
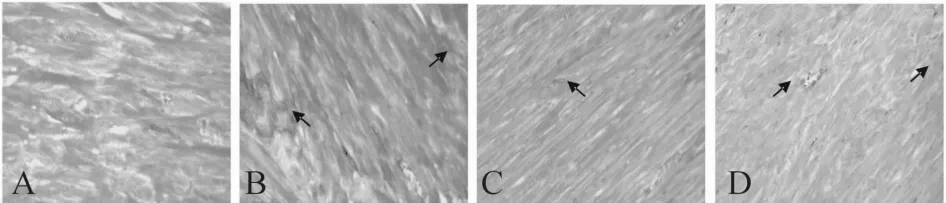
Fig.1 Expression of collagen protein in myocardium tissues of mice(Masson×400)
2.5 心肌组织中TGF-β1表达的变化
与正常组比较,模型组小鼠心肌细胞胞浆中有较多棕黄色颗粒状物质,呈强阳性反应;熊果酸组棕黄色颗粒数明显减少,半定量分析结果显示:提示熊果酸和贝那普利均能抑制TGF-β1蛋白的表达(P<0.05)。箭头所示为 TGF-β1蛋白的表达(图 2)。
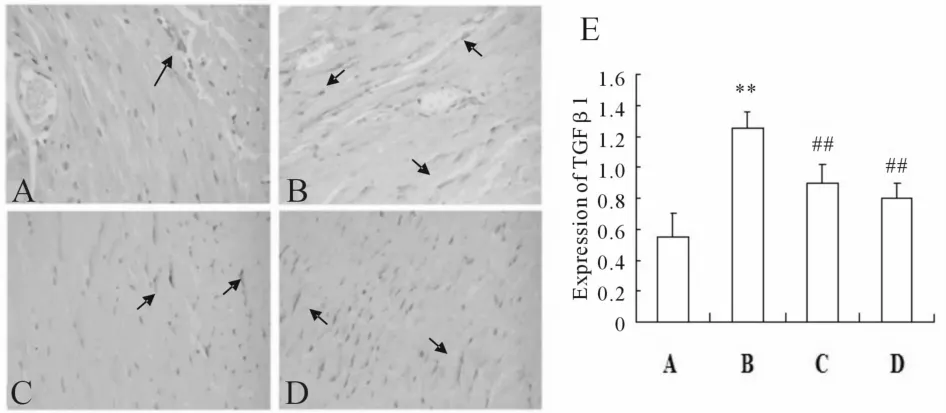
Fig.2 Expression of TGF-β1 in myocardium tissues of mice(immunohistochemical staining×400)
3 讨论
糖尿病心肌病是导致糖尿病患者心功能不全的临床常见并发症之一,其发病机制迄今尚未完全明确。糖尿病导致的心肌细胞代谢紊乱、胰岛素抵抗,心肌局部RAS系统过度激活,氧化应激等均能引起心肌结构和功能改变,在糖尿病心肌组织形态学上主要表现为心肌细胞局灶性肥大、坏死,细胞外基质沉积和心肌纤维化[5]。本实验采用四氧嘧啶一次性尾静脉注射方法制备的小鼠糖尿病模型,血糖均13.9 mmol/L,且“三多一少”症状明显,心肌组织中羟脯氨酸含量增高,Masson染色显示心肌细胞肥大,排列紊乱,心肌间质胶原纤维沉积和纤维化,说明模型建立成功。从实验结果上看,熊果酸具有降低血糖,改善糖尿病小鼠心肌组织纤维化的作用。
氧化应激在糖尿病心肌病变中起着重要作用,可通过激活基质金属蛋白酶(matrix metalloproteinase,MMPs),进而可引起心肌纤维化[6,7],而MDA含量和SOD活性是其两个重要指标。研究结果显示:模型组心肌组织中脂质过氧化物明显增多,而清除活性氧的超氧化物歧化酶活力降低,表明四氧嘧啶所致糖尿病小鼠的心肌氧化应激状态增强,加重心肌损伤并引起心肌结构改变。阳性药物贝那普利干预后,心肌组织中SOD活性升高;MDA、HYP含量下降。糖尿病时,RAS系统激活,心肌局部血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)水平升高,诱导氧化应激,引起心肌内皮细胞凋亡。贝那普利作为血管紧张素转换酶抑制剂,能够有效抑制甚至逆转上述现象,通过降低心肌局部AngⅡ水平,减轻心肌氧化应激状态。而熊果酸组,心肌组织中MDA含量明显降低;同时SOD活性提高,显示熊果酸具有较好的抗氧化能力,这与文献报道一致[8],其具体途径是否与降低心肌AngⅡ水平有关有待进一步研究。
诸多的生长因子表达增加在糖尿病状态下组织器官纤维化形成中起重要作用,其中TGF-β1是一个关键的生长因子[9],在糖尿病情况下,TGF-β1由其活化型的受体介导,在细胞外基质和基底膜上与蛋白质结合发挥局部生物学效应,促使成纤维细胞合成胶原纤维蛋白、蛋白多糖、纤维粘连蛋白,引起心肌纤维化。本实验结果表明:熊果酸能够显著抑制糖尿病小鼠心肌组织中TGF-β1的表达,提示熊果酸可通过下调TGF-β1表达这一途径,减少心肌纤维化。有文献报道:贝那普利能抑制RAS系统激活,通过蛋白激酶 C(protein kinase C,PKC)途径抑制 TGF-β1表达升高保护糖尿病肾病[10]。本实验结果显示:其亦能抑制心肌组织中的TGF-β1表达明显下降,胶原表达减少,从而保护糖尿病心肌病变。
综上所述,氧化应激和TGF-β1过度表达参与糖尿病心肌病变的过程,熊果酸对糖尿病引起的心肌损伤具有良好的改善作用,其可能的作用机制包括降血糖、抗氧化和抑制TGF-β1表达等。由于目前对糖尿病心肌病变缺乏有效治疗手段,因此研究熊果酸治疗DCM的作用和机制,对开发中药治疗糖尿病并发症具有重要意义。
[1] 宫 燕,陈 凯,喻苏青,等.山茱萸总萜对糖尿病小鼠心肌病变的保护作用[J].中国应用生理学杂志,2012,28(4):378-384.
[2] Aydemir-Koksoy A,Bilginoglu A,Sariahmetoglu M,et al.Antioxidant treatment protects diabetic rats from cardiac dysfunction by preserving contractile protein targets of oxidative stress[J].J Nutr Biochem,2010,21(9):827-833.
[3] Dobaczewski M,Chen W,Frangogiannis NG.Transforming growth factor(TGF)-βsignaling in cardiac remodeling[J].J Mol Cell Cardiol,2011,51(4):600-606.
[4] Jang SM,Yee ST,Choi J,et al.Ursolic acid enhances the cellular immune system and pancreatic beta-cell function in streptozotocin-induced diabetic mice fed a high-fat diet[J].Int Immunopharmacol,2009,9(1):113-119.
[5] Asbun J,Villarreal FJ.The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy[J].J Am Coll Cardiol,2006,47(4):693-700.
[6] Galli F,Battistoni A,Gambari R,et al.Oxidative stress and antioxidant therapy in cystic fibrosis[J].Biochim Biophys Acta,2012,1822(5):690-713.
[7] Sharma V,McNeill JH.Diabetic cardiomyopathy:Where are we 40 years later[J]?Can J Cardiol,2006,22(4):305-308.
[8] Wang ZH,Hsu CC,Huang CN,et al.Anti-glycative effects of oleanolic acid and ursolic acid in kidney of diabetic mice[J].Eur J Pharmacol,2010,628(1-3):255-260.
[9] Roestenberg P,van Nieuwenhoven FA,Joles JA,et al.Temporal expression profile and distribution pattern indicate a role of connective tissue growth factor(CTGF/CCN-2)in diabetic nephropathy in mice[J].Am J Physiol Renal Physiol,2006,290(6):F1344-F1354.
[10]陈烁苹,郑景晨,倪连松,等.血管紧张素-(1-7)对糖尿病大鼠肾脏PDGF、TGF-β的影响[J].中国应用生理学杂志,2008,24(4):475-478.
