模拟高原低氧对p53及其靶基因表达的调节*
2013-03-25王铭洋张圣婷陈学群杜继曾
王铭洋,赵 阳,张圣婷,陈学群,杜继曾
(浙江大学基础医学系神经生物学和生理学研究室,浙江杭州310058)
低氧是激活p53的重要因素之一,p53也是机体应对低氧应激的重要调节因子。作为转录因子,p53的主要功能是调节细胞周期停滞和细胞凋亡的相关靶基因,两类靶基因之间的表达平衡决定细胞命运,与细胞周期停滞相关的p53靶基因包括p21,cyclinB2,Fas/APO1等,与细胞凋亡相关的p53靶基因有bax,IGFBP3,Bcl-2等[1]。研究低氧应激下 p53及其靶基因的表达变化模式与规律,对理解机体的低氧适应性有重要意义。
小哺乳动物根田鼠(Microtus oeconomus)和高原鼢鼠(Myospalax baileyi)是生活在我国青藏高原的优势物种,在长期进化中形成了对高原低氧环境的良好适应。目前没有文献报道高原鼢鼠和根田鼠肝脏p53的表达情况,我们实验室克隆了根田鼠(JX998171)和高原鼢鼠(JX998170)p53基因的编码区序列,本研究比较了两种高原动物p53表达情况;探讨了大鼠肝脏p53及其靶基因的表达模式。
1 材料与方法
1.1 动物和低氧处理
高原动物:成年健康的高原鼢鼠(体重250~300 g)和根田鼠(体重18~25 g)捕获于中国科学院海北高寒草甸生态系统实验站附近(37°39’N,101°19’E,海拔:3.352 km,气压:508 mmHg)。随机分为对照组和低氧组(n=6),对照组置于海北实验站中(3.2 km),低氧组用含 8.0%O2和 92.0%N2的混合气体模拟7 km低氧6 h。
平原动物:采用健康雄性、清洁级SD大鼠,体重(170±20)g,购于浙江省医学科学院实验动物中心(SCXK2008-0033)。随机分为对照组和三个低氧组(n=6):低氧组分别模拟 2 km(16.0%O2),5 km(10.8%O2)和 7 km(8.0%O2)低氧8 h,对照组不给予低氧处理。
1.2 样品准备和方法
低氧处理后,动物被迅速断头牺牲,解剖获取肝脏后迅速置于液氮中冷冻,随后保存于-80℃。称取约50mg肝脏进行以下处理:(1)Q-PCR样品:使用东盛公司RNA提取试剂盒提取肝脏组织总RNA,并采用TransScriptTMFirst-Strand cDNA Synthesis Super-Mix(TransGenBiotech,AT301)逆转录为 cDNA,置于-20℃保存。(2)Western-blot样品:将肝脏组织置于RIPA裂解液(碧云天,P0013B)中,并按 1∶100的比例加入 PMSF(碧云天,ST505)和 protease inhibitor cocktail(Biomol,BML-KI103-0001)蛋白酶抑制剂,充分匀浆后,4℃,10 000×g,30 min离心,取上清。用BCA蛋白浓度测定试剂盒(碧云天,P0012)测定总蛋白浓度,并用上样缓冲液调整蛋白浓度至40μg总蛋白/20μl缓冲液。
1.3 Quantitative Real Time PCR
按说明书要求制备Q-PCR反应体系(SYBR®Premix Ex TaqTM,Takara),使用PRISM 7900HT实时荧光定量PCR系统(Applied Biosystems)进行试验和分析。以18s rRNA作为内参基因。经预实验,PCR产物电泳条带清晰,无杂带,溶解曲线较好。
1.4 W estern blot检测
每个孔中加入20μl样品,进行SDS-PAGE(分离胶10%,浓缩胶5%)。按标准程序,转膜后用含5%的脱脂奶粉TBST封闭。加一抗(p53mousemAb,cell signaling)室温孵育2 h,一抗稀释倍数如下:高原鼢鼠样品1∶800,根田鼠样品1∶800(5%的脱脂奶粉的 TBS-T稀释),大鼠样品 1∶2 000(calbiochem,signalBoostTMimmunoreaction enhancer kit solution1)。用TBS-T漂洗,再加入二抗(山羊抗小鼠lgG),稀释倍数均为1∶2 000。室温孵育1 h后,用TBS-T漂洗。经ECL显影后,高原鼢鼠、根田鼠和大鼠p53蛋白条带单一,分子量正确。
1.5 统计学处理
数据用均数 ±标准误(¯x±Sx)表示,用 SPSS 15.0软件分析,两组间比较采用t检验。
2 结果
2.1 低氧对高原鼢鼠、根田鼠和大鼠肝脏p53 mRNA表达的调节
低氧6 h(8.0%O2)显著减少高原鼢鼠肝脏p53mRNA表达(P<0.05),而使根田鼠肝脏 p53 mRNA表达呈下降趋势(P>0.05,图 1A)。低氧 8 h(16.0%O2)没有改变大鼠肝脏p53 mRNA表达,而严重低氧 8 h(10.8% 和 8.0%O2)显著增加大鼠肝脏 p53mRNA表达(P<0.05,P<0.01,图 1B)。
2.2 低氧对高原鼢鼠、根田鼠和大鼠肝脏p53蛋白表达的调节
低氧6 h(8.0%O2)显著减少高原鼢鼠和根田鼠肝脏的p53蛋白表达(P<0.01,图 2A);低氧 8 h(16.0%O2)没有改变 p53蛋白表达,而严重低氧8 h(10.8%和8.0%O2)显著增加 p53蛋白表达(P<0.05,P<0.01)。
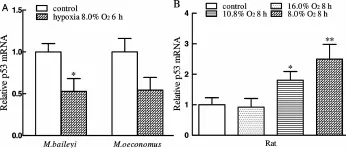
Fig.1 Effects of hypoxia on hepatic p53mRNA expression in M.baileyi,M.oeconomus and rat,relative amountof p53mRNA evaluated by the ratio of p53 to 18s(±sx,n=5,6)
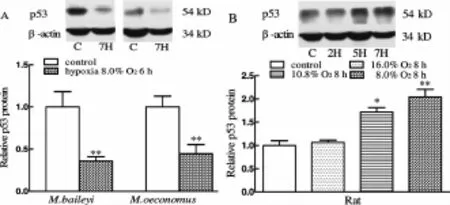
Fig.2 Effects of hypoxia on heaptic p53 protein expression in M.baileyi,M.oeconomus and rat,relative amountof p53 protein evaluated by the ratio of band optical density(±sx,n=5,6)
2.3 低氧对大鼠肝脏p53靶基因mRNA表达的调节
低氧8 h(16%O2)对大鼠肝脏凋亡靶基因bax和IGFBP3 mRNA表达没有影响;低氧8 h(10.8%O2)显著减少大鼠肝脏baxmRNA表达(P<0.01),而IGFBP3mRNA表达呈下降趋势;低氧 8 h(8.0%O2)相对于 10.8%低氧 8 h显著减少 IGFBP3mRNA表达(P<0.01),而 baxmRNA表达呈下降趋势(P>0.05);不同程度的低氧对Bcl-2 mRNA的表达均无显著影响(图 3A);低氧 8 h(10.8%和 8.0%O2)显著增加 p21 mRNA表达(P<0.01),但不同程度的低氧对大鼠肝脏cyclinB2 mRNA表达均无影响(图3 B)。
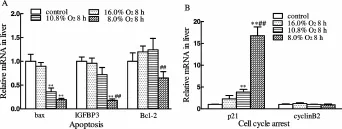
Fig.3 Effects of hypoxia on hepatic p53 downstream genesmRNA expression in rat,relative amountof p53 targetgenes evaluated by the ratio of p53 target genes toβ-actin(±sx,n=6)IGFBP3:Insulin-like growth factor binding protein 3;Bcl-2:B-cell lymphoma 2
3 讨论
低氧通常被认为能够促进 p53表达,A.Sermeus和 C.Michiel提出p53的表达水平与低氧程度相关,常氧时保持低浓度,轻度低氧依旧保持低浓度甚至会更低,而中度低氧和重度低氧时浓度显著升高[2]。我们发现,低氧(8.0%O2)处理6 h后,高原动物根田鼠、高原鼢鼠肝脏中p53 mRNA和蛋白表达水平均显著下降,而低氧(8.0%O2)处理8 h后,大鼠p53mRNA和蛋白表达则显著上升。平原动物和高原动物的这种差异可能是不同的调节机制,Coose JP等发现1%低氧16 h可以增加MCF-7(人乳腺癌细胞)细胞p53蛋白表达,但使HepG2细胞 p53蛋白减少[3],而 Pan Y等发现 HCT116(人结肠癌细胞)细胞在0.2%低氧过夜培养后,高浓度组(低氧处理前浓度为 3×105cells/60 mm)的细胞培养液 pH低于6.9,p53升高,低浓度组(低氧处理前浓度为 5×104cells/60 mm)细胞培养液pH不变,p53没有变化[4]。这些文献说明低氧是否诱导p53表达不仅与低氧程度,还与细胞类型、微环境均相关。根田鼠和高原鼢鼠长期生活在海拔3~5 km的高寒草甸,一方面,其低氧耐受性更强,面对一定程度的低氧,p53表达的下降可能对其生存是有利的,可能不易造成细胞凋亡;另一方面,低氧下重要的HIF-1α转录因子可能参与对p53的调节,Seok GL等发现HIF-1α的过表达可以抑制人p53蛋白的表达,我们实验室已经发现低氧(8.0%O2,6 h)可以显著增加高原鼢鼠HIF-1α蛋白的表达,而低氧也可以增加根田鼠HIF-1α蛋白[5],所以高原动物p53表达的下降可能和低氧诱导的 HIF-1α升高相关。平原动物大鼠在低氧(8.0%O2)处理8 h后,肝脏p53基因和蛋白明显上调,Iswar Baitharu等发现7.6 km低氧7 d能显著增加大鼠大脑海马区p53蛋白的表达,国内也有文献报道间歇低氧(10%O2,8 h/d)能促进大鼠肺p53蛋白的表达。低氧时,平原动物大鼠p53的增加则有利于选择性激活或抑制p53下游的各类靶基因,保护正常细胞。
平原动物大鼠在低氧(10.8%和 8.0%O2)处理 8 h后,肝脏p53 mRNA和蛋白表达显著上升,但p53下游与细胞凋亡相关的靶基因bax和IGFBP3的表达均显著下降,而与细胞周期停滞相关的靶基因p21的表达则显著上升。有研究报道大鼠血清IGFBP3蛋白随着间歇低氧程度(6% ~8%O2,8 s/each,6~24 times/1 h)的增加而下降。低氧上调 p53细胞周期停滞靶基因,而下调p53细胞凋亡靶基因,反映机体适应低氧的一种策略,缺氧时机体正常代谢受阻,细胞损伤的威胁加剧,为避免细胞遭到损伤,节省能量消耗,激活细胞周期停滞靶基因可以保护正常细胞,而细胞凋亡靶基因的抑制也起到保护正常细胞的作用。
总之,低氧对高原动物和平原动物p53表达的影响是不同的,低氧下调高原动物p53基因和蛋白的表达,而上调平原动物p53基因和蛋白的表达;平原动物低氧后上调细胞周期停滞靶基因的表达,同时下调细胞凋亡靶基因的表达。以上结果,反映不同动物肝脏p53及其靶基因低氧反应性的不同,提示高原动物和平原动物肝细胞p53及其靶基因在低氧应激时具有不同的表达模式。
[1] Zhao Y,Chen X Q,Du JZ.Cellular adaptation to hypoxia and p53 transcription regulation[J].J Zhejiang Univ Sci B,2009,10(5):404-410.
[2] Sermeus A,Michiels C.Reciprocal influence of the p53 and the hypoxic pathways[J].Cell Death Dis,2011,2:e164.
[3] Cosse JP,Sermeus A,Vannuvel Ketal.Differential effects of hypoxia on etoposide-induced apoptosis according to the cancer cell lines[J].Mol Cancer,2007,6:61.
[4] Pan Y,Oprysko PR,Asham A Met al.p53 cannot be induced by hypoxia alone but responds to the hypoxicmicroenvironment[J].Oncogene,2004,23(29):4975-4983.
[5] Chen X Q,Wang SJ,Du JZ.Diversities in hepatic HIF-1,IGF-I/IGFBP-1,LDH/ICD,and theirmRNA expressions induced by CoCl2in Qinghai-Tibetan plateau mammals and sea levelmice[J].Am J Physiol Regul Integr Comp Physiol,2007,292(1):R516-526.
