基于4-(4-甲氧基苯亚甲基氨基)苯甲酸的高选择性的Fe3+荧光传感器
2013-03-22张金丹刘爱荣梁金丽李金萍
张金丹,刘爱荣,梁金丽,李金萍,缪 谦
(温州大学化学与材料工程学院,浙江温州 325035)
基于4-(4-甲氧基苯亚甲基氨基)苯甲酸的高选择性的Fe3+荧光传感器
张金丹,刘爱荣,梁金丽,李金萍,缪 谦†
(温州大学化学与材料工程学院,浙江温州 325035)
构建了基于4-(4-甲氧基苯亚甲基氨基)苯甲酸(MBABA)的荧光化学传感器,用于95%乙醇介质中Fe3+的测定.常见金属离子共存时,荧光传感器MBABA可以选择性地与Fe3+形成1∶1的配合物而使其荧光被明显淬灭,Fe3+对MBABA的荧光淬灭常数KSV为4.71×104L∙mol−1.更强的配位剂F–可夺取MBABA-Fe3+配合物中的Fe3+,使MBABA的荧光恢复到原来的强度.本方法测定Fe3+的检测限达2.4×10−6mol∙L−1,表明MBABA可作为测定Fe3+的高灵敏度和专一性的荧光传感器.
4-(4-甲氧基苯亚甲基氨基)苯甲酸;荧光化学传感器;Fe3+
铁是人和动物体内含量最丰富的过渡金属元素,在一些涉及氧化还原的生理过程中起着重要作用[1-3].许多疾病与中枢神经系统铁的累积有关,如亨廷顿症、帕金森症、老年痴呆症等,但发育阶段铁缺乏又会导致不可逆的运动技能缺失,现已发现鼠的行为改变与铁缺乏有关[4].铁在生物的氧化还原过程和医学分析中具有重要作用[5],是环境和生物体系中最重要的元素之一,设计简单、高灵敏度、高选择性的测定Fe3+的化学传感器及建立痕量Fe3+的测量方法尤为必要.
最近,设计Fe3+荧光传感器的研究工作引起了广泛关注,这些荧光染料有罗丹明B衍生物[3,6-8]、杯芳烃衍生物[9]、喹啉衍生物[10-11]、香豆素衍生物[12-13]、杂环冠醚衍生物[14]、芴膦酸盐高分子[15]、菲并咪唑[16]、吡嗪基-1,2,4-三嗪[17]、蒽衍生物[18-19]、查尔酮衍生物[20]、苯并咪唑衍生物[21]、丹酰衍生物[22]等.但是许多荧光传感器由于受水溶性差、非专一性、检测限高、合成过程复杂等性质的影响,在实际应用中受到限制.所以开发设计新的Fe3+荧光传感器仍旧是我们面临的挑战.
Schiff碱具有结构多变性和可操作性,能与过渡金属离子形成稳定的配合物,在离子键合领域引起了越来越多的关注.通过调节Schiff碱的结构可以控制客体-主题配合物的几何构型、空腔大小、亲油性,使Schiff碱对特定的离子产生非常高的选择性、灵敏度.最近Schiff碱作为荧光传感器来测定Cu2+、Zn2+、Pb2+、Mn2+、Ni2+、Hg2+等阳离子引起了特别的关注[23-28].但是关于测定Fe3+的Schiff碱荧光传感器的报道却很少[5,29-30].4-(4-甲氧基苯亚甲基氨基)苯甲酸(MBABA)是具有一定配位能力的Schiff碱,已有文献报道化合物MBABA的合成方法[31-32]、抗菌活性[32]、电还原性[33]及其与Sn(IV)、Ru(II)所形成的配合物的性质[34-35],但关于化合物MBABA的离子传感性能未见报道.在此,我们构建了基于化合物MBABA的荧光化学传感器,用于95%乙醇介质中Fe3+的测量.Fe3+与化合物MBABA中的羧基配位形成1∶1的配合物从而使MBABA的荧光被淬灭.荧光传感器MBABA对Fe3+的测量具有高灵敏度和专一性.
1 实验部分
1.1 仪器与试剂
1H NMR在Bruker AVANCE-300核磁共振仪上测试.红外光谱在Bruker EQUINOX 55傅立叶变换红外光谱仪上测定.荧光光谱由HORIBA Jobin Yvon FluoroMax-4荧光光谱仪测定.循环伏安曲线在上海辰华仪器有限公司的CHI1030B多通道恒电位仪上测定.所有试剂均为分析纯,实验用水为二次蒸馏水.
1.2 化合物MBABA的合成
化合物MBABA可由对氨基苯甲酸和对甲氧基苯甲醛直接缩合得到[31],产率86%,熔点198 –200ºC.1H NMR(DMSO-d6,300 MHz)δ:3.84(s,3H,– OCH3),7.07 – 7.10(d,J = 8.58 Hz,2H,ArH),7.27 – 7.29(d,J = 8.16 Hz,2H,ArH),7.89 – 7.99(m,4H,ArH),8.55(s,1H,– HC = N),12.84(s,1H,– COOH).IR(KBr,cm-1):3 471.3(– OH str.),1 683.0(C = O str.),1 593.5(C = N str.),1 508.1(C = C str.),1 251.4(– OCH3str.).
化合物MBABA的合成见下式:

MBABA
1.3 金属离子的荧光光谱滴定
金属离子的荧光光谱滴定实验在3.0mL 5.0×10−4mol∙L−1化合物MBABA的95%乙醇溶液中进行.金属离子采用硝酸盐或盐酸盐,浓度为6.25 ×10−3mol∙L−1(水溶液).在滴定过程中,选择的金属盐加到3.0 mL化合物MBABA的95%乙醇溶液中后,不停地搅拌,5分钟后测定稳态荧光光谱.以二次蒸馏水代替金属离子溶液在相同条件下做空白试验.
1.4 循环伏安扫描
化合物MBABA的电化学行为及Fe3+对化合物MBABA的电化学响应采用循环伏安法(CV)来表征.MBABA的循环伏安扫描在浓度为1.0 × 10−4mol∙L−1的95%乙醇溶液(含浓度0.1 mol∙L−1过氯酸四丁基铵)中进行,采用三电极系统,玻碳电极为工作电极,铂丝电极为辅助电极,Ag/Ag+电极为参比电极,扫描速度为50 mV∙s−1.玻碳电极的处理:将玻碳电极分别用1.0 μm、0.3 μm、0.05 μm的Al2O3粉抛光,在二次水和无水乙醇中分别超声洗涤2 – 3 min,然后进行电化学活化处理,直到获得稳定的循环伏安响应.
1.5 红外光谱法研究化合物MBABA与Fe3+的配位作用
将化合物MBABA的95%乙醇溶液与Fe3+的水溶液等摩尔混合均匀,在红外灯下挥干溶剂,得到的粉末采用KBr压片后测量红外光谱.
2 结果与讨论
2.1 化合物MBABA对金属离子的响应信号变化
化合物MBABA的荧光发射光谱和Fe3+对化合物MBABA的荧光滴定曲线见图1.从图1可以看出,在95%乙醇溶液中,激发波长为354 nm时,化合物MBABA在408 nm处有一发射峰.Fe3+的加入没有改变化合物MBABA在408 nm处的荧光发射波长,但是荧光强度却随着Fe3+浓度的增大而逐渐减小.这些现象表明Fe3+和化合物MBABA之间生成了配合物[23,24,36].分子内的光致电子转移(PET)导致化合物MBABA到配合物MBABA-Fe3+有效的能量转移[37-38],这是荧光淬灭效果明显的原因.

图1 不同的摩尔比Fe3+存在时化合物MBABA的荧光发射光谱 (λex= 354 nm)
化合物MBABA对多种常见阳离子的荧光响应强度见图2.化合物MBABA在等浓度其它常见阳离子,如NH4+、Mg2+、Co2+、Ni2+、Cr3+、Ba2+、Ca2+、Pb2+、Cd2+、Al3+、 Zn2+、Fe2+存在下,荧光发射强度有不同程度的增强,但Cu2+、K+、Mn2+、Na+、Ag+、Hg2+对荧光发射强度几乎无影响.化合物MBABA对Fe3+与对其它常见阳离子荧光响应信号的明显差异表明化合物MBABA有望成为潜在的Fe3+的荧光化学传感器,特别是化合物MBABA能很好地区分不同化合价的铁(Fe2+和Fe3+),这在许多生物过程中是非常必要的[39].

图2 化合物MBABA对等浓度的不同阳离子的荧光响应强度 (λex= 354 nm)
Fe3+对化合物MBABA的荧光淬灭效果可以用Stern-Volmer常数即KSV来衡量.KSV的计算是利用荧光发射光谱的变化及Stern-Volmer方程[40]:F0/F = 1 + ΚSV[Q],式中F0是无淬灭剂存在时的荧光发射强度,F是有淬灭剂存在时的荧光发射强度,[Q]是淬灭剂浓度,即Fe3+的浓度.图3是Fe3+在1.5 × 10−5– 3.2×10−4mol∙L−1浓度范围内对MBABA的荧光淬灭Stern-Volmer图.从图3可以看出,F0/F与c(Fe3+)呈良好的线性关系,相关系数为0.996 4,斜率为0.471 2,根据斜率可求出KSV为4.71 × 104L∙mol−1.线性的Stern-Volmer曲线表明荧光团属于单一种类并且淬灭机理是单一类型的[24,36].
用循环伏安法测定了相同条件下化合物MBABA、Fe3+以及化合物MBABA溶液中加入Fe3+后的伏安性质,见图4.从图4的CV曲线可见,加入Fe3+后,化合物MBABA在– 0.219 V处的还原峰和– 0.008 V处的氧化峰的峰电流明显降低,并且在– 0.584 V处产生了新的还原峰,表明Fe3+和化合物MBABA形成了配合物.Fe3+和化合物MBABA的配位作用使得游离的化合物MBABA的浓度减小,所以化合物MBABA的氧化、还原峰电流降低.
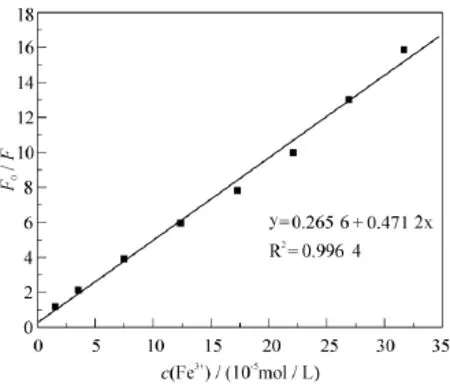
图3 Fe3+对化合物MBABA荧光淬灭的Stern-Volmer曲线
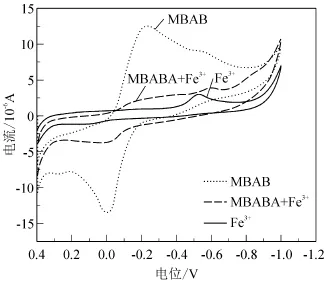
图4 化合物MBABA, Fe3+及其混合物的循环伏安曲线
用红外光谱法测定了化合物MBABA对Fe3+的响应,化合物MBABA及MBABA-Fe3+配合物的IR光谱数据见表1.化合物MBABA中羧基的C = O伸缩振动特征峰位于1 683.0cm−1处,C = N伸缩振动特征峰位于1 593.5cm−1处,羧基的O – H伸缩振动位于3 471.3cm−1处.MBABA与Fe3+配位后,羧基的反对称伸缩振动νas(COO)位于1 694.2cm−1,但羧基的对称伸缩振动峰被1 384.2cm−1处以离子形式存在的的强伸缩振动峰掩盖[41-42],O – H伸缩振动移至3 408.3cm−1处,但是C = N伸缩振动特征峰的峰位置改变很小,位于1 591.4cm−1处,表明化合物MBABA分子中C = N没有参与配位,羧基是铁离子的作用位点[43].

表1 化合物MBABA和配合物MBABA-Fe3+的红外光谱数据
2.2 配位比
图5为荧光发射光谱的相对荧光强度 (F0– F)/F0对摩尔比n (Fe3+)/n (MBABA)的关系曲线图,这里F0和F分别指不存在和存在Fe3+时化合物MBABA的荧光发射强度.从图5可以明显看出,n (Fe3+)/n (MBABA)在0 – 0.7范围内,(F0– F)/F0与n (Fe3+)/n (MBABA)呈良好的线性关系(相关因子R2= 0.975 2);当n (Fe3+)/n (MBABA)超过1.8后,(F0– F)/F0值达到一个平台.将曲线的两段线性部分延长,交点处n (Fe3+)/n (MBABA)的值为0.94,由此可知Fe3+与化合物MBABA形成配合物的配位比为1∶1[44].
2.3 可逆性
实用的化学传感器材料的一个重要标准是它的可逆性,换句话说就是要求这种材料在分析物存在时能够产生可测量的信号,在分析物不存在时就不会产生信号[15,45].根据这个要求,本文研究了与MBABA结合后的Fe3+的离去条件.把竞争配体,如F–加到含Fe3+的MBABA溶液中,Fe3+-MBABA对不同摩尔比的F–的荧光响应变化结果见图6.从图6可以看出,含Fe3+的MBABA的荧光随着F–浓度的增大而逐渐增强,当加入的F–与Fe3+的摩尔比为6∶1时,由于形成了[FeF6]3–配离子,导致Fe3+从配合物Fe3+-MBABA中解离,被Fe3+淬灭的MBABA的荧光几乎完全恢复.

图5 (F0– F)/F0与n (Fe3+)/n (MBABA)的关系曲线(λex= 354 nm, λem= 408 nm)
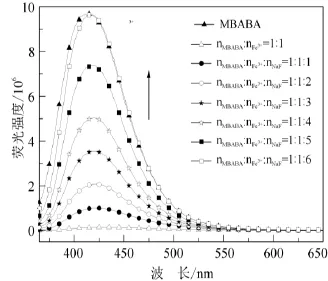
图6 化合物MBABA的荧光可逆性(λex= 354 nm)
2.4 选择性
选择性是化学传感器最重要的特性之一.本文研究了一些常见离子对Fe3+-MBABA的荧光淬灭比率η的影响.淬灭比率的计算公式为:η = 1 –.荧光传感器的选择性研究结果见图7.
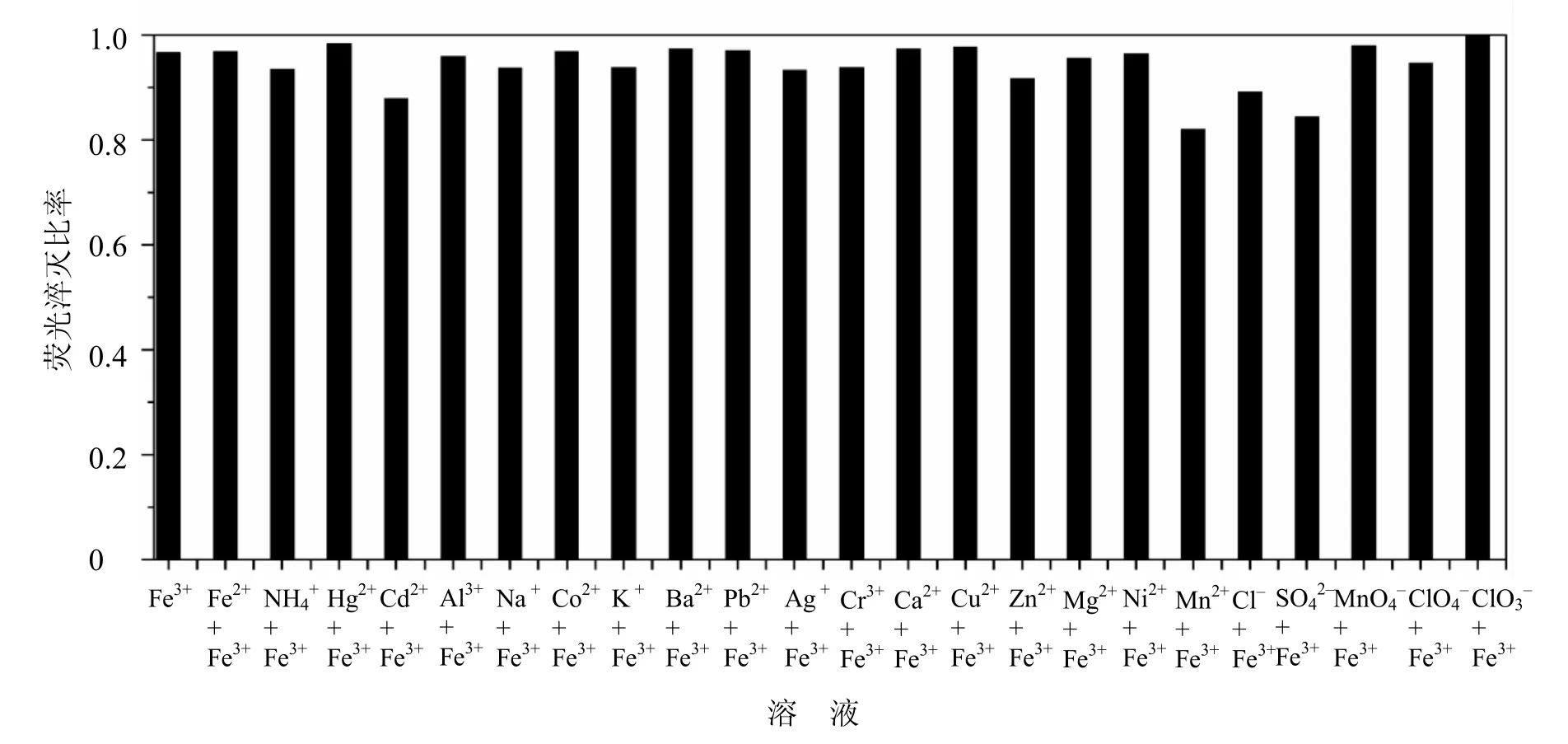
图7 同浓度的干扰离子共存时Fe3+对化合物MBABA的荧光淬灭比率(λex= 354 nm)
从图7可以看出,同浓度(5.0 × 10−4mol∙L−1)的共存阳离子(如Fe2+、NH4+、Hg2+、Cd2+、Al3+、Na+、Co2+、K+、Ba2+、Pb2+、Ag+、Cr3+、Ca2+、Cu2+、Zn2+、Mg2+、Ni2+、Mn2+)和阴离子(如Cl–、SO42–、MnO4–、ClO4–、ClO3–)基本不干扰Fe3+的测量.结果表明MBABA可作为测定Fe3+的专一性的荧光传感器.
2.5 分析应用
从Fe3+对MBABA的荧光淬灭Stern-Volmer图(图3)可以得出,在1.5 × 10–5– 3.2 × 10−4mol∙L−1内,F0/F与c(Fe3+)呈良好线性关系,方程为 y = 0.265 6 + 0.471 2x,R2= 0.996 4,n = 8.根据以上方程的斜率和空白溶液测定值的标准偏差,求出对Fe3+的检测限为2.4 × 10−6mol∙L−1[25,46].在相同条件下,用荧光法测量了合成的样品溶液[29]中Fe3+的浓度,结果如表2所示,样品的回收率和相对标准偏差都较满意.

表2 合成样品中Fe3+的测量 (n = 5)
3 结 语
通过荧光光谱研究了4-(4-甲氧基苯亚甲基氨基)苯甲酸(MBABA)对金属离子的响应性质,结果表明:Fe3+与MBABA形成1∶1的配合物从而选择性地淬灭了MBABA的荧光;更强配位剂F−可夺取配合物MBABA-Fe3+中的Fe3+,使MBABA的荧光恢复到原来的强度;荧光传感器MBABA的选择性、线性范围、检测限等性能及合成样品的回收率、标准偏差等测定结果都令人满意.所以,以羧基为作用位点的化合物MBABA可作为测定Fe3+的高选择性传感器.
[1] Liang Z Q, Wang C X, Yang J X, et al.A highly selective colorimetric chemosensor for detecting the respective amounts of iron(II)and iron(III)ions in water [J].New J Chem, 2007, 31(6):906-910.
[2] Pulido-Tofino P, Barrero-Moreno J M, Pérez-Conde M C.A flow-through fluorescent sensor to determine Fe(III)and total inorganic iron [J].Talanta, 2000, 51(3):537-545.
[3] Zhang L Z, Fan J L, Peng X J.X-ray crystallographic and photophysical properties of rhodamine-based chemosensor for Fe3+[J].Spectrochim Actat A, 2009, 73(2):398-402.
[4] James P.S, Raoul K.Alexa Fluor 488 as an iron sensing molecule and its application in PEBBLE nanosensors [J].Analyst, 2005, 130(4):528-533.
[5] Ozlem O, Kadriye E, Rafet K, et al.Photocharacterization of a novel fluorescent Schiff Base and investigation of its utility as an optical Fe3+sensor in PVC matrix [J].Dyes and Pigments, 2007, 74(3):730-735.
[6] Xu M Y, Wu S Z, Zeng F, et al.Cyclodextrin supramolecular complex as a water-soluble ratiometric sensor for ferric ion sensing [J].Langmuir, 2010, 26(6):4529-4534.
[7] Zhang X, Shiraishi Y, Hirai T.A new rhodamine-based fluorescent chemosensor for transition metal cations synthesized by one-step facile condensation [J].Tetrahedron Lett, 2007, 48(31):5455-5459.
[8] Xiang Y, Tong A J.A new rhodamine-based chemosensor exhibiting selective FeIII-amplified fluorescence [J].Org Lett, 2006, 8(8):1549-1552.
[9] Liu J M, Zheng Q Y, Yang J L, et al.A new fluorescent chemosensor for Fe3+and Cu2+based on calix[4]arene [J].Tetrahedron Lett, 2002, 43(50):9209-9212.

[11] Tumambac G E, Rosencrance C M, Wolf C.Selective metal ion recognition using a fluorescent 1,8-diquinolylnaphthalene-derived sensor in aqueous solution [J].Tetrahedron, 2004, 60(49):11293-11297.
[12] Lim N C, Pavlova S V, Brückner C.Squaramide hydroxamate-based chemidosimeter responding to iron(III)with a fluorescence intensity increase [J].Inorg Chem, 2009, 48(3):1173-1182.
[13] Ma Y M, Luo W, Quinn P J, et al.Design, Synthesis, physicochemical properties, and evaluation of novel Iron chelators with fluorescent sensors [J].J Med Chem, 2004, 47(25):6349-6362.
[14] Bricks J L, Kovalchuk A, Trieflinger C, et al.On the development of sensor molecules that display FeIII-amplified fluorescence [J].J Am Chem Soc, 2005, 127(39):13522-13529.
[15] Wu X F, Xu B W, Tong H, et al.Phosphonate-functionalized polyfluorene film sensors for sensitive detection of iron(III)in both organic and aqueous media [J].Macromolecules, 2010, 43(21):8917-8923.
[16] Lin W Y, Long L L, Yuan L, et al.A novel ratiometric fluorescent Fe3+sensor based on a phenanthroimidazole chromophore [J].Anal Chim Acta, 2009, 634(2):262-266.
[17] Thirumurugan P, Perumal P T.The synthesis and photophysical studies of pyridinyl-1,2,4-triazine derivatives and use as a fluorescent sensor for ferric salts [J].Dyes and Pigments, 2011, 88(3):403-412.
[18] Lohani C R, Kim J M, Lee K H.Facile synthesis of anthracene-appended amino acids as highly selective and sensitive fluorescent Fe3+ion sensors [J].Bioorg Med Chem Lett, 2009, 19(21):6069-6073.
[19] Li Z X, Zhang L F, Zhao W Y, et al.Fluoranthene-based pyridine as fluorescent chemosensor for Fe3+[J].Inorg Chem Commun, 2011, 14(10):1656-1658.
[20] Wei Y L, Qin G J, Wang W Y, et al.Development of fluorescent FeIIIsensor based on chalcone [J].J Lumin, 2011, 131(8):1672-1676.
[21] Lee D Y, Singh N, Jang D O.A benzimidazole-based single molecular multianalyte fluorescent probe for the simultaneous analysis of Cu2+and Fe3+[J].Tetrahedron Lett, 2010, 51(7):1103-1106.
[22] Smanmoo S, Nasomphan W, Tangboriboonrat P.Highly selective fluorescent chemosensor for Fe3+imaging in living cells [J].Inorg Chem Commun, 2011, 14(2):351-354.
[23] Wang S C, Men G W, Zhao L Y, et al.Binaphthyl-derived salicylidene Schiff base for dual-channel sensing of Cu, Zn cations and integrated molecular logic gates [J].Sensors and Actuators B, 2010, 145(2):826-831.
[24] Aksuner N, Henden E, Yilmaz I, et al.A highly sensitive and selective fluorescent sensor for the determination of copper(II)based on a schiff base [J].Dyes and Pigments, 2009, 83(2):211-217.


[26] Guo L Q, Hong S C, Lin X C, et al.An organically modified sol-gel membrane for detection of lead ion by using 2-hydroxy-1-naphthaldehydene-8-aminoquinoline as fluorescence probe [J].Sensors and Actuators B, 2008, 130(2):789-794.
[27] Singh N, Kaur N, Choitir C N, et al.A dual detecting polymeric sensor:chromogenic naked eye detection of silver and ratiometric fluorescent detection of manganese [J].Tetrahedron Lett, 2009, 50(29):4201-4204.
[28] Wang J Q, Huang L, Xue M, et al.Developing a novel fluorescence chemosensor by self-assembly of bis-schiff base within the channel of mesoporous SBA-15 for sensitive detecting of Hg2+ions [J].Appl Surf Sci, 2008, 254(17):5329-5335.
[29] Dong L, Wu C, Zeng X, et al.The synthesis of a rhodamine B schiff-base chemosensor and recognition properties for Fe3+in neutral ethanol aqueous solution [J].Sensors and Actuators B, 2010, 145(1):433-437.
[30] Ghosh S, Chakrabarty R, Mukherjee P S.Design, synthesis, and characterizations of a series of Pt4macrocycles and fluorescent sensing of Fe3+/Cu2+/Ni2+through metal coordination [J].Inorg Chem, 2009, 48(2):549-556.
[31] Rawal M K, Sahu A, Ameta R, et al.Punjabi P B.Microwave assisted synthesis of some schiff bases on NaY zeolite:a green chemical approach [J].Int J ChemTech Res, 2009, 1(4):1182-1185.
[32] Dilmaghani K A, Jazani N H, Behrouz A, et al.Synthesis, characterization and antibacterial activity of some schiff bases derived from 4-aminobenzoic acid [J].Asian J Chem, 2009, 21(8):5947-5954.
[33] Osman A M, El-Cheikh F, Khalill Z H, et al.Studies on the electrosynthesis of organic compounds II.reducibility of some schiff’s bases on lead and copper cathodes [J].Appl Chem Biotech, 1976, 26(1):126-130.
[34] Deng C Y, Lin Z Y, Yang M L, et al.Microwave synthesis of Schiff-bases and their organotin complexes [J].Adv Mater Res, 2011, 201-203:2550-2553.
[35] Howon M G, Nedhool D.Synthesis and characterization of some ruthenium(II)schiff base complexes, synthesis and reactivity [J].Synth React Inorg Met-Org Chem, 1999, 29(4):607-620.
[36] Aksuner N, Henden E, Yilmaz I, et al.Selective optical sensing of copper(II)ions based on a novel cyclobutanesubstituted schiff base ligand embedded in polymer films [J].Sensors and Actuators B, 2008, 134(2):510-515.
[37] Fan L J, Zhang Y, Murphy C B, et al.Fluorescent conjugated polymer molecular wire chemosensors for transition metal ion recognition and signaling [J].Coord Chem Rev, 2009, 253(3-4):410-422.

[43] 张玲菲,赵江林,曾晞,等.苯基乙酰丙酮-罗丹明B衍生物的合成及对Fe3+离子的识别性质研究[J].无机化学学报, 2010, 26(10):1796-1803.
[44] Wang J Q, Huang L, Gao L, et al.A small and robust Al(III)-chemosensor based on bis-schiff base N,N′- (1,4-phenylenedimethylidyne)bis-1,4-benzene diamine [J].Inorg Chem Commun, 2008, 11(2):203-206.
[45] Wang B, Wasielewski M R.Design and synthesis of metal ion-recognition-induced conjugated polymers:an approach to metal ion sensory materials [J].J Am Chem Soc, 1997, 119(1):12-21.
[46] Huang X B, Meng J, Dong Y, et al.Polymer-based fluorescence sensor incorporating triazole moieties for Hg2+detection via click reaction [J].Polymer, 2010, 51(14):3064-3067.
A Highly Selective Fluorescent Sensor for Fe3+Based on 4-(4-methoxybenzylideneamino)Benzoic Acid
ZHANG Jindan, LIU Airong, LIANG Jinli, LI Jinping, MIAO Qian
(College of Chemistry and Materials Engineering, Wenzhou University, Wenzhou, China 325035)
A fluorescent chemosensor based on 4-(4-methoxybenzylideneamino)benzoic acid (MBABA)was constructed for detecting Fe3+in 95% ethanol solution.Fluorescent chemosensor MBABA can selectively coordinate with Fe3+under other commonly coexistent metal ions resulting in 1:1 MBABA-Fe3+complex, which causes the fluorescence of MBABA obviously quenched by Fe3+.The quenching constant KSVof Fe3+to MBABA is 4.71×104L∙mol-1.The fluorescence intensity of MBABA was regained when the metal was removed by a stronger chelating ligand F−.The detection limit for Fe3+was as low as 2.4×10-6mol∙L−1, indicating MBABA can be treated as a sensitive and specific fluorescence sensor for Fe3+detection.
4-(4-methoxybenzylideneamino)Benzoic Acid;Fluorescent Chemosensor;Fe3+
O65
A
1674-3563(2013)02-0036-09
10.3875/j.issn.1674-3563.2013.02.007 本文的PDF文件可以从xuebao.wzu.edu.cn获得
(编辑:王一芳)
2012-10-15
浙江省自然科学基金(406068)
张金丹(1988- ),女,河南新乡人,硕士研究生,研究方向:功能材料合成与分析化学.† 通讯作者,mq0577@yahoo.com.cn
