藻类对痕量金属元素的吸收研究
2013-03-20张焕玲李文君李铁朱茂旭杨桂朋
张焕玲,李文君,李铁,2,朱茂旭,2,杨桂朋,2
(1.中国海洋大学化学化工学院,山东 青岛 266100;2.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
随着现代工业的发展,环境污染日益严重并且生态环境日益恶化,水体污染成为影响人类健康的重要因素(鲁意扬 等,2001;李希彬等,2012;刘浩等,2011)。水体中的重金属污染又占很大的一部分,水溶液中的重金属污染能够通过食物链逐渐积累而对生物产生毒害效应(Figueira et al,1999;沈春燕等,2008)。工业废水中去除重金属污染的常规方法是化学沉降、过滤、离子交换、电化学处理或者是膜工艺(Herrero et al,2006;Davis et al,2003;Senthilkumar et al,2007;Asbchin et al,2008;Leusch et al,1995)。然而这些技术有的效率不高,达不到需要的要求;有的即使效率可以达到要求,但是成本太高,尤其是在大量水体中而重金属的浓度又很低时。因此,后来一些的研究中逐渐采用价格比较低的生物材料(如:细菌、真菌和海藻) 代替传统的技术来清除工业废水中的重金属污染(Herrero et al,2006)。
通过价格较低的生物材料来清除有毒的重金属,如Cd2+、Cu2+、Zn2+、Pb2+、Cr3+、Hg2+的过程叫做生物吸附(Davis et al,2003)。生物吸附是一个新兴的研究领域,这种方法原料廉价易得,既适合于含高浓度金属离子的水体,又适合于含低浓度金属离子的水体;具有不产生二次污染、吸附容量大、去除效率高等诸多优点,国外从20 世纪80年代开始从事这方面的研究,90年代发展较快(Leusch et al,1995;Wilke et al,1999)。通过测量有机体内形态学、组织学和生理学的变化可以反映它们所居住的水生生态环境物理和化学的变化。藻类在水生态系中广泛存在,并且有很强的适应环境的能力。它们可以作为吸收金属的很好的材料(Rajfur et al,2010),也可作为湖泊、河流和海洋的生物指示物。藻类是水体中的初级生产者,作为自养生物需从环境中吸取足够的无机盐,进行同化作用,某些藻类还具有很高的富集某些重金属元素的能力(孔繁祥,1993)。藻类作为生物吸附剂吸附分离重金属离子,其优点是吸附容量大、选择性强、吸附效率高并且消耗少。利用藻类来吸附重金属不仅有理论意义,并且有很强的环境效益,这种方法具有广泛的应用前景。
1 藻类与重金属的作用机理
Stumm 等(1996)就痕量金属对单细胞的浮游藻类生长的影响问题指出,有些痕量金属对于藻的生长起到很重要的作用,如Fe、Ni、Cd、Zn、Cu等,在金属的浓度很低的时候,藻的生长会受到限制;随着金属浓度的增加,藻的生长会处在一个最佳的状态;金属浓度继续增加就会对藻的生长产生毒性。简建波等(1997) 在研究Cu2+对三角褐指藻生长的影响时发现Cu2+浓度较低(0.25 mg/L,0.5 mg/L) 时,三角褐指藻的生长受到刺激,而在Cu2+浓度较高(1.5 mg/L) 时,三角褐指藻的生长受到抑制。王丽平等(2007) 在实验中发现,Cu2+浓度增加到0.317 μg/mL 时,三角褐指藻的增值明显受到抑制。浮游植物对痕量金属的吸收大多数情况下涉及到两个过程:首先是金属与细胞释放的配体或细胞表面带有官能团的配体作用结合到细胞表面形成络合物,然后金属络合物通过细胞膜运送到细胞内部(Stumm et al,1996)。藻类对重金属的吸收是静电吸引和络合作用共同作用的结果(Figueira et al,1999)。藻类吸收重金属的机理是十分复杂的,按其细胞壁的新陈代谢过程可分为的方式如下:
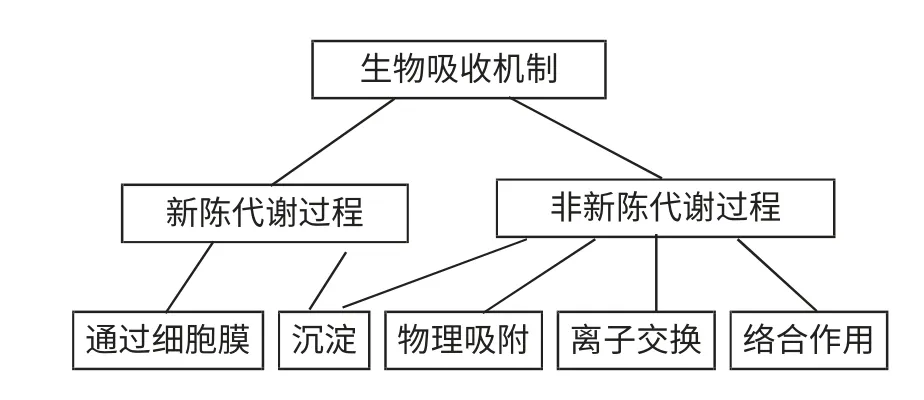
图1 藻类吸收重金属的方式(Veglio et al,1997)
藻类细胞壁上的多糖、蛋白质、磷脂等多聚复合体给藻类提供了大量可以与金属离子结合的官能团,这些官能团排列在藻类细胞壁上,与金属离子充分接触。其中有些可以失去质子而带负电荷,再靠静电引力吸附金属离子;有的带孤对电子与金属离子形成配位键而络合吸附金属离子(陆开形等,2006)。藻类吸收Pb2+的实验中,50%的吸收是由于离子交换,30%的吸收归因于沉淀机制,另外的20%是由于络合机制(Hawari et al,2006)。在上述吸收机制的分类中,沉淀和离子交换主要依靠的是藻类细胞表面的官能团,下面主要介绍官能团、离子交换和络合作用。
1.1 官能团
藻类结合金属的能力是与细胞的结构组成有关,细胞的主要成分主要有水、蛋白质、核酸、多糖、油脂、无机盐和矿物元素。已经被证实的是生物分子、蛋白质、多糖和细胞外的聚合物包含不同的表面官能团,如羧基、羰基、羟基、氨基、磷酸基和磺酸基等(Senthilkumaar et al,2000;Greene et al,1987)。海藻细胞表面包含多种官能团,氨基、磷酸酯基、巯基、羧基、羟基官能团和氨基酸残留物的官能团链,如组氨酸、半光氨酸、冬氨酸和谷氨酸是海藻吸附金属离子的潜在位置(Sigg,1987)。羧基官能团是褐藻细胞中的主要的官能团,在褐藻细胞中占据主要的吸附位置,这些位置直接决定了褐藻对金属的吸收能力(Davis et al,2003)。
1.2 离子交换
离子交换在生物吸附过程中是一个很重要的过程,它可以解释很多在重金属吸附实验中观察到的现象(Davis et al,2003)。金属离子和蛋白质在生物表面的相互作用与H+和蛋白质的相互作用相似,蛋白质上的结合位点对于金属和H+都是等同的。当水体在pH 值较低时,蛋白质上的结合位点会结合质子;pH 值较高时就会与Ca2+、Mg2+、Na+结合。当溶液中含有或者是被加入Cu2+、Mn2+、Zn2+、Ni2+、Cd2+、Fe3+、Pb2+时,这些金属离子就会与蛋白质表面结合的H+或Na+、Mg2+、Ca2+发生离子交换,从而达到吸收金属离子的目的。以藻细胞表面的官能团,如羧基、氨基、巯基、羟基等,通过释放H+来获得电荷,进而结合金属阳离子为例(Davila,1995),即质子与金属间的离子交换:
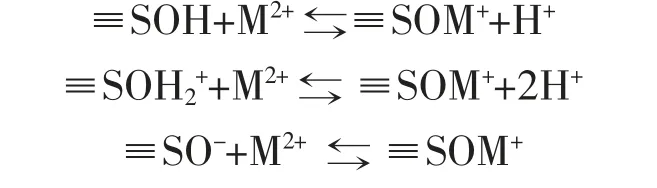
在离子交换的过程中也可能伴随着物理吸附(Leusch et al,1995;Zhang et al,1997)。如Na+和Mg2+会促进离子交换的进行,而溶液中加入Ag+会与藻的菌体结构架桥从而增强对Ag+的吸收(Zhang et al,1997)。
1.3 络合作用
重金属可与藻细胞表面的官能团螯合,同超富集高等植物一样,金属硫蛋白(MT)、植物螯合肽(PC) 等重金属结合蛋白陆续在藻类中发现,从而将有害的金属离子形式转变为无害的蛋白结合形式(陆开形等,2006)。金属离子的吸收首先是与细胞上的官能团络合,如Semeniuk 等(2009)在研究北太平洋海域中浮游植物对Cu 的需求与吸收的实验时发现,Cu 首先与含有不同官能团的四种合成配体络合,加入的四种配体的量是Cu 含量的10倍,以保证完全络合。Cu 与天然配体中的带有N和S 原子的官能团络合的速率很快,而Cu 与EDTA 络合的速率较慢,这主要归结为Cu 与Ca-EDTA 发生离子交换的速率很慢所致(Semeniuk et al,2009)。Farias 等(2002)在研究南极大型藻类中痕量金属的毒性时指出,藻类的细胞壁由多种多糖和蛋白质构成,包括带负电荷的羧基、硫酸盐或磷酸盐官能团,他们能与金属很好的络合,而络合的金属与周围水体的交换很少。正如Vasconcelos等(2001)指出的那样,海藻释放到培养基上的有机配体并不是缓冲痕量金属,而是在很大程度上改变痕量金属的存在形式以及生物可利用性,从而影响对痕量金属的吸收。Andrade 等(2010) 的研究指出Zn 和Cd 的存在会刺激细胞壁合成细胞壁多糖,多糖能够与金属离子进行离子交换,从而避免金属进入细胞质,预防重金属的毒害效应。
2 藻类对痕量金属的吸收
2.1 藻类吸收痕量金属的意义
痕量金属会对水体中的有机体产生直接的毒性,并且会在很多大型的海洋物种中积累,在不同的环境中,细菌、真菌、贻贝、鱼类和藻类等已经被证实可以用作吸收痕量金属的有效的吸附剂(Pucci et al,1996;Bargagli et al,1996)。海藻可以用于表层水的指示剂,分析表层水中的重金属,因其浓度较低,需要进行预浓集,通常用海藻来对表层水中的金属进行预浓集,进一步评价表层海水的污染情况(Rajfur et al,2010)。Topcuoglu 等(2003) 在研究黑海的土耳其海岸海藻的重金属指示时,发现测定海洋生物体中的重金属含量通常比测定海水和沉积物样品中的金属含量简单。这是因为海水中金属含量很低,并且分布很不均匀,沉积物样品中的金属含量又容易被有机物、颗粒物在一定pH 下通过氧化还原作用转化。海藻吸收了海水中的痕量金属之后,就可以通过测定藻体内痕量金属的浓度来进一步判定海水中痕量金属的浓度,从而进一步研究减少水体污染的方法。
知道浮游植物对痕量金属吸收的浓度,对于了解浮游植物对痕量元素的需求、浮游植物对痕量元素吸收的机制以及痕量元素的生物地球化学循环都有十分重要的意义(Tang et al,2006)。
2.2 藻类对重金属吸收的影响因素
2.2.1 藻的种类
一般来说,不同类型的藻对重金属的吸附能力有很大的不同。例如,对于二价重金属离子的吸收,细菌吸收值的典型范围是在0.05~0.2 mmol/g;真菌和酵母菌的吸收值在0.2~0.5 mmol/g;淡水藻的吸收值是0.5~1.0 mmol/g;海水藻的吸收值是1.0~1.5 mmol/g(Yu et al,1998)。其中海水中不同的藻类吸收值又会有不同。重金属的吸收主要发生在海藻细胞壁上,不同类型的海藻细胞壁上所含的主要的官能团不同,导致吸收重金属的能力不同。褐藻的细胞壁主要由三种成分构成:纤维素(细胞的结构骨架)、海藻酸(一种甘露糖醛酸聚合物和与钠盐、钾盐、镁盐、钙盐相对应的古罗糖醛酸)、磷酸盐多聚糖。这类海藻主要的活性官能团是羧基和含硫的官能团。红藻也包括纤维素,但是与金属的吸附相关的是由硫酸盐多聚糖组成的半乳糖,而绿藻主要的是纤维素,并且细胞壁中很大成分是由蛋白质结合多糖组成的糖蛋白(Romera et al,2007)。由于褐藻的细胞壁上有藻朊酸盐的成分,所以褐藻比其他种类的海藻吸收金属的能力都强(Davis et al,2003;Yu et al,1998)。然而有些绿藻(C. tomentosum 和U. lactuca) 和一些红藻(H.valentiae 和G. crassa) 对Pb2+的吸收又比S. polycystum 具有更强的吸收能力(孔繁祥,1993)。Farias 等(2002)2139在研究11 种藻对金属的吸收时发现,11 种样品中As 的含量都很高,但是在Himantothallus grandifolius 中的含量最高,明显高于其他藻种。另外,礁膜属植物与其他种类的植物相比优先吸收Fe、Se 和V,三者的浓度分别达到3 095、6.55 和38.4 μg/g。痕量金属水平最高的是礁膜属植物和南极褐尾食果鼠,其中礁膜属植物不能有效地积累As、Cd、Pb 三种元素。Rajfur 等(2010)研究发现,分析亚丁湾样品中的绿藻门、褐藻门和红藻门植物中的重金属,发现金属浓度最高的是绿藻门植物,金属浓度最低的是红藻门植物。Lin 等(1999) 研究发现,室温下pH 在4.0~5.0 之间时,Sargassum kjellmanianum 对Cu2+和Cd2+单独存在于水中的饱和吸附量分别是1.50 和0.8 mmol/L;相同条件下,Laminaria japonica 对Cu2+和Cd2+单独存在于水中的饱和吸附量分别大于1.10 和0.8 mmol/L。
2.2.2 培养基上的金属浓度
藻对金属的吸收也与培养基上金属的浓度有关。Ghimire 等(2008)在研究中还发现藻类对金属离子的吸收随培养基上金属离子浓度的增加而增加,直至达到饱和时,吸收不再增加。对于各个金属的最大吸收容量是Pb2+为1.35 mol/kg、Cd2+为1.1 mol/kg、Fe3+为1.53 mol/kg、La3+和Ce3+均为0.87 mol/kg(Ghimire et al,2008)。
一种金属的浓度不同,可能会影响到浮游植物对其他金属的需求。Semeniuk 等(2009)在研究亚北极太平洋中浮游植物对Cu 的需求及其吸收时,发现Cu 在开阔大洋浮游植物的生理活动中起着关键性的作用,并且当海水中Fe 的浓度较低时则细胞对Cu 的需求量就会增大。培养基上的金属离子在浮游植物细胞吸收的过程中会相互影响。Vasconcelos 等(2001)在研究中发现当培养基上Pb2+浓度增加时,细胞对Cu2+的吸收就会下降,同样的Cd2+对于Cu2+的吸收也起到抵制作用。在活的有机体中,通过各种酶和电子传递系统,可以从金属中获得微量营养盐。但是细胞中的一种痕量金属的浓度往往会影响其他痕量金属的浓度(Casiano et al,1997)。Zn 是浮游植物生长所必须的元素,但是浓度过高时会阻碍其他必须痕量元素的新陈代谢而对细胞的生长产生毒性(Sunda,1989)。
2.2.3 金属的选择性吸收
藻对金属的吸收具有选择性,一种金属的去除可能会影响其他金属离子的吸收。Andrade 等(2010) 在研究褐藻细胞壁中的多糖在抵抗重金属毒性时的保护机制时,发现在金属的初始浓度是1 mg/L 时,细胞对Pb2+的吸收比对Cd2+的吸收高3倍;而在初始浓度较高(40~900 mg/L) 时,细胞对Cd2+的吸收又比Pb2+高的多。Ghimire 等(2008)在研究中发现,对于Pb2+、Cd2+、Cu2+、Zn2+、Ni2+、Fe3+、Al3+、La3+、Ce3+这几种金属中,藻对Pb2+的选择性最高,相同的条件下,对Pb2+的吸收值最大。Rajfur 等(2010)的研究中也发现,用藻类来清除沉积物中的重金属后,测得沉积物中金属浓度顺序是Cr>Pb>Cd,而在水体中金属浓度顺序是Cr>Cd>Pb。
Farias 等(2002)的研究中指出,在研究的11种海藻中,测得细胞内的Fe 和Sr 的浓度是最大的,而有些物种中测得细胞内的Cu 的含量比较低,元素V 测得有很宽的浓度范围,有最小的浓度波动的是Mo 和Ni。Hawari 等(2006)也指出用Ca 处理生物以后,对Pb2+、Cd2+、Cu2+和Ni2+的平均吸收量分别为1.55、0.88、0.89 和0.51 meq/g。
重金属与一些基本的金属通过活性酶或者是蛋白质膜结合,以及重金属与具有生物活性的官能团反应时,往往会表现出他们的毒性效应,这样会中断藻细胞正常的新陈代谢过程(Visvili et al,1991)。细胞在吸收重金属的过程中,金属之间的相互关系也起到很重要的作用,对于细胞的生长有的起到协同作用,而有的金属之间对于细胞的生长就是拮抗作用。在不同的真核植物中Zn 和Co 可以代替彼此的新陈代谢过程(Sunda et al,1995a)。细胞对Co 的吸收随着培养基上Zn 离子浓度的降低而增加(Vasconcelos et al,2001)。
2.2.4 温度
温度会影响藻类对重金属的吸收。Aksu 等(1992) 在研究中发现,只有温度在20~35 ℃时温度不会影响藻类对金属的吸收,超出这个范围,吸收就会受到温度的影响。褐藻、绿藻和红藻这三种藻类对Pb2+有最大吸收值时的温度是30℃(Senthilkumar et al,2007)。Li 等(2011)的研究中指出,对于Cd2+、Pb2+和Cu2+在温度为303 K 时吸收达到最佳效果。Rousch(1998) 在研究矿业废水中海藻的分布时指出,藻类适宜的生存温度为24±2 ℃。
2.2.5 pH
pH 似乎是研究藻类对金属的吸附中的一个重要因素,它不仅影响溶液中金属的化学过程,还影响生物体中官能团的浓度以及溶液中金属离子的竞争(Aksu et al,1992)。浮游植物事先用无机酸处理,暴露处于金属结合的位点,之后在离子交换的过程中不断地释放H+,使周围溶液中的pH 逐渐降低,低的pH 值又会显著的降低金属的吸附容量(Hawari et al,2006)。Romera 等(2007)的研究中发现,藻类对金属最大的吸收时,最佳的pH 是在2~6。在pH 小于2 时,高的质子浓度使金属的吸收减少;pH 大于6 时,金属离子又易于产生沉淀。Herrero 等(2006)在研究死亡藻体的Cd2+和H+的相互作用时发现,Cd2+的吸收随pH 的增大而增大,当pH 达到5 时,吸收达到最大值。Davila(1995)的研究中也发现,金属与H+发生离子交换时,pH会影响交换时的平衡常数。Ghimire 等(2008)在海带藻对金属离子的吸收时发现,金属离子的吸收随pH 的增加而增加。在微酸的情况下,大约有80%~100%的金属能够被吸收。
藻类吸收金属最适宜的pH 范围是4~5(Yu et al,1998),对Pb2+吸收的最大值也在这一范围内被发现。在低pH 值时,H+与Pb2+在结合位点发生竞争,导致对Pb2+的吸收较低;高pH 值时,溶液中的Pb2+与细胞表面的H+发生离子交换,使得细胞对Pb2+的吸收较高(Senthilkumar et al,2007)。Semeniuk 等(2009)在研究在不同Fe 含量下,海藻对Cu2+的需求以及获得量时是把pH 调到8,然后再用盐溶液冲洗来除去细胞表面多余的放射性核素。Li 等(2011)的研究中指出,对于Cd2+、Pb2+、和Cu2+吸收的最佳pH 是5。
2.2.6 金属元素间的相互作用及其影响
对于海洋微型藻来说,Pb2+和Cd2+对于Cu2+的吸收都起到拮抗作用(Vasconcelos et al,2001)。研究沿岸硅藻中的Thalassiosira pseudonana 发现其对Cu 的吸收与Zn 和Mn 都产生拮抗作用(Rueter et al,1982;Sunda et al,1983)。而Zn、Cu、Cd 的毒性与Mn 形成拮抗作用。硅藻中Cd 浓度不仅与周围Cd2+浓度有关,还与Mn2+和Zn2+浓度有关(Sunda et al,1996)。Ganeli 等(1993) 发现在Kattegat 地区Co 的可利用性可决定浮游植物的生物量以及群落结构。Co 和Zn 的比例会影响硅藻的生长,高的[Zn2+] /[Co2+] 比例会促进硅藻的生长(Sunda et al,1995b)。浮游植物还是痕量金属(如Al) 进入深海食物链的重要载体(Quiroz et al,2008)。
2.3 藻类和重金属的收集
藻类的收集分网采和实验室培养收集两方面。网采浮游植物样品用海水冲洗以除去海盐和其他污染物质,之后样品用蒸馏水冲洗,于85℃烘干(Topcuoglu et al,2003)。重金属离子在自然界不能被降解,很多重金属又具有很高的经济价值,因此重金属废水的处理和回收显得十分重要。对于重金属的回收,马江游等(2003) 指出海藻吸附的重金属离子可用电解质(硫酸或氢氧化物) 或是络合剂(EDTA 等) 来淋洗。Darnall 等(1986) 在研究中指出,藻细胞结合的Au 和Ag 能够被巯基乙醇选择性洗脱。
3 总结
综上所述,藻类可以吸收海水中的重金属,利用这种方法来清除工业污水或是被污染的水体中的有毒、放射性的重金属,并且对贵重金属进行回收再利用。与一些传统方法相比,特别是低浓度金属的处理,这种方法具有高效、经济等优点,具有很高的应用价值(Romera et al,2007)。生物吸收法是一种成本低廉、吸附剂来源丰富、去除效率高的新型处理方法,特别适用于低浓度废水的处理。但是目前已有的应用大多集中于某些经济价值高的金属,而对于相对廉价的金属如Cu、Cd、Zn、Pb 以及一些具有放射性毒害的金属却有所忽略,致使环境中依然存在大量的金属污染,这些现象应引起我们的关注(李志勇等,1997)。吸收的结果会因海藻的种类、金属离子的浓度、温度以及pH 等条件的不同而不同。目前来说,这项技术的最大缺点就是并没有大规模的生产有效的生物吸附剂,这项技术还处于试验阶段,限制了实际应用(Yu et al,1998)。目前,大多数的研究都倾向于研究藻类对单一金属的吸附,而很少对多种离子体系进行研究,但是在多种痕量金属的体系中会产生协同或者是拮抗的作用,这在海洋环境中是十分重要的(Davila,1995)。这有可能会影响藻类的生长,所以在以后的研究中应该更注意金属离子的组合对海水中的藻类的生理学、生物化学以及生态学过程的影响。
Aksu Z,Sag Y,Kutsal T,1992. Kutsal. The biosorption of copper(II)by C.vulgaris and Z.ramigera.Environ.Technol,13:579-586.
Andrade L R,Leal R N,Noseda M,et al,2010.Brown algae overproduce cell wall polysaccharides as a protection mechanism against the heavy metal toxicity.Mar.pollut.Bull,60:1482-1488.
Asbchin S A,Andres Y Y,Gerente C,et al,2008.Biosorption of Cu(Ⅱ)from aqueous solution by Fucus serratus:Surface characterization and sorption mechanisms.Bioresour.Technol,99:6150-6155.
Bargagli R L,Nelli S,Ancora,et al,1996. Elevated cadmium accumulation in marine organisms from Terranova Bay(Antarctica).Polar Biol,16:513-520.
Casiano J M S,Davila M G,Laglera L M,et al,1997. The influence of zinc,aluminum and cadmium on the uptake kinetics of iron by algae.Mar.Chem,59:95-111.
Darnall D W,Greene B,Henzl M T,et al,1986. Selective recovery of Gold and other metal ions from an algal biomass.Environ.Sci.Technol,20:206-208.
Davila M G,1995.The role of phytoplankton cells on the control of heavy metal concentration in seawater.Mar Chem,48:215-236.
Davis T A,Volesky B,Mucci A,2003. A review of biochemistry of heavy metal biosorption by brown algae.Water Res,37:4311-4330.
Farias S,ArisnabarretaS P,Vodopivez C,et al,2002. Levels of essential and potentially toxic trace metals in Antarctic macro algae. Spectrochimica Acta Part B,57:2133-2140.
Figueira M M,Volesky B,Ciminelli V S T,et al. Biosorption of metals in brown seaweed biomass.PII:S0043-1354(99)00120-7.
Ganeli E,Haraldsson C,1993. Can increased leaching of trace metals from acidified areas influence phyto-plankton groethin coastal waters?Ambio,22(5):308-311.
Ghimire K N,Inoue K,Ohto K,et al,2008.Adsorption study of metal ions onto crosslinked seaweed Laminaria japonica. Bioresour Technol,99:32-37.
Greene B R. Mcpherson D,1987. Darnall. Metals speciation,separation and recovery.Chelsea,MI:Lewis,315-338.
Hawari A H,Mulligan C N,2006. Heavy metals uptake mechanisms in a fixed-bed column by calcium-treated anaerobic biomass. Process Biochem,41:187-198.
Herrero R,Cordero B,Lodeiro P,et al,2006.Interactions of cadmium(II)and protons with dead biomass of marine algae Fucus sp.Mar Chem,99:106-116.
Leusch A,Holan Z R,Volesky B,1995.Biosorption of heavy metals(Cd,Cu,Ni,Pb,Zn)by chemically reinforced biomass of marine algae. J.Chem.Technol.Biotechno1,62(3):279-288.
Li L,Liu F,Jing X,et al,2011. Displacement mechanism of binary competitive adsorption for aqueous divalent metal ions onto a novel IDAchelating resin:Isotherm and Kineticmodeling.Water Res,45:1177-1188.
Lin R G,Huang P L,Zhou J L,1999.Study on the adsorption and desorption of copper and cadmium in water on two species of brown algae.Mar.Environ.Sci,18(4):8-13.
Pucci P S,Caimi S,Caroli,et al,1996. The role of Chirocephalus diaphanus in the early recognition of environmental pollution by trace elements.Microchem J,54:412-417.
Quiroz-Vazquez P K N,White D C Sigee,2008.Entry of aluminium,silicon and transition metals into the pelagic food chain:uptake by phytoplankton in a non-polluted eutrphic lake. Hydrobiologia,607:131-142.
Rajfur M,Klos A,Waclawek M,2010. Sorption properties of algae Spirogyra sp. and use for determination of heavy metal ions concentrations in surface water.Bioelectrochemistry,80:81-86.
Romera E,Gonzalez F,Ballester A,et al,2007. Comparative study of biosorption of heavy metals using different types of algae. Bioresour.Technol,98:3344-3353.
Rousch J M,Sommerfeld M R. Effect of manganese and nickel on growth of selected algae in pH buffered medium. PII:S0043-1354(98)00474-6.
Rueter J G,Morel F M M,1982. The interaction between zinc deficiency and copper toxicity as it affects the silicic acid uptake mechanisms in Thalassiosira pseudnana Limnol Oceanogr,26:67-73.
Semeniuk D M,Cullen J T,Johnson W K,et al,2009.Plankton copper requirements and uptake in the subarctic Northeast Pacipic Ocean.Deep-Sea Research I.56:1130-1142.
Senthilkumar R,Vijayaraghavan K,Thilakavathi M,et al,2007.Application of seaweeds for the removal of lead from aqueous solution.Biochem.Eng J,33:211-216.
Senthilkumar S,Bharathi S,Nithyanandhi D,et al,2000. Biosorptin of toxic heavy metals from aqueous solutions. Bioresour Technol,75:163-165.
Sigg L,1987.Surface chemical aspects of the distribution and fate of metal ions in lakes.In:W.Stumm(Editor),Aquatic Surface Chemistry.New York:Wiley,331-350.
Stumm W,Morgan S S,1996. Aquatic chemistry. New York:John Wiley&Sons:614-671.
Sunda W G,1989. Trace metal interactions with marine phytoplankton.Biol.Oceanogr,6:411-442.
Sunda W G,Huntsman S A,1983. Effect of competitive interactions between manganese and copper on cellular manganese and growth in estuarine and oceanic isolates of Thalassiosira pseudnana. Limnol.Oceanogr,28:924-934.
Sunda W G,Huntsman S A,1995a. Iron uptake and growth limitation in oceanic and coasal phytoplankton.Mar.Chem,50:189-206.
Sunda W G,Huntsman S A,1995b. Cobalt and zinc interreplacement in marine phytoplankton:biological and geochemical implications.Limnol.Oceanogr,40:1404-1417.
Sunda W G,Huntsman S A,1996. Antagonisms between cadmium and zinc toxicity and mangannese limitation in a coastal diatom. Limnol.Oceanogr,41(3):373-387.
Tang D,Morel F M M,2006.Distinguishing between cellular and Fe-oxide-associated trace elements in phytoplankton. Mar Chem,98:18-30.
Topcuoglu S,Guven K C,Balkis N,et al,2003.Heavy metal monitoring of marine algae from the Turlish Coast of the Black Sea.Chemosphere,52:1683-1688.
Vasconcelos,M T S D,Leal M F C,2001. Antagonistic interactions of Pb and Cd on Cu uptake,growth inhibition and chelator release in the marine algae Emiliania huxleyi.Mar Chem,75:123-139.
Veglio F,Beolchini F,1997. Removal of metals by biosorption:a review.Hydrometallurgy,44:301-316.
Visvili I,Rachlin J W,1991. The toxic action and interactions of copper and cadmium to the marine algae Dunaliella minuta,in both acute and chronic exposure.Arch.Environ Contam Toxicol,20:271-275.
Wilke A,Bunke G,1999.Removal of Lead,Cadmium,Nickel and Zinc by adsorption on microalgae.Prog.Min.Oilfield Chem,1(4):337-344.
Yu Q,Matheickal J T,Yin P,et al. Heavy metal uptake capacities of common marine macro algal biomass. PII:S0043-1354(98)00363-7.
Zhang W,Robertson J D,Savage M,et al,1997. Use of particle-induced X-Ray emission for evaluation of competitive metal binding on algae.Microchem J,56:403-412.
简建波,邹定辉,刘文华,等,1997.三角褐指藻对铜离子长期暴露的生理响应.海洋通报,29(1):65-71.
孔繁祥,1993.藻类生物在重金属矿物形成中的作用.地质地球化学,21(1):71-73.
李希彬,孙晓燕,牛福新,等,2012.半封闭海湾的水交换数值模拟研究.海洋通报,31(3):248-254.
李志勇,郭祀远,李琳,等,1997.利用藻类去除与回收工业废水中的金属.重庆环境科学,19(6):27-32.
刘浩,戴明新,彭士涛,等,2011.渤海湾主要污染物环境容量的估算.海洋通报,30(4):451-455.
鲁意扬,王颖,尹忠民,2001.大连市近岸海域水质污染类型及趋势研究.海洋通报,20(2):92-96.
陆开形,唐建军,蒋德安,2006.藻类富集重金属的特点及其应用展望.应用生态学报,17(1):118-122.
马江游,黄代城,王睿,2003.重金属离子脱除技术进展.化学工业与工程技术,24(3):8-10.
沈春燕,冯波,卢伙胜,2008.茂名放鸡岛海域水体重金属的分布与污染评价.海洋通报,27(5):116-120.
王丽平,郑丙辉,孟伟,2007.荧蒽与铜对三角褐指藻的单一和联合毒性.海洋通报,26(4):111-114.
